Cząstki subatomowe
Wszystkie pierwiastki składają się z niezwykle małych cząstek materii zwanych atomami. Możemy zdefiniować atom jako najprostszą cząstkę pierwiastka, która posiada właściwości chemiczne tego pierwiastka. Właściwości chemiczne obejmują stan fizyczny pierwiastka (gaz, ciecz lub ciało stałe), rodzaje wiązań, jakie pierwiastek może tworzyć, sposób, w jaki reaguje z innymi pierwiastkami itp. Dlatego wszystkie atomy tworzące pierwiastek węgiel mają takie same właściwości chemiczne.
Fizykom udało się rozsadzić atomy na dziesiątki różnych cząstek subatomowych, jednak tylko 3 z nich są stabilne. Są to protony, neutrony i elektrony. Protony są dodatnio naładowanymi cząstkami, mają masę i znajdują się w centrum, czyli w jądrze atomu. Neutrony nie mają ładunku, mają masę i również znajdują się w jądrze atomu. Neutrony łączą się z protonami w sposób, który pomaga stabilizować jądro. Zbyt wiele lub zbyt mało neutronów może spowodować, że jądro atomowe będzie niestabilne i może rozpadać się tworząc inne pierwiastki. Takie atomy określamy jako radioaktywne. Chociaż masa neutronu jest nieco większa od masy protonu, możemy im obu przypisać masę względną 1 (1 atomowa jednostka masy lub amu). Neutrony i protony stanowią prawie całą masę atomu. Trzecim rodzajem stabilnej cząstki jest elektron. Elektrony posiadają ładunek ujemny, ale są niezwykle małe i mają masę zaledwie 1/1850 masy protonu lub neutronu. Są one tak małe, że dla celów praktycznych nie wnoszą nic do masy atomu. Elektrony poruszają się wokół jądra z ogromnymi prędkościami, w rzeczywistości podróżują z prędkością bliską prędkości światła. Chociaż często opisujemy elektrony jako krążące po orbitach wokół jądra, jak planety krążące wokół słońca, współczesna fizyka uczy nas, że ten model jest błędny. Te „orbity” są w rzeczywistości obszarami w przestrzeni wokół jądra, gdzie elektrony będą się znajdować przez większość czasu. Obszar ten jest często określany jako „chmura” elektronowa. To prawda, że jest to nadal określony obszar, ale jest on nieco bardziej amorficzny niż orbita sferyczna. Dla uproszczenia jednak, często myślimy o nich jako o podobnych do satelitów orbitach kołowych. Poniższy obrazek przedstawia nasz obecny model atomu azotu.
Jądro azotu zawiera 7 protonów (pomarańczowy) i 7 neutronów (zielony). Zacienione obszary wokół jądra reprezentują orbitale elektronowe (chmury). Elektrony (niebieskie) znajdą się gdzieś w obrębie tych orbitali. (Uwaga: obrazek nie jest narysowany w odpowiedniej skali. Zasugerowano, że gdyby jądro było wielkości piłki do koszykówki, elektrony byłyby oddalone o około sześć kilometrów lub 3¾ mili!)
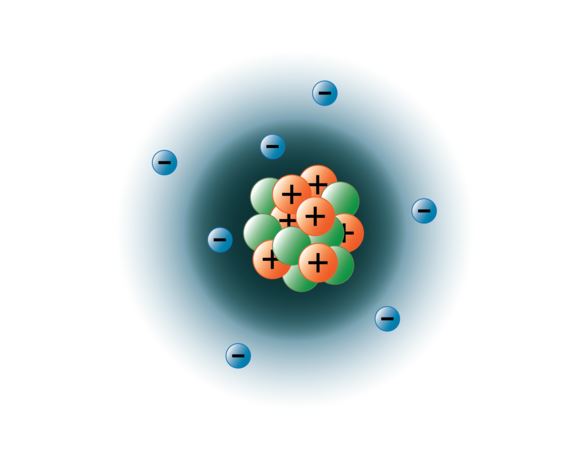
image created by BYU-I student Hannah Crowder Fall 2013
Atomic Number
Przyjrzyjrzyjrzyjrzyj się ponownie układowi okresowemu i zauważ liczbę u góry każdego pola. Liczba ta jest liczbą atomową dla danego elementu i jest unikalna dla każdego elementu. Na przykład, liczba atomowa wodoru wynosi 1. Żaden inny pierwiastek nie ma liczby atomowej 1. Dla węgla liczba atomowa wynosi 6 i, ponownie, żaden inny pierwiastek nie ma liczby atomowej 6. Znaczenie liczby atomowej jest takie, że mówi nam ona o liczbie protonów w jądrze każdego pierwiastka. Dlatego wszystkie atomy wodoru mają 1 proton, a wszystkie atomy węgla mają 6 protonów. Ponadto, ponieważ atomy mają ładunek neutralny, liczba atomowa mówi nam również o liczbie elektronów w atomie. W notacji chemicznej liczba atomowa dla danego pierwiastka jest wyrażona jako indeks dolny poprzedzający symbol pierwiastka. Na przykład węgiel będzie wyrażony jako 6C.
Liczba masowa (masa atomowa)
Liczba masowa atomu, jak sama nazwa wskazuje, mówi o całkowitej masie atomu. Ponieważ masa elektronu jest bardzo mała (pomijalna), nie jest on używany do obliczania liczby masowej. Należy również pamiętać, że masa każdego protonu i każdego neutronu wynosi 1 atomową jednostkę masy. Zatem liczba masowa jest sumą protonów i neutronów w atomie. Ponieważ liczba masowa to liczba protonów plus liczba neutronów, a liczba atomowa to liczba protonów, możesz znaleźć liczbę neutronów odejmując po prostu liczbę atomową od liczby masowej. Jako przykład załóżmy, że mamy pierwiastek o liczbie atomowej 8 i liczbie masowej 17. Z tych informacji można wywnioskować, że ten pierwiastek ma 8 protonów, 8 elektronów i 9 neutronów (17-8=9). Teraz pozwólcie, że rzucę wam krzywą piłkę. Jak wspomniano powyżej, wszystkie atomy danego pierwiastka mają taką samą liczbę protonów (liczbę atomową), jednak różne atomy danego pierwiastka mogą mieć różną liczbę neutronów. Mówimy, że są to różne izotopy danego pierwiastka. Na przykład, istnieją trzy izotopy wodoru. Najbardziej rozpowszechniony izotop, stanowiący 99,98% wszystkich atomów wodoru, ma liczbę masową 1. Składa się więc z 1 protonu, żadnego neutronu i jednego elektronu. Pozostałe, mniej rozpowszechnione izotopy wodoru mają numery masowe odpowiednio 2 i 3. Izotopy te różnią się liczbą neutronów w swoich jądrach, ale wszystkie trzy mają jeden proton i jeden elektron. W rzeczywistości istnieją naturalnie występujące izotopy każdego pierwiastka, z których każdy ma swoją unikalną liczbę masową. W notacji chemicznej liczba masowa dla danego izotopu jest wyrażona jako indeks górny poprzedzający symbol pierwiastka. Trzy izotopy wodoru zostałyby wyrażone jako 1H, 2H i 3H. Ponieważ każdy pierwiastek składa się z kilku izotopów, nasuwa się jedno pytanie: „jaka jest rzeczywista masa danego pierwiastka?”. Ponownie, jeśli spojrzysz na powyższy układ okresowy, zauważysz liczbę w dolnej części każdego pola. Jest to masa atomowa danego pierwiastka. Na przykład masa atomowa wodoru wynosi 1,00794 amu. Liczba ta została uzyskana poprzez obliczenie średniej masy 3 izotopów wodoru. Na przykład, załóżmy, że mamy 10 chłopców w naszej klasie. Gdybyśmy chcieli poznać średnią wagę chłopców, dodalibyśmy ich indywidualne wagi razem, a następnie podzielili sumę przez 10. To dałoby nam ich średnią wagę. To jest zasadniczo sposób, w jaki określane są masy atomowe. Ponieważ 1H jest najobficiej występującym izotopem wodoru, ma sens, że masa atomowa dla wodoru jest bardzo zbliżona do masy atomowej 1H.
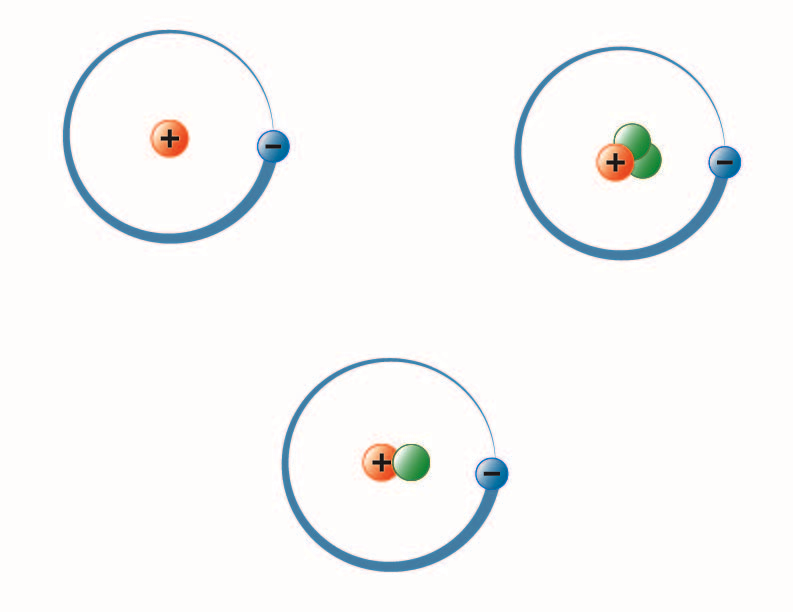
image created by BYU-I student Hannah Crowder Fall 2013
Obraz powyżej przedstawia trzy izotopy wodoru. Najbardziej powszechny (górny lewy) ma jeden proton i żadnych neutronów w jądrze. Deuter (na dole) ma jeden proton i jeden neutron, a tryt (na górze po prawej) ma jeden proton i dwa neutrony.
**Możesz użyć poniższych przycisków, aby przejść do następnego lub poprzedniego czytania w tym module**

