1 – Definicja
ARVD jest chorobą mięśnia sercowego związaną z komorowymi zaburzeniami rytmu i nagłą śmiercią. Charakteryzuje się strukturalnymi i funkcjonalnymi nieprawidłowościami prawej komory spowodowanymi zastąpieniem mięśnia sercowego przez tkankę tłuszczową i włóknistą. Miejsca zajęcia nieprawidłowości anatomicznych znajdują się w tzw. trójkącie dysplazji (obszary podwsierdziowe prawej komory, koniuszek i infundibulum)(4).
Arrytmogenna dysplazja prawej komory (ARVD) jest chorobą dziedziczną, typowo dziedziczoną jako cecha autosomalna dominująca o zmiennej penetracji i niepełnej ekspresji(1). Istnieje autosomalny recesywny wariant związany z rogowaceniem dłoni i włosów zwany chorobą Naxos.
2 – Częstość występowania
Częstość występowania w populacji ogólnej wynosi w przybliżeniu od 1:2500 do 1:5000
Niemniej jednak zależy ona od warunków geograficznych, na przykład w niektórych regionach Włoch (Padwa, Wenecja) i Grecji (wyspa Naxos) częstość występowania jest zwiększona(2). Stanowi od 5% do 10% niewyjaśnionych nagłych zgonów sercowych u osób poniżej 65 roku życia(3).
Występuje u młodych dorosłych, a stosunek liczby mężczyzn do liczby kobiet wynosi 2,7/1. Po chorobie przerostowej serca jest to najważniejsza przyczyna nagłych zgonów sercowych u młodych ludzi.
3 – Diagnostyka
Diagnostyka ARVD jest często trudna, ponieważ nie ma jednego testu. Diagnoza opiera się na obecności czynników strukturalnych, histologicznych, elektrokardiograficznych i genetycznych zgodnie z raportem grupy zadaniowej McKenna i wsp. z 1994 roku (5) (tabela 1) oraz modyfikacją grupy zadaniowej Homid i wsp. z 1994 roku (6) (tabela 2) w celu zwiększenia czułości diagnostycznej członków rodziny pierwszego stopnia dla wczesnego wykrywania choroby.
A) Wywiad kliniczny
Po pierwsze, zaczniemy od łatwiejszego narzędzia, czyli wywiadu klinicznego.
Prezentacja kliniczna jest różna, od form bezobjawowych do kołatania serca, zmęczenia, omdleń, a nawet zatrzymania akcji serca, zwykle podczas wysiłku. Objawy te wynikają z komorowych pobudzeń ektopowych, utrwalonego częstoskurczu komorowego o konfiguracji bloku lewej odnogi pęczka Hisa lub niewydolności prawokomorowej(4).
W historii naturalnej tej choroby możemy wyróżnić cztery etapy(7):
a) faza wczesna lub cicha, jest to faza subkliniczna z ukrytymi nieprawidłowościami strukturalnymi
b) faza niestabilna z zaburzeniami elektrycznymi
c) faza niewydolności prawej komory
d) faza końcowa z postępującą niewydolnością obu komór, imitująca kardiomiopatię rozstrzeniową
B) Badanie diagnostyczne
1.- Elektrokardiogram
W kryteriach rozpoznania ARVD wyróżnia się kilka cech EKG:
a) inwersja załamka T w odprowadzeniach V1 do V3 (pomniejsze kryterium diagnostyczne, ale jedna z najczęstszych nieprawidłowości EKG występująca u 85% pacjentów (8)
b) czas trwania zespołu QRS = 110 ms w odprowadzeniach V1 do V3
c) fala Epsilon (potencjały elektryczne po zakończeniu zespołu QRS). Jest to główne kryterium diagnostyczne stwierdzane nawet w 30% przypadków ARVD.
Opisano również inne markery EKG ARVD: dyspersja QRS i QT, blok ciemieniowy definiowany jako czas trwania zespołu QRS w odprowadzeniach od V1 do V3, który przekracza czas trwania zespołu QRS w odprowadzeniu V6 o > 25 ms, wydłużony skok fali S w odprowadzeniach od V1 do V3 = 55 ms (był on postrzegany jako najbardziej rozpowszechniona cecha EKG w 95% przypadków ARVD8
2.- Obrazowanie mięśnia sercowego
2.1 Echokardiografia
Jest to najczęściej stosowana nieinwazyjna technika obrazowania, ale nie zawsze jest optymalną techniką obrazowania u pacjentów otyłych i z rozedmą płuc.
Echokardiografia jest wstępną metodą diagnostyczną u pacjentów, u których podejrzewa się ARVD. Główne wyniki to (9):
– poszerzenie i hipokinezja prawej komory
– izolowane poszerzenie drogi odpływu prawej komory
– zwiększona refleksyjność pasma moderatora
– tętniaki końcoworozkurczowe
– akineza-dyskineza segmentu dolnego i koniuszka prawej komory
– wydatne trabekule koniuszkowe
2.2 Angiografia kontrastowa prawej komory
Ta technika jest uważana za standard odniesienia w diagnostyce ARVD (10). Obejmuje ona obszary akinetyczno-dyskinetyczne zlokalizowane w trójkącie anatomicznym dysplazji. Jednak ze względu na inwazyjną technikę, ekspozycję na promieniowanie rentgenowskie, zmienność międzyobserwacyjną, metoda ta nie jest szeroko stosowana (9).
2.3 Tomografia komputerowa
Tomografia komputerowa jest w stanie zdiagnozować pacjentów z ARVD. Dery i wsp.11, jako pierwsi wykazali poszerzoną hipokinetyczną prawą komorę u pacjenta z ARVD.
Wskazania do rozpoznania ARVD w tomografii komputerowej z wiązką elektronów to7:
– obecność nasierdziowych lub wewnątrzsercowych złogów tłuszczu
– wyraźne trabekulacje o niskiej atenuacji
– poszerzona, hipokinetyczna prawa komora
– łuskowaty wygląd ściany prawej komory
Obecnie tomografia komputerowa nie jest opcjonalną metodą obrazowania w ramach wstępnych badań przesiewowych ze względu na duże obciążenie promieniowaniem.
Rezonans magnetyczny (MR) jest doskonałym narzędziem obrazowania prawej komory, pozwala na trójwymiarową ocenę anatomii komory, jej objętości, a w porównaniu z innymi technikami pozwala lepiej rozpoznać zastąpienie tkanki tłuszczowej i włóknistej mięśnia sercowego, chociaż naciek tłuszczowy w prawej komorze nie jest wyłączną cechą ARVD, ponieważ występuje w ponad 50% prawidłowych serc u osób starszych. Jednak obecność nadnamiotowej wymiany tkanki tłuszczowej lub rozsianego ścieńczenia miokardium prawej komory należy uznać za główne kryterium rozpoznania ARVD.
MR można również wykorzystać do oceny funkcji zarówno skurczowej, jak i rozkurczowej. W kilku badaniach zwrócono uwagę na obecność dysfunkcji rozkurczowej prawej komory jako wczesnego markera choroby (12)
Typowe kryteria, które można wykazać za pomocą MR to:
– obecność obszarów o wysokiej intensywności sygnału wskazujących na zastępowanie miokardium przez tłuszcz (główne kryterium)
– zastępowanie włókniste, które prowadzi do rozproszonego ścieńczenia miokardium prawej komory (główne kryterium)
– tętniak prawej komory i drogi odpływu prawej komory (główne kryterium)
– poszerzenie prawej komory i drogi odpływu prawej komory (gdy ciężkie, główne kryterium;
– regionalne zaburzenia kurczliwości (kryterium drugorzędowe)
– globalna dysfunkcja skurczowa (kryterium główne) i globalna dysfunkcja rozkurczowa (kryterium drugorzędowe)
Rezonans magnetyczny serca dostarcza ważnych kryteriów anatomicznych, morfologicznych, czynnościowych i przepływowo-dynamicznych do rozpoznania ARVD, chociaż rozpoznanie ARVD musi być oparte na kryteriach Task Force, a nie tylko na nieprawidłowościach strukturalnych.
2.5 Biopsja endomiokardialna
Diagnostyka histologiczna jest ostateczna, jednak biopsja endomiokardialna jest kontrowersyjna ze względu na segmentowy charakter choroby, a próbki są zwykle uzyskiwane z przegrody międzykomorowej (13). Mogą wystąpić powikłania, takie jak tamponada i perforacja.
4 – Postępowanie z pacjentami z ARVD
Przed leczeniem musimy znać predyktory śmiertelności i stratyfikację ryzyka. W badaniu Hulota i wsp. (14) stwierdzono, że co najmniej 1 epizod częstoskurczu komorowego w bloku lewej odnogi pęczka Hisa, kliniczne objawy niewydolności prawej komory i dysfunkcja lewej komory wiązały się ze zgonami z przyczyn sercowo-naczyniowych.
Problem polega na tym, że pojawienie się nagłego zgonu nie jest związane z progresją choroby, a nagły zgon może być pierwszą manifestacją choroby.
1.- Leki antyarytmiczne
Leki antyarytmiczne są początkową i najczęściej stosowaną terapią. Środki blokujące receptory beta-adrenergiczne są zalecane w celu zmniejszenia arytmii stymulowanej adrenergicznie.
Najbardziej skutecznym lekiem jest sotalol. Sotalol był skuteczniejszy niż beta-blokery i amiodaron u pacjentów z indukowalnym i nieindukowalnym częstoskurczem komorowym (VT) podawanym w dawkach od 320 do 480 mg/dobę (sotalol zapobiegał VT podczas programowanej stymulacji komorowej u 68%, podczas gdy amiodaron u 26%, klasa Ia i Ib u 5,6%, a klasa Ic tylko u 3% pacjentów). (15).
2.- Ablacja cewnikowa
Ablacja prądem o częstotliwości radiowej (RF) jest stosowana w przypadkach oporności/nietolerancji leków lub nieustannego częstoskurczu komorowego. Celem ablacji RF jest usunięcie dróg przewodzenia. Całkowity sukces ablacji RF występuje jedynie w 30-65% przypadków. Ze względu na postępujący i rozproszony charakter choroby trudno jest zlikwidować liczne ogniska arytmogenne16.
Podłoże patologiczne jest rejestrowane podczas badania elektrofizjologicznego jako niskoamplitudowy, frakcjonowany sygnał wsierdzia odzwierciedlający zmniejszenie lokalnej prędkości przewodzenia wsierdziowego7.
3.- Terapia za pomocą wszczepialnego kardiowertera-defibrylatora
Pacjenci uznani za grupę wysokiego ryzyka nagłego zgonu sercowego powinni otrzymać wszczepialny kardiowerter-defibrylator (implantable cardioverter-defibrillator, ICD). Są to osoby, które 1) były reanimowane z zatrzymania krążenia z omdleniami w wywiadzie, 2) mają zagrażające arytmie, które nie są całkowicie stłumione przez terapię lekami antyarytmicznymi oraz 3) z wywiadem rodzinnym w kierunku zatrzymania krążenia u krewnych pierwszego stopnia (prewencja pierwotna).
ICD działają poprzez zapewnienie stymulacji antytachykardyjnej i defibrylacji w przypadku wystąpienia arytmii.
Terapia za pomocąICD jest wykonalna i bezpieczna u pacjentów z ARVD z niską częstością występowania krótko- i długoterminowych powikłań. Narzędzie to odgrywa ważną rolę w leczeniu arytmii komorowych, ponad trzy czwarte pacjentów z ARVD otrzymało odpowiednią terapię ICD podczas średnio 3,5-letniej obserwacji (17)
Mogą jednak wystąpić powikłania terapii ICD w wyniku zastąpienia miokardium prawej komory przez tkankę tłuszczową i włóknistą. Należą do nich perforacja spowodowana ścieńczeniem ściany prawej komory, trudności z umieszczeniem elektrody w związku z nieodpowiednimi amplitudami załamka R lub wysokimi progami stymulacji, nieodpowiednie wykrywanie lub stymulacja w trakcie obserwacji wynikające z progresji choroby oraz brak zakończenia arytmii komorowych w związku z rosnącymi progami defibrylacji (18).
4.- Leczenie niewydolności serca
W przypadku wystąpienia niewydolności prawokomorowej lub obukomorowej leczenie polega na stosowaniu aktualnej terapii niewydolności serca, w tym diuretyków, beta-blokerów, inhibitorów konwertazy angiotensyny i leków przeciwzakrzepowych.
Curative therapy in case of refractory congestive heart failure and/or arrhythmias is cardiac transplantation.
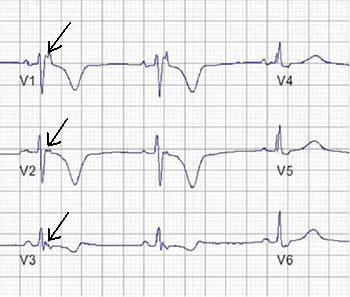
Ryc. 1. Zapis poekscytacyjnej fali epsilon (strzałki) w prawych odprowadzeniach przedsercowych.
Rycina 2. 12-odprowadzeniowy zapis EKG VT o morfologii bloku lewej odnogi pęczka Hisa
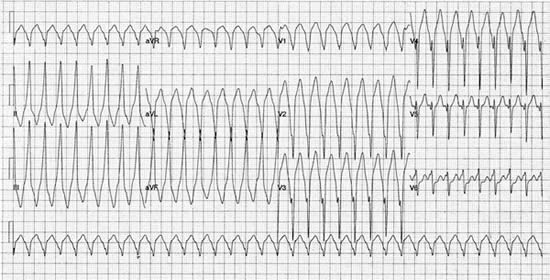
Tabela 1. Kryteria rozpoznania dysplazji prawej komoryI Globalna i/lub regionalna dysfunkcja i zmiany strukturalne
| Major | Szerokie poszerzenie i obniżenie frakcji wyrzutowej prawej komory przy braku (lub tylko łagodnym) upośledzeniu funkcji LV |
| Lokalizowane tętniaki prawej komory (akinetyczne lub dyskinetyczne obszary z rozkurczowym wybrzuszeniem) | |
| Szerokie segmentalne poszerzenie prawej komory | |
| Małe | Łagodne globalne poszerzenie prawej komory i/lub obniżenie frakcji wyrzutowej przy prawidłowej lewej komorze |
| Łagodne segmentalne poszerzenie prawej komory | |
| Regionalna hipokinezja prawej komory |
II Charakterystyka tkankowa ścian
.
| Duża | Włóknista wymiana miokardium w biopsji endomiokardialnej |
III Zaburzenia repolaryzacji
| Mała | Odwrócone załamki T w prawych odprowadzeniach przedsercowych (V2 i V3) u osób w wieku powyżej 12 rż; w przypadku braku bloku prawej odnogi pęczka Hisa |
IV Zaburzenia depolaryzacji/przewodzenia
| Dużo | Fale Epsilon lub miejscowe wydłużenie (>110 ms) zespołu QRS w prawych odprowadzeniach przedsercowych (V1-V3) |
| Minor | Potencjały późne (sygnał uśredniony EKG) |
V Arytmie
| Minor | Tachykardia komorowa typu bloku lewej odnogi pęczka Hisa (podtrzymywana i niepodtrzymywana) (EKG, Holter, próba wysiłkowa). |
| Częste ekstrasystole komorowe (ponad 1000/24h) |
VI Wywiad rodzinny
| Duża | Choroba rodzinna potwierdzona podczas sekcji zwłok lub zabiegu chirurgicznego |
| Minor | Przedwczesna nagła śmierć w wywiadzie rodzinnym (< 35 lat) spowodowana podejrzeniem dysplazji prawej komory. |
| Historia rodzinna (rozpoznanie kliniczne na podstawie obecnych kryteriów) |
Tabela 2. Proponowana modyfikacja Task Force dla rozpoznania rodzinnej ARVD
ARVD u krewnego pierwszego stopnia plus jedno z poniższych:
| 1.- EKG | Odwrócenie załamka T w prawym odprowadzeniu przedsercowym (V2 i V3) |
| 2.- SAECG | Późne potencjały widoczne w EKG z uśrednieniem sygnału (SAECG) |
| 3.- Arytmia | LBBB typu VT w EKG, monitorowaniu holterowskim lub podczas prób wysiłkowych. Extrasystole > 200 w okresie 24 godzin |
| 4.- Strukturalne lub czynnościowe nieprawidłowości RV | Łagodne globalne poszerzenie RV i/lub obniżenie EF przy prawidłowej LV Łagodne segmentalne poszerzenie RV Regionalna hipokinezja RV |
Treść tego artykułu odzwierciedla osobistą opinię autora/autorów i niekoniecznie jest oficjalnym stanowiskiem Europejskiego Towarzystwa Kardiologicznego
.