Komórki regulatorowe (Tregs), dawniej znane jako komórki supresorowe T, są podzbiorem komórek T z bezpośrednią rolą zarówno w autoimmunologii jak i odpowiedzi na patogeny.
Tregs zmniejszają stan zapalny poprzez wydzielanie cytokin immunosupresyjnych (IL-10, TGF-b), a także poprzez bezpośrednią supresję efektorowych komórek T zapalnych (takich jak komórki Th1 i Th17).
Tregs kontrolują i prawdopodobnie zapobiegają chorobom autoimmunologicznym poprzez przyczynianie się do utrzymania tolerancji na autoantygeny. Korzyści terapeutyczne wynikające z transferu Treg są dobrze ugruntowane w modelach zwierzęcych, a wysiłki zmierzające do rozpoczęcia terapii Treg u ludzi są w toku w odniesieniu do transplantacji i pacjentów z cukrzycą typu 1.
Zważywszy na znaczenie tego unikalnego podzbioru komórek T w tak wielu reakcjach immunologicznych, wielu badaczy czuje się zaniedbanych, jeśli immunofenotypują swoje populacje komórek bez uwzględnienia pomiaru Treg w mieszaninie. Ale kwantyfikacja Treg może być skomplikowana.
Na przykład – Jakie są najlepsze markery do użycia? Skąd masz pewność, że mierzysz prawdziwe supresorowe limfocyty T?
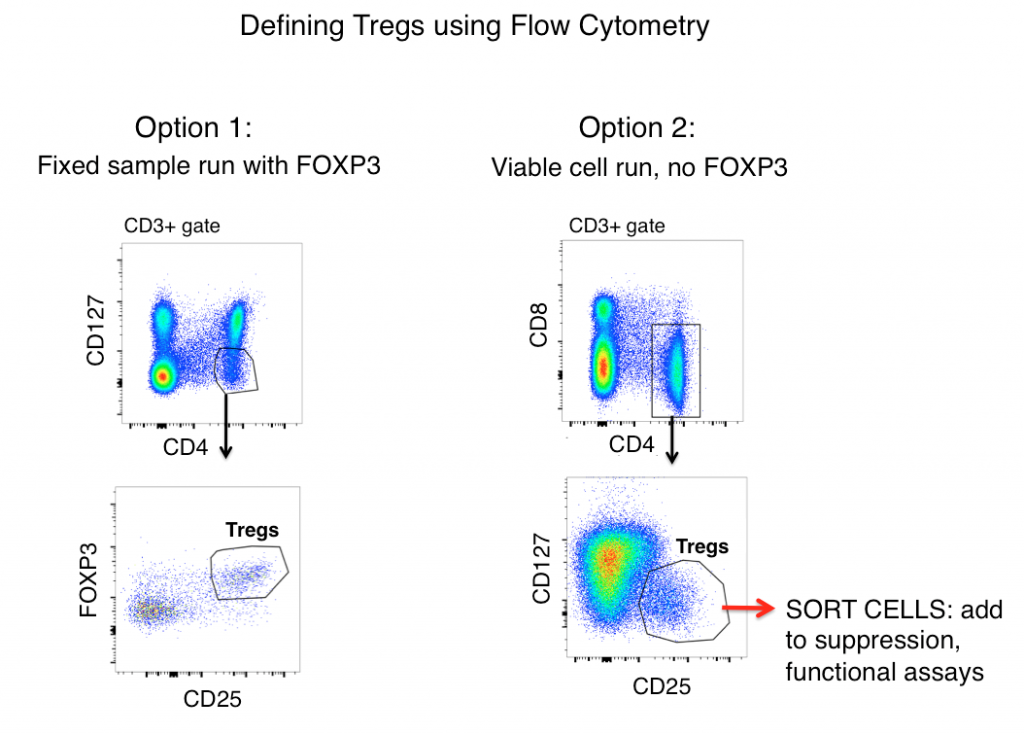
Strategie bramkowania do definiowania Tregów za pomocą cytometrii przepływowej
Standardowa strategia bramkowania Tregów zarówno dla próbek mysich, jak i ludzkich (po uprzednim wykluczeniu podwójnych bramek i bramkowaniu na żywych komórkach) obejmuje antygeny CD3, CD4, CD25, FOXP3 i CD127.
Patrząc wyłącznie na ekspresję antygenów, Tregs są często definiowane jako CD3+, CD4+, CD25hi, FOXP3+, i CD127lo (pokazane na rysunku poniżej jako opcja 1). Używając tych markerów, wyraźna populacja jest często widoczna w próbkach takich jak splenocyty myszy i ludzkie PBMC.
Jednakże, aktywowane komórki T często zwiększają regulację CD25, a ekspresja FOXP3 została znaleziona na „efektorowych” (nie supresyjnych) liniach komórek T. Dlatego też, gdy polegamy na samym fenotypowaniu za pomocą cytometrii przepływowej w celu zdefiniowania Tregs, zapalne komórki T mogą być wilkiem w owczej skórze (Treg) i prowadzić do nieprawidłowej interpretacji danych.
Komórka może wyglądać jak kaczka, ale czy kwacze? Pomiar funkcji efektorowych Twojej potencjalnej populacji Treg pomoże w znacznym stopniu wyjaśnić dokładność Twojej strategii bramkowania przepływu. W celu określenia czy komórki, które definiujesz jako Tregs funkcjonalnie je przypominają, Opcja 2 (patrz poniżej) obejmuje pominięcie FOXP3 z panelu, sortowanie komórek CD3+, CD4+, CD25hi, CD127lo, a następnie określenie funkcji Twojej populacji „Treg” poprzez analizę cytokin i / lub testy ko-kultury supresyjnej z nietregowymi komórkami T (CD3+ CD4+ CD25-, CD127hi). Zazwyczaj FOXP3 nie może być włączony do paneli, w których po sortowaniu wymagane są komórki żywotne, ponieważ wymagane jest barwienie wewnątrzkomórkowe.
Defining The Increasing Variety Of Treg Subsets
Istnieje wiele rodzajów Tregs, w tym tTregs, pTregs i iTregs.
Na przykład, tTregs (znane również jako nTregs) są generowane w grasicy i mają repertuar TcR, który jest ukierunkowany na autopeptydy. Inny smak, znany jako pTregs, jest generowany na peryferiach, a iTregs są indukowane w kulturze przez TGF-b.
Istnieją makery związane z tymi różnymi podzbiorami Treg i należy je rozważyć w celu włączenia do panelu antyciał Treg, jeśli ich podzbiór jest przedmiotem zainteresowania. Na przykład, u ludzi, CD39 jest uważany za wiarygodny marker tTreg. Ponadto, zarówno u myszy, jak i u ludzi, stwierdzono, że Helios niezawodnie odróżnia tTreg od podgrup p i iTreg.
Definiowanie pojedynczej komórki jako Treg – czy to możliwe?
Głównym ograniczeniem w dziedzinie Treg jest brak testów supresji pojedynczej komórki.
Definiowanie pojedynczej komórki T jako członka odrębnej linii pamięci, takiej jak Th1, Th2 lub Th17, można osiągnąć poprzez analizę analitów z rozdzielczością pojedynczej komórki, taką jak wewnątrzkomórkowe barwienie cytokin, ponieważ komórki te są głównie, jeśli nie wyłącznie, definiowane przez to, jakie cytokiny wytwarzają.
Jednakże, aby wykazać, że pojedyncza komórka jest Treg, idealnie chcielibyśmy być w stanie określić ilościowo, że ta jedna wybrana komórka może tłumić funkcję efektorowych komórek T (lub innych podzbiorów komórek) we współkulturze. Obecnie jedynym sposobem badania funkcji supresyjnej Treg jest hodowla masowa, w której można stwierdzić, że niektóre (ale nie wszystkie, być może nawet nie większość) komórek oznaczonych jako Tregs są supresyjne.
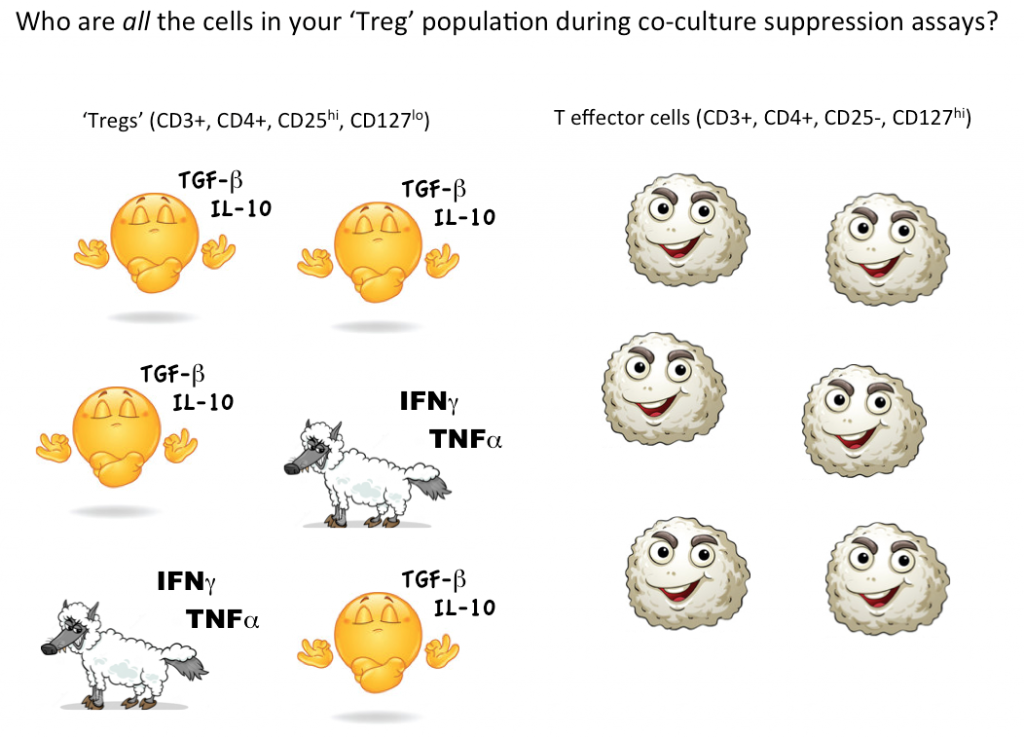
Myśląc ponownie o potencjalnych wilkach 'efektorowych komórek T’ w owczej skórze, po prostu nie wiemy ile nie supresyjnych, a nawet zapalnych komórek ukrywa się w naszej strategii bramkowania Treg. Użycie cytometrii przepływowej do pierwszego bramkowania i sortowania zdolnych do życia komórek z markerami zgodnymi z Tregs, a następnie testowanie funkcjonalne, aby zobaczyć, czy jako grupa, komórki zdefiniowane przez strategię bramkowania rzeczywiście działają jak Tregs, jest obecnie najlepszym sposobem na ilościowe określenie Tregs w próbce.
Wykonując właściwe strategie bramkowania do definiowania Tregs przez cytometrię przepływową i rozliczając się z rosnącą liczbą podzbiorów Treg, można wyodrębnić interesujące nas populacje Treg. Kluczem jest funkcjonalne przetestowanie tych populacji po ich zidentyfikowaniu, ponieważ obecnie zdefiniowanie pojedynczej komórki jako Treg jest trudne, jeśli nie niemożliwe. Jednakże, postępy są czynione codziennie i w końcu prawidłowe oznaczanie pojedynczych komórek Treg będzie możliwe.
Aby dowiedzieć się więcej o analizie komórek T i innych typów komórek za pomocą cytometrii przepływowej i uzyskać dostęp do wszystkich naszych zaawansowanych materiałów, w tym 20 filmów szkoleniowych, prezentacji, podręczników i członkostwa w prywatnych grupach, wpisz się na listę oczekujących na Flow Cytometry Mastery Class.
 .
.