Nazwa ogólna: naftifine hydrochloride
Postać dawkowania: krem
Medically reviewed by Drugs.com. Ostatnia aktualizacja w dniu 1 stycznia 2021.
- Przegląd
- Skutki uboczne
- Dawkowanie
- Profesjonaliści
- Ciąża
- Więcej
Wskazania i stosowanie Naftifine Cream
Naftifine hydrochloride cream jest wskazany w leczeniu grzybicy międzypalcowej stóp, tinea cruris, i tinea corporis wywołanych przez organizm Trichophyton rubrum.
Naftifine Cream Dawkowanie i sposób podawania
Wyłącznie do stosowania miejscowego. Krem z chlorowodorkiem naftyfiny nie jest przeznaczony do stosowania okulistycznego, doustnego ani dopochwowego. Nakładać cienką warstwę kremu chlorowodorku naftifiny raz na dobę na miejsca chorobowo zmienione plus ½ cala marginesu zdrowej otaczającej skóry przez 2 tygodnie.
Postacie dawkowania i moc
Każdy gram zawiera 20 mg chlorowodorku naftifiny (2%) w białej do białawej bazie.
Przeciwwskazania
Brak
Ostrzeżenia i środki ostrożności
Lokalne działania niepożądane
Przerwać leczenie, jeśli podczas stosowania kremu chlorowodorku naftifiny wystąpi podrażnienie lub nadwrażliwość. Należy poinformować pacjentów, aby skontaktowali się z lekarzem, jeśli takie objawy wystąpią po zastosowaniu kremu chlorowodorku naftifiny.
Działania niepożądane
Doświadczenia z badań klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo zróżnicowanych warunkach, częstości występowania działań niepożądanych obserwowanych w badaniach klinicznych danego leku nie można bezpośrednio porównywać z częstościami obserwowanymi w badaniach klinicznych innego leku i mogą one nie odzwierciedlać częstości obserwowanych w praktyce klinicznej.
Podczas badań klinicznych 903 osoby były narażone na działanie naftifiny w postaci kremu 1% i 2%. Łącznie 564 osoby z grzybicą międzypalcową, grzybicą skóry lub grzybicą ciała były leczone naftifiny chlorowodorkiem w kremie.
W dwóch randomizowanych badaniach kontrolowanych nośnikiem (400 osób było leczonych naftifiny chlorowodorkiem w kremie). Populacja była w wieku od 12 do 88 lat, głównie mężczyźni (79%), 48% rasy kaukaskiej, 36% rasy czarnej lub afroamerykańskiej, 40% rasy latynoskiej lub latynoskiej i miała przeważnie grzybicę międzypalcową lub grzybicę stóp. Większość uczestników otrzymywała dawki raz dziennie, miejscowo, przez 2 tygodnie, aby pokryć chorobowo zmienione obszary skóry plus ½ cala marginesu otaczającej zdrowej skóry. W dwóch badaniach kontrolowanych z zastosowaniem nośnika, u 17,5% osób leczonych kremem chlorowodorku naftifiny wystąpiły działania niepożądane w porównaniu z 19,3% osób, u których stosowano nośnik. Najczęstszym działaniem niepożądanym (większym lub równym 1%) jest świąd. Większość działań niepożądanych miała łagodne nasilenie. Częstość występowania działań niepożądanych w populacji leczonej kremem chlorowodorku naftifiny nie różniła się istotnie od częstości w populacji leczonej nośnikiem.
W trzecim randomizowanym badaniu kontrolowanym nośnikiem, 116 pacjentów pediatrycznych z grzybicą skóry było leczonych kremem chlorowodorku naftifiny. Populacja była w wieku od co najmniej 2 do mniej niż 18 lat (średni wiek 9 lat), z przewagą mężczyzn (61%), 47% rasy białej, 51% rasy czarnej lub afroamerykańskiej, 92% rasy hiszpańskiej lub latynoskiej, zakażonych grzybicą skóry. Chlorowodorek naftyfiny w kremie stosowano miejscowo raz na dobę przez 2 tygodnie na wszystkie dotknięte grzybicą skóry powierzchnie ciała oraz ½ cala marginesu zdrowej skóry wokół dotkniętych zmian. Częstość występowania działań niepożądanych w populacji leczonej kremem chlorowodorku naftifyny nie różniła się istotnie od częstości występowania działań niepożądanych w populacji leczonej nośnikiem.
W dwóch otwartych pediatrycznych badaniach farmakokinetyki i bezpieczeństwa stosowania, 49 dzieci w wieku od 2 do mniej niż 18 lat z grzybicą stóp, grzybicą stóp i grzybicą skóry otrzymywało krem chlorowodorku naftifyny. Częstość występowania działań niepożądanych w populacji pediatrycznej była podobna do obserwowanej w populacji dorosłych.
Doświadczenie po wprowadzeniu do obrotu
Zidentyfikowano następujące działania niepożądane podczas stosowania chlorowodorku naftifiny po zatwierdzeniu produktu leczniczego: zaczerwienienie/podrażnienie, zapalenie, maceracja, obrzęk, pieczenie, pęcherze, surowiczy drenaż, tworzenie się strupów, ból głowy, zawroty głowy, leukopenia, agranulocytoza.
Ponieważ reakcje te są zgłaszane dobrowolnie przez populację o niepewnej wielkości, nie zawsze jest możliwe wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
STOSOWANIE W POSZCZEGÓLNYCH POPULACJACH
Ciąża
Podsumowanie ryzyka
Brak jest dostępnych danych dotyczących stosowania naftifiny chlorowodorku kremu u kobiet w ciąży, które informowałyby o związanym z lekiem ryzyku wystąpienia poważnych wad wrodzonych i poronienia. W badaniach nad reprodukcją u zwierząt nie zaobserwowano szkodliwego wpływu na rozwój zarodka w przypadku dawek doustnych podawanych w okresie organogenezy do 18-krotności maksymalnej zalecanej dawki u ludzi (MRHD) u ciężarnych szczurów lub dawek podskórnych podawanych w okresie organogenezy do 2-krotności MRHD u ciężarnych szczurów lub 4-krotności MRHD u ciężarnych królików .
Oszacowane ryzyko tła poważnych wad wrodzonych i poronienia dla wskazanej populacji jest nieznane. Wszystkie ciąże obarczone są ryzykiem tła wad wrodzonych, utraty lub innych niekorzystnych wyników. W populacji ogólnej Stanów Zjednoczonych szacowane ryzyko tła poważnych wad wrodzonych i poronienia w ciążach rozpoznanych klinicznie wynosi odpowiednio 2% do 4% i 15% do 20%.
Dane
Dane dotyczące zwierząt
Badania systemowego rozwoju embrionalnego przeprowadzono na szczurach i królikach. W celu porównania dawek stosowanych u zwierząt z dawkami stosowanymi u ludzi na podstawie porównania powierzchni ciała (mg/m2), MRHD ustalono na poziomie 8 g 2% kremu na dobę (2,67 mg/kg/dobę dla osobnika o masie ciała 60 kg).
Dawki doustne 30, 100 i 300 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom szczurów. Nie stwierdzono wpływu leczenia na rozwój zarodka w dawkach do 300 mg/kg/dobę (18-krotność MRHD). Podskórne dawki 10 i 30 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom szczurów. Nie stwierdzono wpływu leczenia na rozwój zarodka przy dawce 30 mg/kg/dobę (2 razy MRHD). Podskórne dawki 3, 10 i 30 mg/kg/dobę chlorowodorku naftifiny podawano w okresie organogenezy ciężarnym samicom królików. Nie stwierdzono wpływu leczenia na rozwój zarodka przy dawce 30 mg/kg/dobę (4-krotność MRHD).
Badanie rozwoju około- i pourodzeniowego przeprowadzono u szczurów. Samicom szczurów podawano doustnie dawki 30, 100 i 300 mg/kg/dobę chlorowodorku naftifiny od 14. dnia ciąży do 21. dnia laktacji. Zmniejszony przyrost masy ciała samic w czasie ciąży i potomstwa w czasie laktacji odnotowano przy dawce 300 mg/kg/dobę (18-krotność MRHD). Nie odnotowano toksyczności rozwojowej przy dawce 100 mg/kg/dobę (6-krotność MRHD).
Laktacja
Podsumowanie ryzyka
Brak dostępnych informacji na temat obecności chlorowodorku naftifiny w kremie w mleku ludzkim, wpływu leku na niemowlę karmione piersią lub wpływu leku na wytwarzanie mleka. Brak danych klinicznych dotyczących okresu laktacji uniemożliwia jednoznaczne określenie ryzyka stosowania chlorowodorku naftifiny w postaci kremu u niemowląt w okresie laktacji; dlatego należy rozważyć rozwój i korzyści zdrowotne wynikające z karmienia piersią, a także kliniczne zapotrzebowanie matki na chlorowodorek naftifiny w postaci kremu oraz wszelkie potencjalne działania niepożądane kremu chlorowodorku naftifiny lub związane z chorobą podstawową matki u niemowląt karmionych piersią.
Stosowanie u dzieci
Bezpieczeństwo stosowania i skuteczność naftifiny chlorowodorku kremu zostały ustalone u pacjentów pediatrycznych w wieku 12 lat i starszych z grzybicą międzypalcową stóp i grzybicą skóry oraz w wieku 2 lat i starszych z grzybicą skóry.
Stosowanie chlorowodorku naftifiny w postaci kremu w tych grupach wiekowych jest poparte dowodami z odpowiednich i dobrze kontrolowanych badań u dorosłych i dzieci, z dodatkowymi danymi dotyczącymi bezpieczeństwa i PK z dwóch badań z otwartą etykietą przeprowadzonych u 49 pacjentów pediatrycznych narażonych na działanie chlorowodorku naftifiny w postaci kremu .
Bezpieczeństwo i skuteczność chlorowodorku naftifiny w postaci kremu w leczeniu grzybicy stóp i grzybicy międzypalcowej u pacjentów pediatrycznych w wieku poniżej 12 lat nie zostały ustalone. Nie ustalono bezpieczeństwa stosowania i skuteczności chlorowodorku naftifiny w postaci kremu w leczeniu grzybicy skóry u pacjentów pediatrycznych w wieku poniżej 2 lat.
Stosowanie u osób w podeszłym wieku
Badania kliniczne naftifiny chlorowodorku kremu nie obejmowały wystarczającej liczby osób w wieku 65 lat i starszych, aby określić, czy reagują one inaczej niż osoby młodsze.
Opis produktu leczniczego naftifiny krem
Naftifiny chlorowodorek krem, USP jest kremem o barwie białej do białawej, przeznaczonym wyłącznie do stosowania miejscowego. Każdy gram zawiera 20 mg chlorowodorku naftifiny, USP, (2%), syntetycznego związku przeciwgrzybiczego z grupy alliloamin.
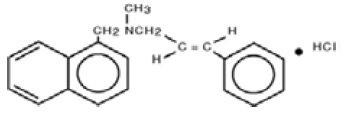
Chemicznie, chlorowodorek naftifiny jest (E)-N-cynaminylo-N-metylo-1-napthalenemethylamine hydrochloride.
Wzór cząsteczkowy to C21H21N-HCl o masie cząsteczkowej 323,86.
Wzór strukturalny chlorowodorku naftifiny, USP to:
Krem chlorowodorek naftifiny, USP zawiera następujące składniki nieaktywne: alkohol benzylowy, alkohol cetylowy, wosk estrów cetylowych, mirystynian izopropylu, polisorbat 60, woda oczyszczona, wodorotlenek sodu, monostearynian sorbitanu i alkohol stearylowy. Kwas solny może być dodany w celu dostosowania pH.
Naftifiny krem – farmakologia kliniczna
Mechanizm działania
Naftifiny chlorowodorek krem jest lekiem przeciwgrzybiczym stosowanym miejscowo .
Farmakodynamika
Farmakodynamika naftifiny chlorowodorku kremu nie została ustalona.
Farmakokinetyka
Badania biodostępności in vitro i in vivo wykazały, że naftifina przenika przez warstwę rogową naskórka w stężeniu wystarczającym do zahamowania wzrostu dermatofitów.
Farmakokinetykę chlorowodorku naftifiny w kremie oceniano po stosowaniu raz na dobę przez 2 tygodnie u 21 dorosłych osób, zarówno mężczyzn, jak i kobiet, zarówno z grzybicą stóp, jak i grzybicą skóry. Mediana całkowitej ilości stosowanego kremu wynosiła 6,4 g (zakres od 5,3 g do 7,5 g) na dobę. Wyniki badań wykazały, że ekspozycja ogólnoustrojowa (tj. stężenie maksymalne (Cmax) i pole pod krzywą od czasu 0 do 24 godzin (AUC0-24) na naftifinę zwiększały się w ciągu 2 tygodni leczenia u wszystkich 21 uczestników. Średnia geometryczna (współczynnik zmienności lub CV%) AUC0-24 wynosiła 117 (41,2) ng*hr/mL w dniu 1. i 204 (28,5) ng*hr/mL w dniu 14. Średnia geometryczna (CV %) Cmax wynosiła 7 ng/mL (55,6) w dniu 1. i 11 ng/mL (29,3) w dniu 14. Mediana czasu do osiągnięcia Cmax (Tmax) wynosiła 8 godzin (zakres od 4 do 24 godzin) w dniu 1. i 6 godzin (zakres od 0 do 16 godzin) w dniu 14. Kumulacja po 14 dniach stosowania miejscowego była mniejsza niż dwukrotna. Stężenia końcowe na ogół zwiększały się w ciągu 14-dniowego okresu badania. Naftifina była nadal wykrywana w osoczu u 13/21 (62%) uczestników w dniu 28. Średnie (odchylenie standardowe lub SD) stężenie w osoczu wynosiło 1,6 ± 0,5 ng/ml (zakres poniżej granicy oznaczalności (BLQ) do 3 ng/ml). W tym samym badaniu farmakokinetycznym przeprowadzonym u pacjentów z grzybicą stóp i grzybicą skóry, mediana frakcji dawki wydalanej z moczem w okresie leczenia wynosiła 0,0016% w dniu 1 i 0,0020% w dniu 14.
W drugim badaniu, do którego zakwalifikowano 22 uczestników, farmakokinetykę chlorowodorku naftifiny w kremie oceniano u 20 pacjentów pediatrycznych w wieku od 13 do mniej niż 18 lat z grzybicą stóp i grzybicą skóry. Pacjenci byli leczeni medianą dawki 8,1 g (zakres od 6,6 g do 10,1 g) nakładanej na zmienione chorobowo miejsca raz na dobę przez 2 tygodnie. Wyniki wykazały, że ekspozycja ogólnoustrojowa zwiększała się w okresie leczenia. Średnia geometryczna (CV%) AUC0-24 wynosiła 138 (50,2) ng*hr/mL w dniu 1. i 192 (74,9) ng*hr/mL w dniu 14. Średnia geometryczna (CV %) Cmax wynosiła 9,21 ng/mL (48,4) w dniu 1. i 12,7 ng/mL (67,2) w dniu 14. Mediana frakcji dawki wydalanej z moczem w okresie leczenia wynosiła 0,0030% w dniu 1 i 0,0033% w dniu 14.
W trzecim badaniu oceniano farmakokinetykę naftifiny chlorowodorku kremu u 27 pacjentów pediatrycznych w wieku od 2 do mniej niż 12 lat z co najmniej umiarkowaną grzybicą skóry. Uczestników podzielono na grupy młodsze (w wieku od 2 do mniej niż 6 lat, 17 uczestników) i starsze (w wieku od 6 do mniej niż 12 lat, 10 uczestników). Mediana dawek 1,3 g (zakres od 1 g do 3,1 g) i 2,3 g (zakres od 2,2 g do 4,2 g) była stosowana raz na dobę przez 2 tygodnie, odpowiednio w młodszej i starszej grupie, na obszar dotknięty chorobą plus ½ cala marginesu. Ocenę farmakokinetyczną osocza i moczu przeprowadzono w dniu 1. tylko w starszej grupie i w dniu 14. w obu grupach. U wszystkich uczestników stwierdzono mierzalne poziomy naftifiny w osoczu po zastosowaniu miejscowym kremu zawierającego chlorowodorek naftifiny. Po podaniu pojedynczej dawki w dniu 1. u osób w wieku od 6 do mniej niż 12 lat, średnie geometryczne (CV%) wartości Cmax i AUC0-24 wynosiły odpowiednio 3,60 (76,6) ng/mL i 49,8 (64,4) ng*h/mL. W dniu 14. w tej grupie wartości Cmax i AUC0-24 wynosiły odpowiednio 3,31 (51,2) ng/mL i 52,4 (49,2) ng*h/mL. U uczestników w wieku od 2 do mniej niż 6 lat w dniu 14, Cmax i AUC0-24 wynosiły odpowiednio 3,98 (186) ng/mL i 54,8 (150) ng*h/mL. W starszej grupie uczestników w wieku od 6 do 12 lat, ekspozycja ogólnoustrojowa (zarówno Cmax, jak i AUC0-24) w dniach 1 i 14 była porównywalna. Mediana frakcji dawki wydalanej z moczem w ciągu 24 godzin po podaniu leku w dniu 1. i 14. wynosiła odpowiednio 0,0029% i 0,0014%.
Mikrobiologia
Chociaż dokładny mechanizm działania przeciw grzybom nie jest znany, chlorowodorek naftifiny wydaje się zaburzać biosyntezę steroli poprzez hamowanie enzymu skwalenu2, 3-epoksydazy.To zahamowanie aktywności enzymu powoduje zmniejszenie ilości steroli, zwłaszcza ergosterolu, i odpowiednie nagromadzenie skwalenu w komórkach.
Mechanizm oporności
Do chwili obecnej nie zidentyfikowano mechanizmu oporności na naftifinę.
Naftifina wykazuje aktywność wobec większości izolatów następujących grzybów, zarówno w warunkach in vitro, jak i w zakażeniach klinicznych, zgodnie z opisem w punkcie WSKAZANIA I STOSOWANIE:
Trichophyton rubrum
Toksykologia niekliniczna
Karcynogeneza, mutageneza, upośledzenie płodności
W 2-letnim badaniu rakotwórczości skórnej chlorowodorek naftifyny w kremie podawano szczurom Sprague-Dawley w dawkach miejscowych 1%, 2% i 3% (10, 20, i 30 mg/kg/dobę chlorowodorku naftifyny). W tym badaniu nie stwierdzono żadnych nowotworów związanych z lekiem do największej dawki ocenianej w tym badaniu wynoszącej 30 mg/kg/dobę (12-krotność MRHD na podstawie porównania AUC).
Chlorowodorek naftyfiny nie wykazał potencjału mutagennego ani klastogennego na podstawie wyników dwóch testów genotoksyczności in vitro (test Amesa i test aberracji chromosomowej komórek jajnika chomika chińskiego) oraz jednego testu genotoksyczności in vivo (test mikrojądrowy szpiku kostnego myszy).
Ortalne podawanie chlorowodorku naftifiny szczurom, w okresie krycia, ciąży, porodu i laktacji, nie wykazało wpływu na wzrost, płodność lub reprodukcję, w dawkach do 100 mg/kg/dobę (6-krotność MRHD).
Badania kliniczne
Grzybica skóry
Krem chlorowodorek naftyfiny był badany pod względem bezpieczeństwa i skuteczności w randomizowanym, podwójnie zaślepionym, kontrolowanym nośnikiem, wieloośrodkowym badaniu u 146 pacjentów z objawową grzybicą skóry z dodatnim wynikiem hodowli dermatofitów. Badani byli randomizowani do otrzymywania kremu chlorowodorku naftifiny lub podłoża. Pacjenci stosowali krem chlorowodorku naftifiny lub nośnik na zmienione chorobowo miejsce oraz ½-calowy margines zdrowej skóry wokół zmienionego chorobowo miejsca raz dziennie przez 2 tygodnie. Oceniano oznaki i objawy grzybicy (obecność lub brak rumienia, świądu i łuszczenia się skóry) oraz przeprowadzono badanie KOH i hodowlę dermatofitów w pierwotnym punkcie końcowym skuteczności w 4. tygodniu.
Średni wiek badanej populacji wynosił 47 lat, 87% stanowili mężczyźni, a 43% było rasy białej. Na początku potwierdzono, że uczestnicy mają oznaki i objawy grzybicy, dodatni wynik badania KOH i potwierdzoną obecność dermatofitów na podstawie wyników hodowli z centralnego laboratorium mikologicznego. Analiza populacji docelowej polegała na porównaniu odsetka uczestników z całkowitym wyleczeniem podczas wizyty w 4. tygodniu (patrz Tabela 1). Całkowite wyleczenie zdefiniowano jako zarówno wyleczenie kliniczne (brak rumienia, świądu i łuszczenia), jak i wyleczenie mikologiczne (ujemny wynik hodowli KOH i dermatofitów).
Odsetek osób, u których wystąpiło wyleczenie kliniczne i odsetek osób, u których wystąpiło wyleczenie mikologiczne w 4. tygodniu przedstawiono indywidualnie w tabeli 1 poniżej.
|
Endpoint |
Naftifine Hydrochloride Cream, 2% |
Wskazania |
|
N=75 |
N=71 |
|
|
Kompletna Kurea |
19 (25%) |
2 (3%) |
|
Skuteczne leczenieb |
45 (60%) |
7 (10%) |
|
Wyleczenie mikologiczne |
54 (72%) |
11 (16%) |
|
a. Całkowite wyleczenie jest złożonym punktem końcowym obejmującym zarówno wyleczenie mikologiczne, jak i wyleczenie kliniczne. Wyleczenie kliniczne jest definiowane jako brak rumienia, świądu i łuszczenia się skóry (stopień 0). |
||
|
b. Skuteczne leczenie oznacza ujemny wynik preparatu KOH i ujemny wynik hodowli dermatofitów, rumień, łuszczenie i świąd w stopniu 0 lub 1 (nieobecne lub prawie nieobecne). |
||
|
c. Wyleczenie mikologiczne definiuje się jako ujemny wynik hodowli KOH i dermatofitów. |
||
Grzybica międzypalcowa
Badano skuteczność kremu zawierającego chlorowodorek naftyfiny w randomizowanym, podwójnie zaślepionym, kontrolowanym nośnikiem, wieloośrodkowym badaniu z udziałem 217 pacjentów z objawową grzybicą międzypalcową z dodatnim wynikiem hodowli dermatofitów. Uczestników randomizowano do otrzymywania kremu zawierającego chlorowodorek naftifiny lub preparatu. Pacjenci stosowali krem chlorowodorku naftifiny lub nośnik na zmienione chorobowo miejsce na stopie oraz ½-calowy margines zdrowej skóry wokół zmienionego chorobowo miejsca raz dziennie przez 2 tygodnie. Oceniano oznaki i objawy grzybicy międzypalcowej (obecność lub brak rumienia, świądu i łuszczenia) oraz przeprowadzono badanie KOH i hodowlę dermatofitów w pierwszorzędowym punkcie końcowym skuteczności w 6. tygodniu.
Średni wiek badanej populacji wynosił 42 lata, 71% stanowili mężczyźni, a 57% było rasy białej. Na początku badania u uczestników potwierdzono występowanie oznak i objawów grzybicy międzypalcowej, dodatni wynik badania KOH i potwierdzoną hodowlę dermatofitów. Pierwszorzędowym punktem końcowym skuteczności był odsetek uczestników z całkowitym wyleczeniem podczas wizyty w 6. tygodniu (patrz Tabela 2). Całkowite wyleczenie zdefiniowano jako wyleczenie kliniczne (brak rumienia, świądu i łuszczenia się skóry) oraz wyleczenie mikologiczne (ujemny wynik badania KOH i hodowli dermatofitów).
Wyniki skuteczności w 6. tygodniu, cztery tygodnie po zakończeniu leczenia, przedstawiono w tabeli 2 poniżej. Chlorowodorek naftyfiny w kremie wykazał całkowite wyleczenie u osób z grzybicą międzypalcową, ale nie wykazano całkowitego wyleczenia u osób, u których występowała tylko grzybica typu mokasynowego.
|
Endpoint |
Naftifine hydrochloride Cream, 2% |
Wskazania |
|
N=147 |
N=70 |
|
|
Kompletna kuracja |
26 (18%) |
5 (7%) |
|
Skuteczne leczenieb |
83 (57%) |
14 (20%) |
|
Wyleczenie mikologiczne |
99 (67%) |
15 (21%) |
|
a. Całkowite wyleczenie jest złożonym punktem końcowym zarówno wyleczenia mikologicznego, jak i klinicznego. |
||
|
b. Skuteczne leczenie oznacza ujemny wynik preparatu KOH i ujemny wynik hodowli dermatofitów, rumień, łuszczenie i świąd w stopniu 0 lub 1 (nieobecne lub prawie nieobecne). |
||
|
c. Wyleczenie mikologiczne jest definiowane jako ujemny wynik hodowli KOH i dermatofitów. |
||
Tinea corporis
Badano bezpieczeństwo i skuteczność kremu zawierającego chlorowodorek naftyfiny w randomizowanym, podwójnie ślepym, kontrolowanym z użyciem nośnika, wieloośrodkowym badaniu z udziałem 184 pacjentów z objawową grzybicą skóry z dodatnim wynikiem hodowli dermatofitów. Badani byli randomizowani do otrzymywania chlorowodorku naftifiny w kremie lub nośnika. Uczestnicy stosowali badany środek na wszystkie obszary ciała dotknięte grzybicą oraz na ½ calowy margines zdrowej skóry wokół zmian chorobowych przez dwa tygodnie. Oceniano oznaki i objawy grzybicy (obecność lub brak rumienia, stwardnienia i świądu) oraz przeprowadzano badanie KOH i hodowlę dermatofitów w celu oceny pierwszorzędowego punktu końcowego skuteczności w dniu 21.
Populacja badana to dzieci (w wieku od 2 do 18 lat) z medianą wieku 9 lat (chlorowodorek naftifiny w kremie) lub 8 lat (preparat); 61% uczestników to mężczyźni, a 45% to biali. Na początku badania u uczestników potwierdzono występowanie oznak i objawów grzybicy skóry, dodatni wynik badania KOH i potwierdzoną hodowlę dermatofitów. Pierwszorzędowym punktem końcowym skuteczności był odsetek uczestników, u których nastąpiło całkowite wyleczenie podczas wizyty w dniu 21. Całkowite wyleczenie zdefiniowano jako wyleczenie kliniczne (brak rumienia, stwardnienia i świądu na wszystkich zmianach obecnych na początku) oraz wyleczenie mikologiczne (ujemny wynik badania KOH i hodowli dermatofitów).
Wyniki skuteczności w dniu 21, tydzień po zakończeniu leczenia, przedstawiono w tabeli 3 poniżej.
|
Naftifine Hydrochloride Cream, 2% |
Wózek |
|
|
Punkt końcowy |
N=91 |
N=93 |
|
Kompletna kuracja |
42 (46%) |
26 (28%) |
|
Skuteczne leczenieb |
53 (58%) |
32 (34%) |
|
Wyleczenie mikologiczne |
57 (63%) |
36 (39%) |
|
a. Całkowite wyleczenie jest złożonym punktem końcowym zarówno wyleczenia mikologicznego, jak i klinicznego. |
||
|
b. Skuteczne leczenie oznacza ujemny wynik preparatu KOH i ujemny wynik hodowli dermatofitów, rumień, stwardnienie i świąd w stopniu 0 lub 1 (brak lub łagodny). |
||
|
c. Wyleczenie mikologiczne definiuje się jako ujemny wynik hodowli KOH i dermatofitów. |
||
Jak dostarczać/składowanie i przechowywanie
Naftifiny chlorowodorek krem, USP 2%, jest białym do białawego kremem dostarczanym w następujących wielkościach:
Tuby o wadze 45 gramów – NDC 70700-161-18
Tuby o wadze 60 gramów – NDC 70700-161-17
Krem chlorowodorek naftifiny przechowywać w temperaturze 25°C (77°F); dopuszczalne są wypady do 15° do 30°C (59° do 86°F) .
Informacje dla pacjenta
- Poinformować pacjentów, że naftifiny chlorowodorek kremu jest przeznaczony wyłącznie do stosowania miejscowego. Chlorowodorek naftifiny w kremie nie jest przeznaczony do stosowania doustnego, dopochwowego ani okulistycznego.
- Jeśli podczas stosowania chlorowodorku naftifiny w kremie wystąpi podrażnienie lub nadwrażliwość, leczenie należy przerwać i rozpocząć odpowiednią terapię. Pacjentów należy poinformować o konieczności skontaktowania się z lekarzem, jeśli takie objawy wystąpią po zastosowaniu chlorowodorku naftifiny w kremie.
Distributed by:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
PACKAGE LABEL PRINCIPAL DISPLAY PANEL SECTION – 45g Tube

NDC 70700-161-18
Naftifine Cream, 2%
Xiromed, LLC
Do stosowania wyłącznie miejscowego
Nie stosować u zwierząt w celach okulistycznych, Oral or Intravaginal Use
45 g
Rx Only
PACKAGE LABEL PRINCIPAL DISPLAY PANEL SECTION – 60g Tube

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
For Topical Use Only
Not for Ophthalmic Use, Oral or Intravaginal Use
60 g
Rx Only
| NAFTIFINE HYDROCHLORIDE naftifine hydrochloride cream |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Podmiot odpowiedzialny za etykietowanie -. Xiromed, LLC (080228637)
Rejestrator – Xiromed Pharma España, S.L. (468835741)
Więcej o naftifine topical
- Sposoby działania ubocznego
- W okresie ciąży i karmienia piersią
- Informacje o dawkowaniu
- Ceny & Kupony
- En Español
- 7 Reviews
- Klasa leków: topical antifungals
Zasoby dla konsumentów
- Informacje dla pacjentów
- Naftifine Topical (Advanced Reading)
Zasoby dla profesjonalistów
- Informacje dla pacjentów
- Naftifine. (Profesjonalna Porada dla Pacjenta)
- Naftifine Gel (FDA)
Inne marki Naftin
Przewodniki dotyczące leczenia
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Zrzeczenie się odpowiedzialności medycznej