Pirokseny są najbardziej znaczącą i obfitą grupą skałotwórczych krzemianów ferromagnezu. Występują w prawie wszystkich odmianach skał iglastych i występują w skałach o bardzo różnym składzie, powstałych w warunkach metamorfizmu regionalnego i kontaktowego. Nazwa piroksen pochodzi od greckiego pyro, co oznacza „ogień”, i xenos, co oznacza „obcy”, i został podany przez Haüy do zielonkawych kryształów znalezionych w wielu law, które uważał za przypadkowo zawarte tam.
Skład chemiczny minerałów z grupy piroksenów można wyrazić ogólnym wzorem:
XYZ2O6
w którym X = Na+, Ca2+, Mn2+, Fe2+, Mg2+, Li+; Y = Mn2+, Fe2+, Mg2+, Fe3+, Al3+, Cr3+, Ti4+; i Z= Si4+, Al3+. Zakres możliwych podstawień chemicznych w piroksenie jest ograniczony wielkością dostępnych miejsc w strukturze oraz ładunkiem podstawionych kationów. Miejsca dla kationów X są na ogół większe niż miejsca dla kationów Y. Pomiędzy idealnymi składami końcowymi występuje rozległa substytucja atomowa. Większość piroksenów ma tylko ograniczoną substytucję glinu dla krzemu w miejscu Z (tetraedrycznym). Gdy zastępujący jon różni się ładunkiem, neutralność elektryczna jest utrzymywana przez sprzężone podstawienia. Na przykład, para składająca się z Na+ i Al3+ zastępuje 2Mg2+.
Najczęściej spotykane pirokseny mogą być reprezentowane jako część układu chemicznego CaSiO3 (wollastonit, piroksenoid), MgSiO3 (enstatyt), i FeSiO3 (ferrosilit). (Fig.1). Ponieważ nie istnieją prawdziwe pirokseny o zawartości wapnia większej niż w złączu diopsyd-hedenbergit, część tego układu poniżej tego złącza nazywana jest czworobokiem piroksenu.
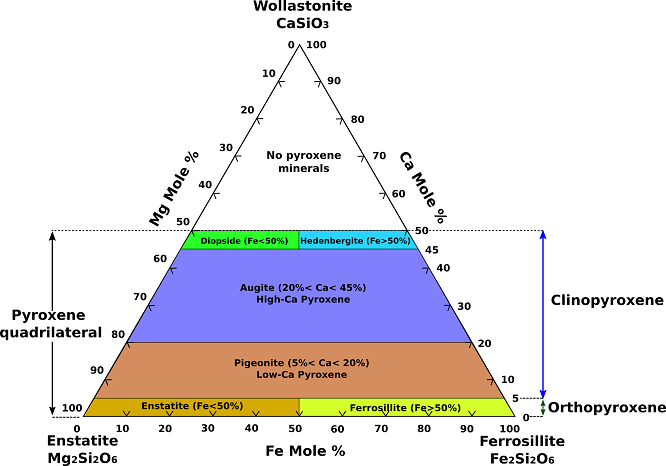
Fig.1Ternary Composition Diagram for Pyroxenes.
Zupełna substytucja występuje między enstatytem (Mg2Si2O6) a ferrosilitem (Fe2Si2O6), a całkowite roztworzenie żelaza w magnez występuje między diopsydem (CaMgSi2O6) a hedenbergitem (CaFeSi2O6). Augit, subkalcytowy augit i pigeonit leżą we wnętrzu czworoboku piroksenowego. Składowo augit jest spokrewniony z członkami serii diopside-hedenbergite z ograniczoną substytucją Na+ dla Ca2+, Al3+ dla Mg2+ i Fe2+ oraz Al3+ dla Si4+ w miejscu Z (tetraedrycznym). Augity ze znaczną zawartością glinu lub sodu nie mogą być ściśle reprezentowane w płaszczyźnie czworościanu. Monokliniczny pigeonite obejmuje pole magnezowo-żelazowego roztworu stałego z nieco wyższą zawartością wapnia niż ortorhombic enstatite-ortoferrosilite series.
Połączone substytucje z udziałem Na+, Li+, lub Al3+ dla Mg2+ w strukturze enstatite dają pirokseny, które leżą poza czworobocznym polu kompozycyjnym. Sprzężona substytucja Na+ i Al3+ dla 2Mg2+ w enstatytach daje piroksen jadeit. W wyniku sprzężonego podstawienia Na+ i Fe3+ za 2Mg2+ powstaje piroksen aegiryn (akmit). Podstawienie Li+ i Al3+ za 2Mg2+ daje spodumen. Zastąpienie Al3+ przez Mg2+ i Al3+ przez Si4+ daje idealny składnik tschermakitu MgAlSiAlO6. Inne, rzadziej spotykane pirokseny o składach spoza czworokąta piroksenowego to johannsenit , i kosmochlor (ureyit) . Johannsenit polega na zastąpieniu manganu przez żelazo w hedenbergicie. Kosmochlor ma chrom (Cr) w miejsce żelaza lub aluminium w piroksenie sodowym.
W wysokich temperaturach pirokseny mają bardziej rozległe pola roztworu stałego niż w niższych. W związku z tym, jak temperatury spadają, piroksen dostosowuje swój skład w stanie stałym przez exsolving oddzielną fazę w postaci lamelli w ziarnie piroksenu gospodarza. Lamele są wydzielane wzdłuż określonych kierunków krystalograficznych, tworząc orientowane wrostki o teksturze równoległej i jodełkowej. Wyróżnia się pięć głównych kombinacji par ekshalacji: (1) augit z lamelami enstatytu, (2) augit z lamelami pigeonitu, (3) augit zarówno z lamelami pigeonitu, jak i enstatytu, (4) pigeonit z lamelami augitu oraz (5) enstatyt z lamelami augitu.
Pirokseny różnią się składem od amfiboli pod dwoma głównymi względami. Pirokseny nie zawierają niezbędnej wody w postaci hydroksyli w swojej strukturze, podczas gdy amfibole są uważane za krzemiany wodorozcieńczalne. Drugą kluczową różnicą chemiczną między nimi jest obecność miejsca A w amfibolach, które zawiera duże pierwiastki alkaliczne, zwykle sód i czasami potas; pirokseny nie mają równoważnego miejsca, które może pomieścić potas.
Struktura
Grupa piroksenów obejmuje minerały, które tworzą się zarówno w ortorhombicznym, jak i monoklinicznym układzie krystalicznym. Pirokseny ortorhombiczne nazywane są ortopiroksenami, a pirokseny monokliniczne klinopiroksenami. Zasadniczą cechą wszystkich struktur piroksenowych jest powiązanie czworościanów krzemowo-tlenowych (SiO4) poprzez współdzielenie dwóch z czterech narożników w ciągłe łańcuchy. Łańcuchy te, które rozciągają się w nieskończoność równolegle do osi krystalograficznej c, mają skład (Si2O6) (Fig.2). Powtarzająca się odległość około 5.3 Å wzdłuż długości łańcucha definiuje oś c komórki jednostkowej. Łańcuchy Si2O6 są związane z warstwą oktaedrycznie skoordynowanych pasm kationowych, które również rozciągają się równolegle do osi c.
.png)
Fig.2: schemat struktury piroksenu jednołańcuchowego. Tam, gdzie stykają się dwa czworościany, mają wspólny jon tlenu. Z Wikipedii
Paski oktaedryczne składają się z oktaedrów M1 i M2 umieszczonych pomiędzy dwoma przeciwnie skierowanymi łańcuchami tetraedrycznymi. Miejsca M1 są zajmowane przez mniejsze kationy, takie jak magnez, żelazo, aluminium i mangan, które są skoordynowane z sześcioma atomami tlenu, tworząc regularny ośmiościan. W piroksenach monoklinicznych, miejsce M2 jest dużym nieregularnym wielościanem zajmowanym przez większe kationy wapnia i sodu, które są w ośmiokrotnej koordynacji. W piroksenach ortorhombicznych niskowapniowych M2 zawiera magnez i żelazo, a wielościan przybiera bardziej regularny kształt oktaedryczny. Pasek kationu M1 jest związany z atomami tlenu dwóch przeciwnie skierowanych łańcuchów tetraedrycznych (Rys.3). Razem tworzą one pas tetraedryczno-oktaedryczno-tetraedryczny (t-o-t). Schematyczny rzut struktury piroksenu prostopadły do osi c oraz związek rozszczepienia piroksenu z paskami t-o-t lub belkami I- pokazano na Rys. 3.
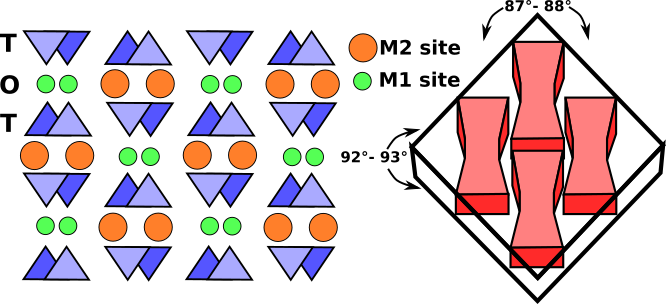
Fig.3: Schematyczny rzut struktury piroksenu monoklinicznego prostopadły do osi c. Prążki T-O-T, zwane dwuteownikami, mają bardzo silne wiązania, które są odporne na rozerwanie i powodują typowe dla piroksenów rozszczepienie pod kątem bliskim 90° (linie przerywane).
W cienkich przekrojach pirokseny monokliniczne wyróżniają się dwoma kierunkami rozszczepienia pod kątem około 87° i 93°, ośmiobocznymi przekrojami podstawnymi oraz jasnobrązową lub zieloną barwą. Pirokseny ortorhombiczne różnią się od piroksenów monoklinicznych tym, że mają równoległe wygaszanie.
Bibliografia
– Cox et al. (1979): The Interpretation of Igneous Rocks, George Allen and Unwin, London.
– Howie, R. A., Zussman, J., & Deer, W. (1992). An introduction to the rock-forming minerals (s. 696). Longman.
– Le Maitre, R. W., Streckeisen, A., Zanettin, B., Le Bas, M. J., Bonin, B., Bateman, P., & Lameyre, J. (2002). Igneous rocks. A classification and glossary of terms, 2. Cambridge University Press.
– Middlemost, E. A. (1986). Magmas and magmatic rocks: an introduction to igneous petrology.
– Shelley, D. (1993). Igneous and metamorphic rocks under the microscope: classification, textures, microstructures and mineral preferred-orientations.
– Vernon, R. H. & Clarke, G. L. (2008): Principles of Metamorphic Petrology. Cambridge University Press.