La Química Física es un tema un tanto amplio; abarca:
- Química cuántica
- Termoquímica (Repaso + Más)
- Cinética (Repaso + Más)
- Mecánica estadística
Como hay bastantes temas para una respuesta, sólo daré dos ejemplos por tema. Esta va a ser una respuesta larga, pero puedes centrarte en lo que buscas.
QUÍMICA CUÁNTICA
En general, la química cuántica consiste en tratar de entender escenarios a escala picoscópica, modelando los sistemas en representaciones matemáticas convenientes y haciendo las aproximaciones adecuadas.
Dos ejemplos de química cuántica son:
- Oscilador armónico simple (dos bolas conectadas por un muelle ideal)
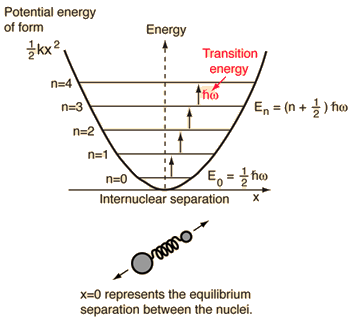
Para este sistema, que conocemos por la física, lo reducimos de un problema clásico de dos cuerpos a un problema de un cuerpo con coordenadas relativas y una masa reducida, #mu = (m_1m_2)/(m_1 + m_2)#.
Este sistema se centra en la comprensión de la energía potencial elástica del enlace molecular.
- Rotor rígido (dos bolas conectadas por una varilla, es decir, un muelle 100% rígido)
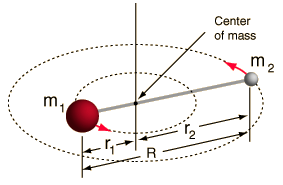
Este sistema es una simplificación, ya que todas las moléculas tienen alguna forma de estiramiento/vibración del enlace (¡comprenderías por qué esta simplificación está bien, si vieras las matemáticas!).
Sin embargo, nos permite descomponer este componente angular de un sistema de dos cuerpos y entender las propiedades rotacionales de la molécula.
TERMOQUÍMICA
Esto mira a la escala macroscópica del flujo de calor, trabajo, energías libres, etc. Ya ha hecho esto antes en la química general algo, y esto se revisa y se amplía.
Dos ejemplos son:
- Determinación de valores termodinámicos a partir de cantidades medibles
¿Qué es la química si no es práctica?
Así, un tema común es poder realizar derivaciones y expresar las principales magnitudes termodinámicas (entropía, entalpía, energía libre de gibbs + helmholtz, energía interna) en términos de variables naturales como volumen, temperatura y presión.
Por ejemplo, se puede calcular la entropía a partir de una expansión isotérmica (#DeltaT = 0, DeltaV > 0#) conociendo #V_2# y #V_1#, o #P_2# y #P_1#, y eso para un gas ideal monatómico:
#DeltaS = -nRln(P_2/P_1) = nRln(V_2/V_1)#
- Soluciones ideales y no ideales no electrolíticas/electrolíticas
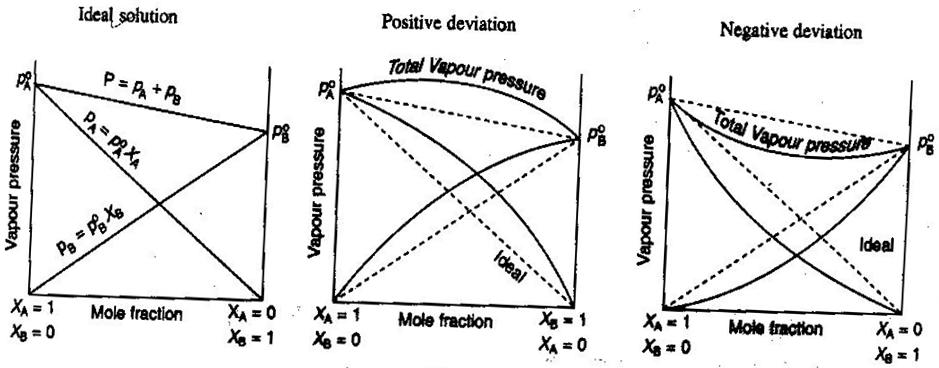
En química general, nos gusta tratar las soluciones de forma ideal, de modo que los volúmenes son aditivos, las concentraciones de los electrolitos fuertes son cálculos directos #»mol/L «#, etc. Algunas formas en que las soluciones pueden no ser ideales:
- La solución puede expandirse o contraerse después de ser mezclada.
- El emparejamiento de iones disminuye la fuerza iónica de la solución y reduce el factor de van’t Hoff #i# del soluto.
- La tendencia al escape del soluto altera su concentración efectiva (su actividad).
QUÍMICA
Es posible que hayas hecho esto antes en una clase de química general, o tal vez en el instituto. La fisicoquímica amplía esto un poco más al ver los mecanismos de reacción y la dinámica de la fase gaseosa con más detalle.
Dos ejemplos:
- Aproximación al estado estacionario
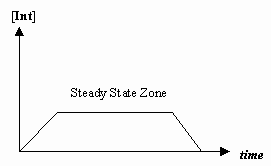
A veces la velocidad del primer paso mecanístico es mucho más lenta que la del segundo, y aproximamos que la concentración del intermedio efectivamente no cambia (#(d)/(dt) = 0#).
Eso permite derivar una ley de velocidad particular para un mecanismo, y expresar una «constante de velocidad observada» en términos de las constantes de velocidad para los pasos individuales.
- Leyes reales de los gases
Puede que hayas conocido la ecuación de estado de Van der Waals:
#(V – nb) = nRT#
Bueno, hay algunas otras, como la de Redlich-Kwong, la de Peng-Robinson, etc.
La idea básica es que todas funcionan mejor para ciertos gases que para otros, pero todas funcionan para dar cuenta de las propiedades reales de los gases en lugar de asumir que todos son una masa puntual inerte que colisiona elásticamente.
MECÁNICA ESTADÍSTICA
Con la mecánica estadística, damos un paso atrás y miramos el mundo picoscópico desde una perspectiva macroscópica:
«¿Qué se puede aprender de un sistema si pensamos como un químico cuántico sobre una gran colección de partículas?»
Dos ejemplos:
- Teorema de la Equipartición
#<< K >> = N/2nRT = N/2 k_BT#,
donde #N# es el número de grados de libertad para cada tipo de movimiento (lineal, rotacional, vibracional, electrónico, nuclear). Básicamente, tiene en cuenta cada tipo de movimiento en una molécula para estimar su energía cinética media, #<< K >>#.
Esto sólo funciona a temperaturas «suficientemente altas». Normalmente, está bien para los movimientos de traslación y rotación, pero tiende a sobreestimar las contribuciones vibracionales.
- La función de partición microcanónica
#q = sum_(i=1)^(N) g_ie^(-beta epsilon_i)#,
donde:
- #g_i# es la degeneración del estado #i# con energía #epsilon_i#.
- #N# es el número total de estados disponibles.
Al igual que la función de onda #psi# especifica todo lo que hay que saber sobre un sistema mecánico cuántico, la función de partición microcanónica especifica cómo una molécula puede distribuir su energía disponible en los posibles tipos de estados (traslacional, rotacional, vibracional, electrónico y nuclear).
Existe una #q# para cada tipo de estado: #q_(tr)#, #q_(rot)#, #q_(vib)#, #q_(el ec)#, y #q_(n uc)#.
A partir de conocer cada tipo de #q#, se pueden derivar las cantidades termodinámicas conocidas, como la entropía (#S#), la entalpía (#H#), la energía libre de Gibbs (#G#), etc., en términos de cada tipo de #q#.
Como ejemplo útil, la entropía molecular absoluta a CUALQUIER temperatura en la mayoría de los casos puede calcularse como:
#S/N = k_B ln (q/N)_»tot» + (<< épsilon >>_»tot»)/T + k_B#,
donde:
- #k_B ~~ «0.695 cm»^(-1)»/K «# es la constante de Boltzmann.
- #(q/N)_»tot» = (q_(tr))/Nq_(rot)q_(vib)q_(el ec)q_(n uc)# es la función de partición microcanónica total que incluye todos los tipos de estados posibles, y #N# es el número total de moléculas consideradas.
- #<< epsilon >> = E/N# es la energía molecular, definida como #<< epsilon >> = k_BT^2((del ln (q»/»N)_»tot»)/(del T))_V#.
(Sí, esta fórmula a #»298,15 K «# permite calcular el mismo #S^@# que se ve en el Apéndice del libro de texto!)
Un ejemplo de esta fórmula en uso se puede encontrar aquí.