Chimia fizică este o temă oarecum largă; acoperă:
- Chimie cuantică
- Termochimie (Recapitulare + Mai mult)
- Cinetică (Recapitulare + Mai mult)
- Mecanică statistică
Din moment ce sunt destul de multe subiecte pentru un singur răspuns, voi da doar două exemple pentru fiecare subiect. Va fi un răspuns lung, dar puteți să vă concentrați pe ceea ce căutați.
CHIMIE CUANTICĂ
Chimia cuantică se referă, în general, la încercarea de a înțelege scenarii la scară picoscopică, modelând sistemele în reprezentări matematice convenabile și făcând aproximările corespunzătoare.
Două exemple de chimie cuantică sunt:
- Oscilatorul armonic simplu (două bile conectate printr-un resort ideal)
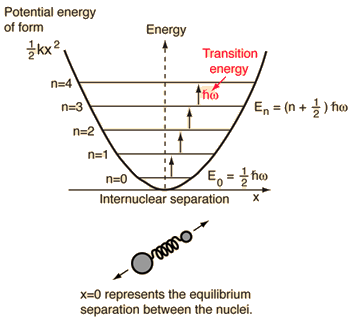
Pentru acest sistem, pe care îl cunoaștem din fizică, îl reducem de la o problemă clasică cu două corpuri la o problemă cu un singur corp cu coordonate relative și o masă redusă, #mu = (m_1m_2)/(m_1 + m_2)#.
Acest sistem se concentrează pe înțelegerea energiei potențiale elastice a legăturii moleculare.
- Rotor rigid (două bile conectate printr-o tijă, adică un resort 100% rigid)
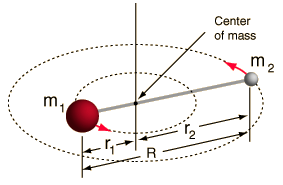
Acest sistem este o simplificare, deoarece toate moleculele au o anumită formă de întindere/vibrație a legăturii (ați înțelege de ce această simplificare este OK, dacă ați vedea matematica!).
Cu toate acestea, ne permite să descompunem această componentă unghiulară a unui sistem cu două corpuri și să înțelegem proprietățile de rotație ale moleculei.
TERMOCHIMIE
Aceasta privește la scara macroscopică fluxul de căldură, lucrul, energiile libere și așa mai departe. Ați mai făcut acest lucru înainte în chimia generală oarecum, iar aceasta este revizuită și dezvoltată.
Două exemple sunt:
- Determinarea valorilor termodinamice din mărimi măsurabile
Ce este chimia dacă nu este practică?
Deci, o temă comună este aceea de a fi capabili să efectuăm derivări și să exprimăm principalele mărimi termodinamice (entropie, entalpie, energia liberă gibbs + helmholtz, energie internă) în termeni de variabile naturale precum volumul, temperatura și presiunea.
De exemplu, se poate calcula entropia dintr-o expansiune izotermă (#DeltaT = 0, DeltaV > 0#) cunoscând #V_2# și #V_1#, sau #P_2# și #P_1#, și asta pentru un gaz ideal monatomic:
#DeltaS = -nRln(P_2/P_1) = nRln(V_2/V_1)#
- Soluții neelectrolitice/electrolitice ideale și neideale
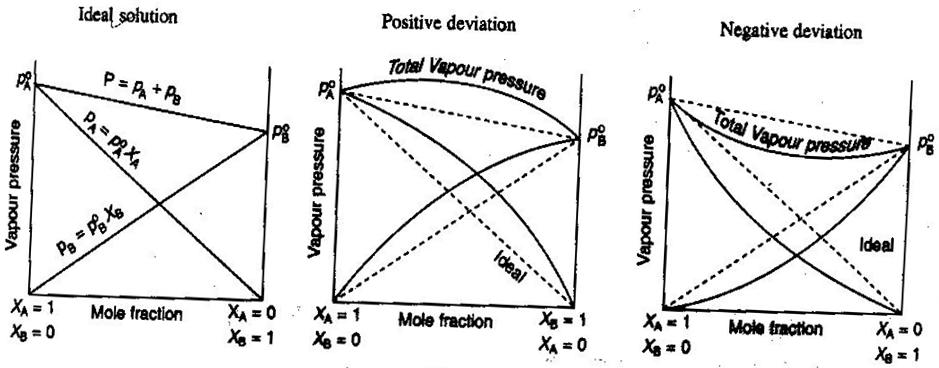
În chimia generală, ne place să tratăm soluțiile în mod ideal, astfel încât volumele să fie aditive, concentrațiile de electroliți puternici să fie calcule directe #”mol/L „# și așa mai departe. Câteva moduri în care soluțiile pot să nu fie ideale:
- Soluția se poate dilata sau contracta după ce a fost amestecată.
- Încrucișarea ionilor scade puterea ionică a soluției și reduce factorul van’t Hoff #i# al solutului.
- Tendința de evadare a solutului modifică concentrația efectivă a acestuia (activitatea sa).
CINETICA
Poate că ați mai făcut acest lucru la un curs de chimie generală, sau poate în liceu. Chimia fizică extinde puțin mai mult acest lucru, analizând mai în detaliu mecanismele de reacție și dinamica fazei gazoase.
Două exemple:
- Aproximația stării staționare
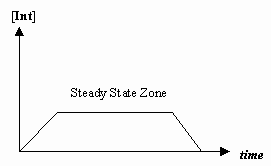
Câteodată viteza primei etape mecaniciste este mult mai lentă decât cea a celei de-a doua etape și aproximăm că concentrația intermediarului nu se schimbă efectiv (#(d)/(dt) = 0#).
Acest lucru permite derivarea unei legi de viteză specifice unui mecanism și ne permite să exprimăm o „constantă de viteză observată” în termeni de constante de viteză pentru etapele individuale.
- Legi reale ale gazelor
Poate că ați făcut cunoștință cu ecuația de stare van der Waals:
#(V – nb) = nRT#
Bine, mai sunt și altele, cum ar fi Redlich-Kwong, Peng-Robinson și așa mai departe.
Ideea de bază este că toate funcționează mai bine pentru anumite gaze decât pentru altele, dar toate funcționează pentru a ține cont de proprietățile reale ale gazelor, în loc să presupunem că toată lumea este o masă punctuală inertă care se ciocnește elastic.
MECANICĂ STATISTICĂ
Cu mecanica statistică, facem un pas înapoi și privim lumea picoscopică dintr-o perspectivă macroscopică:
„Ce se poate învăța dintr-un sistem dacă ne gândim ca un chimist cuantic la o colecție mare de particule?”
Două exemple:
- Teorema ecuației
#<< K >> = N/2nRT = N/2 k_BT#,
unde #N# este numărul de grade de libertate pentru fiecare tip de mișcare (liniară, rotațională, vibrațională, electronică, nucleară). Practic, se ia în considerare fiecare tip de mișcare dintr-o moleculă pentru a estima energia cinetică medie a acesteia, #<< K >>#.
Acest lucru funcționează doar la temperaturi „suficient de ridicate”. De obicei, este OK pentru mișcările de translație și rotație, dar tinde să supraestimeze contribuțiile vibraționale.
- Funcția de partiție microcanonică
#q = sum_(i=1)^(N) g_ie^(-beta epsilon_i)#,
unde:
- #g_i# este degenerarea stării #i# cu energia #epsilon_i#.
- #N# este numărul total de stări disponibile.
La fel cum funcția de undă #psi# specifică tot ceea ce este de știut despre un sistem de mecanică cuantică, funcția de partiție microcanonică specifică modul în care o moleculă își poate distribui energia disponibilă în tipurile de stări posibile (de translație, de rotație, de vibrație, electronică și nucleară).
Există un #q# pentru fiecare tip de stare: #q_(tr)#, #q_(rot)#, #q_(vib)#, #q_(el ec)# și #q_(n uc)#.
Din cunoașterea fiecărui tip de #q#, pot fi derivate mărimile termodinamice cunoscute, cum ar fi entropia (#S#), entalpia (#H#), energia liberă a lui Gibbs (#G#) și așa mai departe, în funcție de fiecare tip de #q#.
Ca un exemplu util, entropia moleculară absolută la ORICE temperatură, în majoritatea cazurilor, poate fi calculată ca:
#S/N = k_B ln (q/N)_”tot” + (<< epsilon >>_”tot”)/T + k_B#,
unde:
- #k_B ~~ „0.695 cm”^(-1)”/K „# este constanta Boltzmann.
- #(q/N)_”tot” = (q_(tr))/Nq_(rot)q_(vib)q_(el ec)q_(n uc)# este funcția de partiție microcanonică totală care include toate tipurile de stări posibile, iar #N# este numărul total de molecule considerate.
- #<< epsilon >> = E/N# este energia moleculară, definită ca #<< epsilon >> = k_BT^2((del ln (del ln (q”/”N)_”tot”)/(del T))_V#.
(Da, această formulă la #”298,15 K „# vă permite să calculați același #S^@# pe care îl vedeți în anexa manualului!)
Un exemplu de utilizare a acestei formule poate fi găsit aici.