Chemia fizyczna jest dość szerokim tematem; obejmuje:
- Chemię kwantową
- Thermochemię (Review + More)
- Kinetykę (Review + More)
- Mechanikę statystyczną
Ponieważ jest dość dużo tematów na jedną odpowiedź, podam tylko dwa przykłady na temat. To będzie długa odpowiedź, ale możesz skupić się na tym, czego szukasz.
CHEMIA KWANTOWA
Chemia kwantowa polega ogólnie na próbach zrozumienia scenariuszy w skali pikoskopowej, modelowaniu systemów w wygodnych reprezentacjach matematycznych i dokonywaniu odpowiednich przybliżeń.
Dwa przykłady chemii kwantowej to:
- Prosty oscylator harmoniczny (dwie kulki połączone idealną sprężyną)
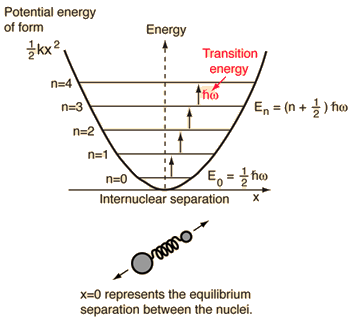
Dla tego układu, który znamy z fizyki, redukujemy go z dwuciałowego problemu klasycznego do problemu jednociałowego o względnych współrzędnych i zredukowanej masie, #mu = (m_1m_2)/(m_1 + m_2)#.
Ten system skupia się na zrozumieniu elastycznej energii potencjalnej wiązania molekularnego.
- Sztywny rotor (dwie kulki połączone prętem, czyli 100% sztywna sprężyna)
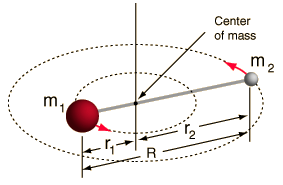
Ten system jest uproszczeniem, ponieważ wszystkie cząsteczki mają jakąś formę rozciągania/wibracji wiązań (zrozumiałbyś dlaczego to uproszczenie jest OK, gdybyś zobaczył matematykę!).
Jednakże pozwala nam to zdekomponować ten kątowy składnik układu dwóch ciał i zrozumieć rotacyjne właściwości cząsteczki.
THERMOCHEMISTYKA
To patrzy na makroskopową skalę przepływu ciepła, pracy, energii swobodnych i tak dalej. Robiłeś to już wcześniej w chemii ogólnej, a to jest przejrzane i rozszerzone.
Dwa przykłady to:
- Określanie wartości termodynamicznych z mierzalnych wielkości
Czym jest chemia, jeśli nie jest praktyczna?
Więc, wspólnym tematem jest umiejętność wykonywania pochodnych i wyrażania głównych wielkości termodynamicznych (entropia, entalpia, energia swobodna gibbsa + helmholtza, energia wewnętrzna) w kategoriach naturalnych zmiennych, takich jak objętość, temperatura i ciśnienie.
Na przykład, można obliczyć entropię z izotermicznej ekspansji (#DeltaT = 0, DeltaV > 0#) znając #V_2# i #V_1#, lub #P_2# i #P_1#, i to dla monatomowego gazu idealnego:
#DeltaS = -nRln(P_2/P_1) = nRln(V_2/V_1)#
- Idealne i nieidealne roztwory nieelektrolitów/elektrolitów
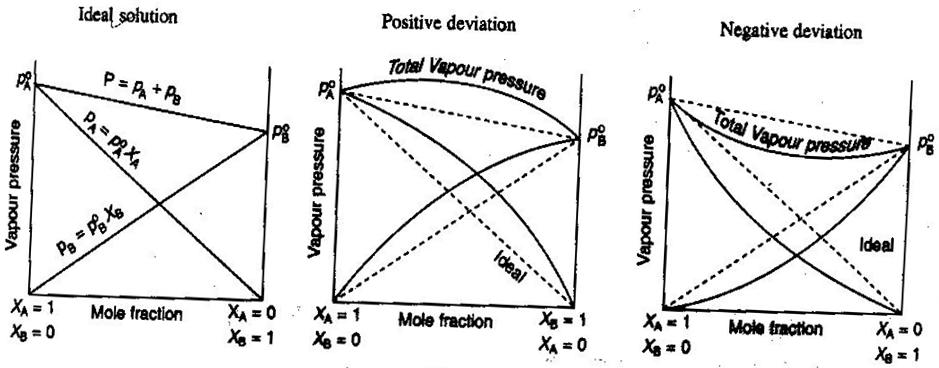
W chemii ogólnej, lubimy traktować roztwory idealnie, tak że objętości są addytywne, stężenia silnych elektrolitów są proste #”mol/L „# obliczenia, i tak dalej. Niektóre sposoby, w jakie roztwory mogą nie być idealne:
- Roztwór może się rozszerzać lub kurczyć po zmieszaniu.
- Parowanie jonów zmniejsza siłę jonową roztworu i zmniejsza współczynnik van’t Hoffa #i# solutu.
- Tendencja ucieczki rozpuszczalnika zmienia jego efektywne stężenie (jego aktywność).
KINETYKA
Możesz to robić wcześniej na zajęciach z chemii ogólnej, a może w szkole średniej. Chemia fizyczna rozszerza się na to trochę więcej, patrząc na mechanizmy reakcji i dynamiki fazy gazowej w sposób bardziej szczegółowy.
Dwa przykłady:
- Przybliżenie stanu ustalonego
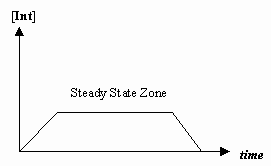
Czasami szybkość pierwszego kroku mechanistycznego jest znacznie wolniejsza niż drugiego kroku, a my przybliżamy, że stężenie półproduktu efektywnie się nie zmienia (#(d)/(dt) = 0#).
To pozwala na wyprowadzenie prawa szybkości charakterystycznego dla danego mechanizmu i na wyrażenie „obserwowanej stałej szybkości” w kategoriach stałych szybkości dla poszczególnych etapów.
- Realne prawa gazowe
Pewnie zapoznaliście się z równaniem stanu van der Waalsa:
#(V – nb) = nRT#
Cóż, jest kilka innych, jak Redlich-Kwong, Peng-Robinson, i tak dalej.
Podstawową ideą jest to, że wszystkie one działają lepiej dla pewnych gazów niż inne, ale wszystkie one działają tak, aby uwzględnić rzeczywiste właściwości gazów zamiast zakładać, że każdy jest elastycznie zderzającą się obojętną masą punktową.
MECHANIKA STATYSTYCZNA
Z mechaniką statystyczną robimy krok wstecz i patrzymy na świat pikoskopowy z makroskopowej perspektywy:
„Czego można się dowiedzieć o systemie, jeśli pomyślimy jak chemik kwantowy o dużym zbiorze cząstek?”
Dwa przykłady:
- Twierdzenie ekwipartycji
#<< K >> = N/2nRT = N/2 k_BT#,
gdzie #N# jest liczbą stopni swobody dla każdego typu ruchu (liniowego, rotacyjnego, wibracyjnego, elektronowego, jądrowego). Zasadniczo, bierze się pod uwagę każdy rodzaj ruchu w cząsteczce, aby oszacować jej średnią energię kinetyczną, #<< K >>#.
To działa tylko w „wystarczająco wysokich” temperaturach. Zazwyczaj jest to OK dla ruchów translacyjnych i rotacyjnych, ale ma tendencję do przeceniania wkładów wibracyjnych.
- Funkcja Partycji Mikrokanonicznej
#q = suma_(i=1)^(N) g_ie^(-beta epsilon_i)#,
gdzie:
- #g_i# jest degeneracją stanu #i# z energią #epsilon_i#.
- #N# jest całkowitą liczbą dostępnych stanów.
Tak jak funkcja falowa #psi# określa wszystko, co można wiedzieć o układzie kwantowo-mechanicznym, mikrokanoniczna funkcja podziału określa, jak cząsteczka może rozdzielić swoją dostępną energię na możliwe rodzaje stanów (translacyjne, rotacyjne, wibracyjne, elektroniczne i jądrowe).
Dla każdego rodzaju stanu istnieje #q#: #q_(tr)#, #q_(rot)#, #q_(vib)#, #q_(el ec)#, i #q_(n uc)#.
Ze znajomości każdego rodzaju #q# można wyprowadzić znane wielkości termodynamiczne, takie jak entropia (#S#), entalpia (#H#), energia swobodna Gibbsa (#G#), i tak dalej, w terminach każdego rodzaju #q#.
Jako użyteczny przykład, absolutna entropia molekularna w KAŻDEJ temperaturze w większości przypadków może być obliczona jako:
#S/N = k_B ln (q/N)_”tot” + (<< epsilon >>_”tot”)/T + k_B#,
gdzie:
- #k_B ~~ „0.695 cm”^(-1)”/K „# jest stałą Boltzmanna.
- #(q/N)_”tot” = (q_(tr))/Nq_(rot)q_(vib)q_(el ec)q_(n uc)# jest całkowitą mikrokanoniczną funkcją podziału, która obejmuje wszystkie możliwe typy stanów, a #N# jest całkowitą liczbą rozważanych cząsteczek.
- #<< epsilon >> = E/N# jest energią molekularną, zdefiniowaną jako #<< epsilon >> = k_BT^2((del ln (q”/”N)_”tot”)/(del T))_V#.
(Tak, ten wzór w #”298.15 K „# pozwala na obliczenie tego samego #S^@#, który widzisz w swoim podręcznikowym dodatku!)
Przykład użycia tego wzoru można znaleźć tutaj.
.