La chimica fisica è un argomento piuttosto ampio; copre:
- Chimica quantistica
- Thermochemistry (Review + More)
- Kinetics (Review + More)
- Meccanica statistica
Siccome ci sono abbastanza argomenti per una risposta, fornirò solo due esempi per argomento. Questa sarà una risposta lunga, ma puoi concentrarti su ciò che stai cercando.
CHIMICA DEL QUANTUM
La chimica del quantum è in generale cercare di capire gli scenari su scala picoscopica, modellando i sistemi in comode rappresentazioni matematiche e facendo le approssimazioni appropriate.
Due esempi di chimica quantistica sono:
- Semplice oscillatore armonico (due sfere collegate da una molla ideale)
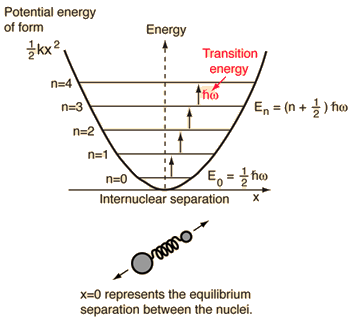
Per questo sistema, che conosciamo dalla fisica, lo riduciamo da un problema classico a due corpi a un problema a un corpo con coordinate relative e una massa ridotta, #mu = (m_1m_2)/(m_1 + m_2)#.
Questo sistema si concentra sulla comprensione dell’energia potenziale elastica del legame molecolare.
- Rotore rigido (due sfere collegate da un’asta, cioè una molla rigida al 100%)
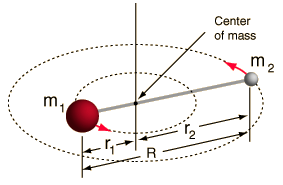
Questo sistema è una semplificazione, poiché tutte le molecole hanno qualche forma di allungamento/vibrazione del legame (capiresti perché questa semplificazione va bene, se vedessi la matematica!)
Tuttavia, ci permette di scomporre questa componente angolare di un sistema a due corpi e di capire le proprietà rotazionali della molecola.
TERMOCEMICO
Questo guarda alla scala macroscopica del flusso di calore, lavoro, energie libere e così via. L’hai già fatto un po’ nella chimica generale, e questo viene rivisto e ampliato.
Due esempi sono:
- Determinazione dei valori termodinamici da quantità misurabili
Cos’è la chimica se non è pratica?
Così, un tema comune è quello di essere in grado di eseguire derivazioni ed esprimere le principali quantità termodinamiche (entropia, entalpia, energia libera di gibbs + helmholtz, energia interna) in termini di variabili naturali come volume, temperatura e pressione.
Per esempio, si può calcolare l’entropia da un’espansione isoterma (#DeltaT = 0, DeltaV > 0#) conoscendo #V_2# e #V_1#, o #P_2# e #P_1#, e questo per un gas ideale monoatomico:
#DeltaS = -nRln(P_2/P_1) = nRln(V_2/V_1)#
- Soluzioni non elettrolitiche/elettrolitiche ideali e non ideali
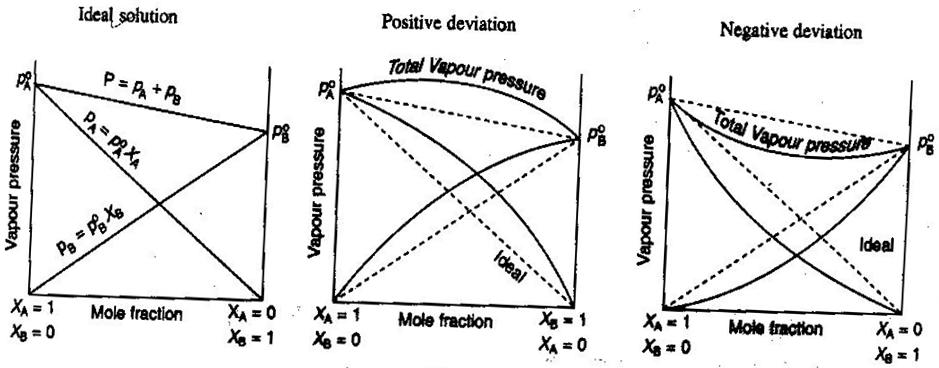
In chimica generale, ci piace trattare le soluzioni in modo ideale, in modo che i volumi siano additivi, le concentrazioni di elettroliti forti siano calcoli diretti #”mol/L “#, e così via. Alcuni modi in cui le soluzioni possono non essere ideali:
- La soluzione può espandersi o contrarsi dopo essere stata mescolata.
- L’accoppiamento degli ioni diminuisce la forza ionica della soluzione e riduce il fattore di van’t Hoff #i# del soluto.
- La tendenza alla fuga del soluto altera la sua concentrazione effettiva (la sua attività).
CINETICA
Potresti aver fatto questo prima in una lezione di chimica generale, o forse al liceo. La chimica fisica si espande un po’ di più guardando i meccanismi di reazione e la dinamica della fase gassosa in modo più dettagliato.
Due esempi:
- Approssimazione di stato stazionario
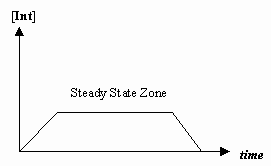
A volte la velocità del primo passo meccanico è molto più lenta di quella del secondo passo, e si approssima che la concentrazione dell’intermedio effettivamente non cambi (#(d)/(dt) = 0#).
Questo permette di derivare una legge di velocità particolare per un meccanismo, e di esprimere una “costante di velocità osservata” in termini di costanti di velocità per i singoli passi.
- Leggi dei gas reali
Ti sarà stata presentata l’equazione di stato di van der Waals:
#(V – nb) = nRT#
Bene, ce ne sono altre, come la Redlich-Kwong, la Peng-Robinson, e così via.
L’idea di base è che tutte funzionano meglio per certi gas che per altri, ma tutte funzionano per rendere conto delle reali proprietà dei gas invece di assumere che tutti siano una massa inerte puntiforme in collisione elastica.
MECCANICA STATISTICA
Con la meccanica statistica, facciamo un passo indietro e guardiamo il mondo picoscopico da una prospettiva macroscopica:
“Cosa si può imparare da un sistema se pensiamo come un chimico quantistico su una grande collezione di particelle?”
Due esempi:
- Teorema di Equipartizione
#<< K >> = N/2nRT = N/2 k_BT#,
dove #N# è il numero di gradi di libertà per ogni tipo di moto (lineare, rotazionale, vibrazionale, elettronico, nucleare). In pratica, prende in considerazione ogni tipo di moto in una molecola per stimare la sua energia cinetica media, #<< K >>#.
Questo funziona solo a temperature “abbastanza alte”. Di solito, va bene per i moti traslazionali e rotazionali, ma tende a sovrastimare i contributi vibrazionali.
- La funzione di partizione microcanonica
#q = sum_(i=1)^(N) g_ie^(-beta epsilon_i)#,
dove:
- #g_i# è la degenerazione dello stato #i# con energia #epsilon_i#.
- #N# è il numero totale di stati disponibili.
Proprio come la funzione d’onda #psi# specifica tutto quello che c’è da sapere su un sistema meccanico quantistico, la funzione di partizione microcanonica specifica come una molecola può distribuire la sua energia disponibile nei possibili tipi di stati (traslazionale, rotazionale, vibrazionale, elettronico e nucleare).
Esiste una #q# per ogni tipo di stato:
Dalla conoscenza di ogni tipo di #q#, si possono derivare le quantità termodinamiche familiari, come l’entropia (#S#), l’entalpia (#H#), l’energia libera di Gibbs (#G#) e così via, in termini di ogni tipo di #q#.
Come esempio utile, l’entropia molecolare assoluta a QUALSIASI temperatura nella maggior parte dei casi può essere calcolata come:
#S/N = k_B ln (q/N)_”tot” + (<< epsilon >>_”tot”)/T + k_B#,
dove:
- #k_B ~~ “0.695 cm”^(-1)”/K “# è la costante di Boltzmann.
- #(q/N)_”tot” = (q_(tr))/Nq_(rot)q_(vib)q_(el ec)q_(n uc)# è la funzione di partizione microcanonica totale che include tutti i possibili tipi di stati, e #N# è il numero totale di molecole considerate.
- #<< epsilon >> = E/N# è l’energia molecolare, definita come #<< epsilon >> = k_BT^2((del ln (q”/”N)_”tot”)/(del T))_V#.
(Sì, questa formula a #”298.15 K “# ti permette di calcolare la stessa #S^@# che vedi nell’appendice del tuo libro di testo!)
Un esempio di questa formula in uso può essere trovato qui.