Nom générique : Sulfate de néomycine, sulfate de polymyxine b et hydrocortisone
Formation posologique : suspension ophtalmique
Médicament revu par Drugs.com. Dernière mise à jour le 1er mars 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
.
Rx only
DESCRIPTION
Sulfates de néomycine et de polymyxine B et suspension ophtalmique à l’hydrocortisone est une suspension antimicrobienne et anti-inflammatoire à usage ophtalmique.
Chaque mL contient : Actifs : sulfate de néomycine (équivalent à 3,5 mg de base de néomycine), sulfate de polymyxine B équivalent à 10 000 unités de polymyxine B et hydrocortisone 10 mg (1%). Conservateur : thimérosal 0,001%. Ingrédients : alcool cétylique, monostéarate de glycéryle, huile minérale, stéarate de polyoxyle 40, propylèneglycol, acide sulfurique (pour ajuster le pH) et eau pour injection.
Le sulfate de néomycine est le sel de sulfate de la néomycine B et C, qui sont produits par la croissance de Streptomyces fradiae Waksman (Fam. Streptomycetacae). Il a une puissance équivalente à pas moins de 600 μg de néomycine standard par mg, calculée sur une base anhydre. Ses formules structurelles sont :
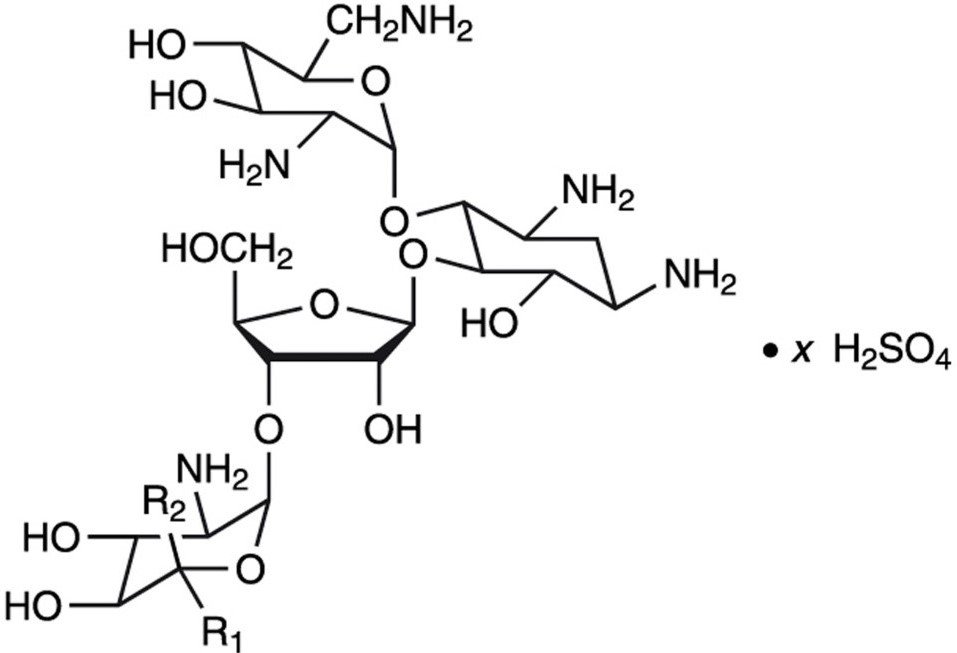
Néomycine B (R1=H, R2=CH2NH2)
Néomycine C (R1=CH2NH2, R2=H)
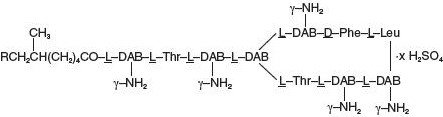
Le sulfate de Polymyxine B est le sel de sulfate de Polymyxine, B1 et B2, qui sont produits par la croissance de Bacillus polymyxa (Prazmowski) Migula (Fam. Bacillaceae). Il a une puissance non inférieure à 6 000 unités de polymyxine B par mg calculée sur une base anhydre. Ses formules structurelles sont:

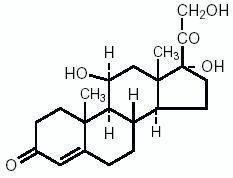
L’hydrocortisone, 11β, 17, 21-trihydroxypregn-4-ène-3, 20 dione, est une hormone anti-inflammatoire. Sa formule développée est :
Néomycine, Polymyxine B, Hydrocortisone Suspension Ophtalmique – Pharmacologie clinique
Les corticostéroïdes suppriment la réponse inflammatoire à une variété d’agents, et ils retardent ou ralentissent probablement la guérison. Comme les corticostéroïdes peuvent inhiber le mécanisme de défense de l’organisme contre les infections, des médicaments antimicrobiens concomitants peuvent être utilisés lorsque cette inhibition est considérée comme cliniquement significative dans un cas particulier.
Lorsqu’il est décidé d’administrer à la fois un corticostéroïde et des antimicrobiens, l’administration de ces médicaments en association présente l’avantage d’une meilleure observance et d’une plus grande commodité pour le patient, avec l’assurance supplémentaire que la dose appropriée de tous les médicaments est administrée. Lorsque chaque type de médicament est dans la même formulation, la compatibilité des ingrédients est assurée et le volume correct de médicament est délivré et retenu.
La puissance relative des corticostéroïdes dépend de la structure moléculaire, de la concentration et de la libération à partir du véhicule.
Microbiologie
Les composants anti-infectieux des sulfates de néomycine et de polymyxine B et de la suspension ophtalmique d’hydrocortisone sont inclus pour assurer une action contre des organismes spécifiques qui y sont sensibles. Le sulfate de néomycine et le sulfate de polymyxine B sont actifs in vitro contre les souches sensibles des micro-organismes suivants : Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, les espèces Klebsiella/Enterobacter, les espèces Neisseria et Pseudomonas aeruginosa. Le produit n’offre pas une couverture adéquate contre Serratia marcescens et les streptocoques, y compris Streptococcus pneumoniae .
Indications et utilisation de la suspension ophtalmique de néomycine, de polymyxine B et d’hydrocortisone
La suspension ophtalmique de néomycine et de polymyxine B sulfates et d’hydrocortisone est indiquée dans les affections oculaires inflammatoires répondant aux stéroïdes pour lesquelles un corticostéroïde est indiqué et lorsqu’il existe une infection bactérienne ou un risque d’infection oculaire bactérienne.
Les corticoïdes oculaires sont indiqués dans les états inflammatoires de la conjonctive palpébrale et bulbaire, de la cornée et du segment antérieur du globe où le risque inhérent à l’utilisation des corticoïdes dans certaines conjonctivites infectieuses est accepté pour obtenir une diminution de l’œdème et de l’inflammation. Ils sont également indiqués dans les uvéites antérieures chroniques et les lésions cornéennes dues à des brûlures chimiques, radiologiques ou thermiques, ou à la pénétration de corps étrangers.
L’utilisation d’une association médicamenteuse avec un composant anti-infectieux est indiquée lorsque le risque d’infection est élevé ou lorsqu’on s’attend à ce qu’un nombre potentiellement dangereux de bactéries soit présent dans l’œil.
Les médicaments anti-infectieux particuliers de ce produit sont actifs contre les pathogènes oculaires bactériens courants suivants : Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, Klebsiella/Enterobacter species, Neisseria species et Pseudomonas aeruginosa.
Le produit n’offre pas une couverture adéquate contre Serratia marcescens et les streptocoques, y compris Streptococcus pneumoniae.
Contre-indications
La suspension ophtalmique de néomycine et de polymyxine B sulfates et d’hydrocortisone est contre-indiquée dans la plupart des maladies virales de la cornée et de la conjonctive, notamment : la kératite épithéliale à herpès simplex (kératite dendritique), la vaccine et la varicelle, ainsi que dans les infections mycobactériennes de l’œil et les maladies fongiques des structures oculaires.
La suspension ophtalmique de néomycine et de polymyxine B sulfates et hydrocortisone est également contre-indiquée chez les personnes ayant présenté une hypersensibilité à l’un de ses composants. L’hypersensibilité au composant antibiotique se produit à un taux plus élevé que pour les autres composants.
Avertissements
NON POUR INJECTION DANS L’OEIL. Les sulfates de néomycine et de polymyxine B et la suspension ophtalmique d’hydrocortisone ne doivent jamais être introduits directement dans la chambre antérieure de l’œil.
L’utilisation prolongée de corticostéroïdes peut entraîner une hypertension oculaire et/ou un glaucome, avec des lésions du nerf optique, des défauts d’acuité visuelle et des champs de vision, et la formation d’une cataracte sous-capsulaire postérieure.
L’utilisation prolongée peut supprimer la réponse de l’hôte et ainsi augmenter le risque d’infections oculaires secondaires. Dans les maladies provoquant un amincissement de la cornée ou de la sclérotique, des perforations sont connues pour se produire avec l’utilisation de corticostéroïdes topiques. Dans les états purulents aigus de l’œil, les corticostéroïdes peuvent masquer l’infection ou renforcer une infection existante.
Si ces produits sont utilisés pendant 10 jours ou plus, la pression intraoculaire doit être systématiquement surveillée même si cela peut être difficile chez les patients non coopératifs. Les corticostéroïdes doivent être utilisés avec précaution en présence d’un glaucome.
L’utilisation de corticostéroïdes après une chirurgie de la cataracte peut retarder la guérison et augmenter l’incidence de saignements filtrants. L’emploi de corticostéroïdes oculaires peut prolonger l’évolution et exacerber la gravité de nombreuses infections virales de l’œil (y compris l’herpès simplex). L’emploi de corticostéroïdes dans le traitement de l’herpès simplex nécessite une grande prudence.
Les antibiotiques topiques, en particulier, le sulfate de néomycine, peuvent provoquer une sensibilisation cutanée. L’incidence précise des réactions d’hypersensibilité (principalement des éruptions cutanées) dues aux antibiotiques topiques n’est pas connue. Les manifestations de sensibilisation aux antibiotiques topiques sont généralement des démangeaisons, des rougeurs et un œdème de la conjonctive et de la paupière. Une réaction de sensibilisation peut se manifester simplement par un défaut de cicatrisation. Lors de l’utilisation à long terme de produits antibiotiques topiques, il est conseillé d’examiner périodiquement ces signes et de dire au patient d’arrêter le produit s’ils sont observés. Les symptômes disparaissent généralement rapidement lors de l’arrêt du médicament. L’application de produits contenant ces ingrédients doit être évitée pour le patient par la suite .
Précautions
Généralités
La prescription initiale et le renouvellement de l’ordonnance du médicament au-delà de 20 ml ne doivent être effectués par un médecin qu’après examen du patient à l’aide d’un grossissement, tel que la biomicroscopie à lampe à fente et, le cas échéant, la coloration à la fluorescéine. Si les signes et les symptômes ne s’améliorent pas après 2 jours, le patient doit être réévalué.
La possibilité d’infections fongiques de la cornée doit être envisagée après une administration prolongée de corticostéroïdes. Des cultures fongiques doivent être réalisées lorsque cela est approprié.
Si ce produit est utilisé pendant 10 jours ou plus, la pression intraoculaire doit être surveillée.
On a signalé des cas de kératite bactérienne associés à l’utilisation de produits ophtalmiques topiques dans des récipients à doses multiples qui ont été contaminés par inadvertance par des patients, dont la plupart présentaient une maladie cornéenne concomitante ou une perturbation de la surface épithéliale oculaire .
Il peut se produire des réactions allergiques croisées qui pourraient empêcher l’utilisation de l’un ou de tous les antibiotiques suivants pour le traitement d’infections futures : kanamycine, paromomycine, streptomycine et éventuellement gentamicine.
Information pour les patients
Les patients doivent être informés qu’ils doivent éviter de laisser l’extrémité du récipient de distribution entrer en contact avec l’œil, la paupière, les doigts ou toute autre surface. L’utilisation de ce produit par plus d’une personne peut propager l’infection.
Les patients doivent également être informés que les produits oculaires, s’ils sont manipulés de manière incorrecte, peuvent être contaminés par des bactéries communes connues pour provoquer des infections oculaires. Des dommages sérieux à l’œil et une perte de vision subséquente peuvent résulter de l’utilisation de produits contaminés.
Si l’état persiste ou s’aggrave, ou si une éruption cutanée ou une réaction allergique se développe, il faut conseiller au patient d’arrêter l’utilisation et de consulter un médecin. N’utilisez pas ce produit si vous êtes allergique à l’un des ingrédients énumérés.
Gardez le produit bien fermé lorsqu’il n’est pas utilisé. Tenir hors de portée des enfants.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études à long terme chez l’animal visant à évaluer le potentiel cancérigène ou mutagène n’ont pas été réalisées avec le sulfate de polymyxine B. Le traitement de lymphocytes humains en culture in vitro avec de la néomycine a augmenté la fréquence des aberrations chromosomiques aux concentrations les plus élevées (80 ug/mL) testées ; cependant, les effets de la néomycine sur la cancérogenèse et la mutagenèse chez l’homme sont inconnus.
Des études à long terme chez l’animal (rats, lapins, souris) n’ont montré aucune preuve de cancérogenèse ou de mutagenèse attribuable à l’administration orale de corticostéroïdes. Aucune étude à long terme chez l’animal n’a été réalisée pour évaluer le potentiel cancérigène des corticostéroïdes topiques. Les études visant à déterminer la mutagénicité de l’hydrocortisone ont donné des résultats négatifs. L’utilisation de corticostéroïdes dans le traitement de l’herpès simplex requiert une grande prudence. Il a été rapporté que la Polymyxine B altère la motilité des spermatozoïdes équins, mais ses effets sur la fertilité masculine ou féminine sont inconnus. Aucune étude animale à long terme n’a été réalisée pour évaluer l’effet sur la fertilité des corticostéroïdes topiques.
Grossesse
Effets tératogènes
Catégorie de grossesse C. Les corticostéroïdes se sont révélés tératogènes chez les lapins lors d’une application topique à des concentrations de 0,5 % aux jours 6 à 18 de la gestation et chez les souris lors d’une application topique à une concentration de 15 % aux jours 10 à 13 de la gestation. Il n’existe pas d’études adéquates et bien contrôlées chez les femmes enceintes. Les sulfates de néomycine et de polymyxine B et la suspension ophtalmique d’hydrocortisone ne doivent être utilisés pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le ftus.
Mères allaitantes
On ne sait pas si l’administration topique de corticostéroïdes pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Les corticostéroïdes administrés par voie systémique apparaissent dans le lait maternel et pourraient supprimer la croissance, interférer avec la production endogène de corticostéroïdes ou provoquer d’autres effets indésirables. En raison du risque de réactions indésirables graves chez les nourrissons allaités par les sulfates de néomycine et de polymyxine B et la suspension ophtalmique d’hydrocortisone, une décision doit être prise concernant l’arrêt de l’allaitement ou l’arrêt du médicament, en tenant compte de l’importance du médicament pour la mère.
Utilisation pédiatrique
La sécurité et l’efficacité chez les patients pédiatriques n’ont pas été établies.
Utilisation gériatrique
Aucune différence globale de sécurité ou d’efficacité n’a été observée entre les patients âgés et les patients plus jeunes.
Réactions indésirables
Des réactions indésirables sont survenues avec les médicaments combinés corticostéroïdes/anti-infectieux qui peuvent être attribuées au composant corticostéroïde, au composant anti-infectieux ou à la combinaison. L’incidence exacte n’est pas connue.
Les réactions survenant le plus souvent en raison de la présence du composant anti-infectieux sont des réactions de sensibilisation allergique comprenant des démangeaisons, un gonflement et un érythème conjonctival . Des réactions d’hypersensibilité plus graves, y compris l’anaphylaxie, ont été rarement rapportées.
Les réactions dues au composant corticostéroïde par ordre décroissant de fréquence sont : l’élévation de la pression intraoculaire (PIO) avec le développement possible d’un glaucome, et des lésions du nerf optique peu fréquentes ; la formation d’une cataracte sous-capsulaire postérieure ; et un retard de cicatrisation.
Infection secondaire
Le développement d’une infection secondaire est survenu après l’utilisation d’associations contenant des corticostéroïdes et des antimicrobiens. Les infections fongiques et virales de la cornée sont particulièrement susceptibles de se développer en même temps que les applications à long terme d’un corticostéroïde. La possibilité d’une invasion fongique doit être envisagée dans toute ulcération cornéenne persistante où un traitement par corticostéroïdes a été utilisé.
Une irritation locale lors de l’instillation a également été rapportée.
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Sandoz Inc. au 1-800-525-8747 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
DOSAGE ET ADMINISTRATION
Une ou deux gouttes dans l’œil affecté toutes les 3 ou 4 heures, selon la gravité de l’affection. La suspension peut être utilisée plus fréquemment si nécessaire.
Pas plus de 20 mL ne doivent être prescrits initialement et l’ordonnance ne doit pas être renouvelée sans une évaluation supplémentaire comme indiqué dans la section PRÉCAUTIONS ci-dessus.
COMMENT FOURNIR
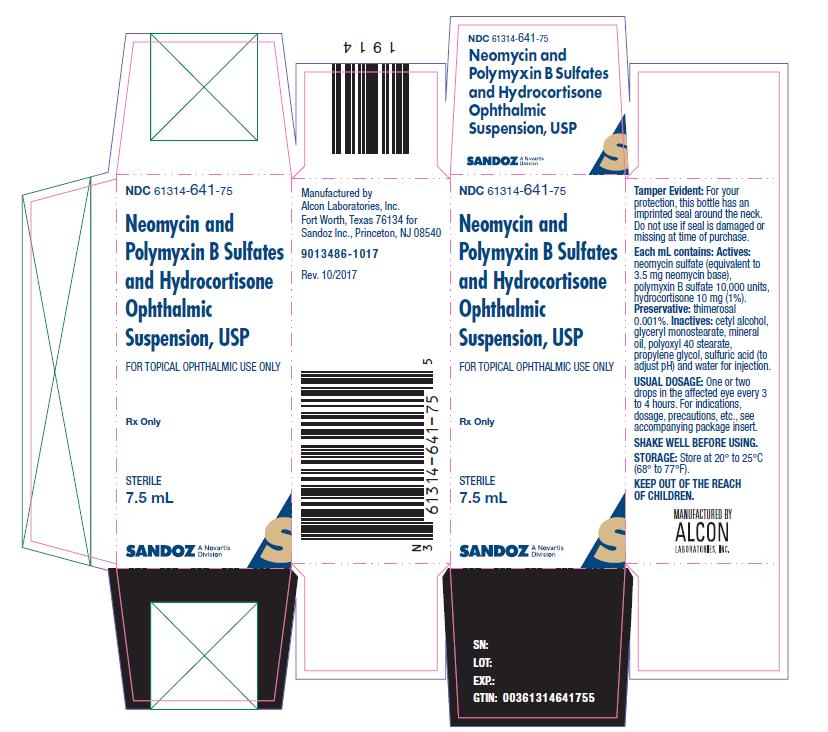
La suspension ophtalmique de néomycine et de sulfates de polymyxine B et d’hydrocortisone est disponible dans une bouteille contenant 7,5 mL. NDC 61314-641-75
Bien aérer avant de l’utiliser.
Réserver entre 20° et 25°C (68° et 77°F).
Fabriqué par
Alcon Laboratories, Inc.
Fort Worth, Texas 76134 pour
Sandoz Inc.
Princeton, NJ 08540
Rev. Juin 2020
Panneau de présentation principal
NDC 61314-641-75
Néomycine et
Polymyxine B Sulfates
et Hydrocortisone
Ophtalmique
Suspension, USP
POUR USAGE OPHTHALMIQUE TOPIQUE SEULEMENT
Rx Only
STERILE
7.5 mL
SANDOZ
| SULFATES DE NEOMYCINE ET DE POLYMYXINE B ET HYDROCORTISONE Sulfate de néomycine, sulfate de polymyxine b et suspension d’hydrocortisone |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Étiqueteur – Sandoz Inc (005387188)
Sandoz Inc
Plus d’informations sur hydrocortisone / néomycine / polymyxine b ophtalmique
. Ressources pour les consommateurs
Ressources professionnelles
Autres marques Suspension ophtalmique Cortisporin Guides de traitement associés
Avis médical . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||