Generischer Name: Neomycinsulfat, Polymyxin B-Sulfat und Hydrocortison
Dosierungsform: ophthalmische Suspension
Medizinisch geprüft von Drugs.com. Last updated on March 1, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Berufliche
- Interaktionen
- Mehr
Nur Rx
BESCHREIBUNG
Neomycin und Polymyxin B Sulfate und Hydrocortison Ophthalmic Suspension ist eine sterile antimikrobielle und entzündungshemmendeentzündungshemmende Suspension zur ophthalmischen Anwendung.
Jeder mL enthält: Wirkstoffe: Neomycinsulfat (entspricht 3,5 mg Neomycinbase), Polymyxin-B-Sulfat, entspricht 10.000 Polymyxin-B-Einheiten, und Hydrocortison 10 mg (1%). Konservierungsmittel: Thimerosal 0,001%. Unwirksame Bestandteile: Cetylalkohol, Glycerylmonostearat, Mineralöl, Polyoxyl 40 stearate, Propylenglykol, Schwefelsäure (zur Einstellung des pH-Wertes) und Wasser für Injektionszwecke.
Neomycinsulfat ist das Sulfatsalz von Neomycin B und C, das durch das Wachstum von Streptomyces fradiae Waksman (Fam. Streptomycetacae) hergestellt wird. Es hat eine Wirksamkeit, die mindestens 600 μg Neomycin-Standard pro mg entspricht, berechnet auf wasserfreier Basis. Seine Strukturformel lautet:
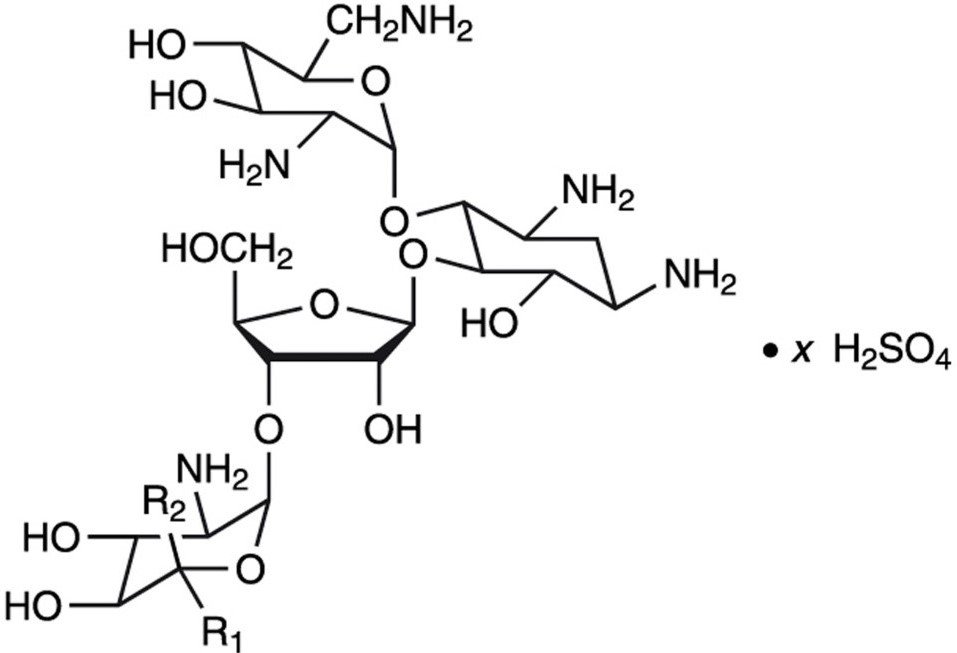
Neomycin B (R1=H, R2=CH2NH2)
Neomycin C (R1=CH2NH2, R2=H)
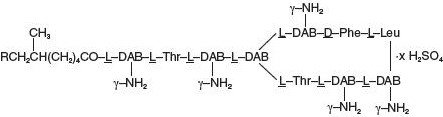
Polymyxin B-Sulfat ist das Sulfatsalz von Polymyxin, B1 und B2, das durch das Wachstum von Bacillus polymyxa (Prazmowski) Migula (Fam. Bacillaceae). Es hat eine Potenz von mindestens 6.000 Polymyxin-B-Einheiten pro mg, berechnet auf wasserfreier Basis. Seine Strukturformel lautet:

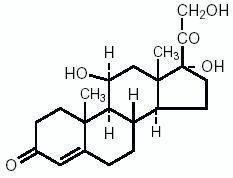
Hydrocortison, 11β, 17, 21-Trihydroxypregn-4-en-3, 20 dion, ist ein entzündungshemmendes Hormon. Seine Strukturformel lautet:
Neomycin, Polymyxin B, Hydrocortison Augensuspension – Klinische Pharmakologie
Kortikosteroide unterdrücken die Entzündungsreaktion auf eine Vielzahl von Wirkstoffen und verzögern oder verlangsamen wahrscheinlich die Heilung. Da Kortikosteroide die körpereigenen Abwehrmechanismen gegen Infektionen hemmen können, können gleichzeitig antimikrobielle Arzneimittel verabreicht werden, wenn diese Hemmung in einem bestimmten Fall als klinisch bedeutsam angesehen wird.
Wenn die Entscheidung getroffen wird, sowohl ein Kortikosteroid als auch antimikrobielle Arzneimittel zu verabreichen, hat die Verabreichung dieser Arzneimittel in Kombination den Vorteil, dass der Patient sie besser befolgt und sie bequemer zu handhaben sind, wobei zusätzlich sichergestellt ist, dass alle Arzneimittel in der richtigen Dosierung verabreicht werden. Wenn jede Art von Medikament in der gleichen Formulierung enthalten ist, ist die Kompatibilität der Inhaltsstoffe gewährleistet, und das richtige Volumen des Medikaments wird abgegeben und gespeichert.
Die relative Wirksamkeit von Kortikosteroiden hängt von der Molekularstruktur, der Konzentration und der Freisetzung aus dem Vehikel ab.
Mikrobiologie
Die antiinfektiösen Komponenten in Neomycin- und Polymyxin-B-Sulfaten und Hydrocortison-Augensuspension sind enthalten, um gegen bestimmte Organismen, die dafür empfänglich sind, zu wirken. Neomycinsulfat und Polymyxin-B-Sulfat sind in vitro gegen empfindliche Stämme der folgenden Mikroorganismen wirksam: Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, Klebsiella/Enterobacter species, Neisseria species und Pseudomonas aeruginosa. Das Produkt bietet keinen ausreichenden Schutz gegen Serratia marcescens und Streptokokken, einschließlich Streptococcus pneumoniae .
Indikationen und Anwendung von Neomycin, Polymyxin B, Hydrocortison Augensuspension
Neomycin und Polymyxin B Sulfate und Hydrocortison Augensuspension ist angezeigt bei auf Steroide ansprechenden entzündlichen Augenerkrankungen, für die ein Kortikosteroid angezeigt ist und bei denen eine bakterielle Infektion oder ein Risiko einer bakteriellen Augeninfektion besteht.
Augenkortikosteroide sind angezeigt bei entzündlichen Erkrankungen der palpebralen und bulbären Bindehaut, der Hornhaut und des vorderen Augenabschnitts, bei denen das mit der Anwendung von Kortikosteroiden verbundene Risiko bei bestimmten infektiösen Bindehautentzündungen in Kauf genommen wird, um eine Verringerung von Ödemen und Entzündungen zu erreichen. Sie sind auch bei chronischer anteriorer Uveitis und Hornhautverletzungen durch chemische, Strahlen- oder thermische Verbrennungen oder das Eindringen von Fremdkörpern indiziert.
Die Verwendung eines Kombinationspräparats mit einer antiinfektiven Komponente ist angezeigt, wenn das Infektionsrisiko hoch ist oder wenn zu erwarten ist, dass eine potenziell gefährliche Anzahl von Bakterien im Auge vorhanden ist.
Die einzelnen antiinfektiven Arzneimittel in diesem Produkt sind gegen die folgenden häufigen bakteriellen Augenpathogene aktiv: Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, Klebsiella/Enterobacter-Arten, Neisseria-Arten und Pseudomonas aeruginosa.
Das Produkt bietet keinen ausreichenden Schutz gegen Serratia marcescens und Streptokokken, einschließlich Streptococcus pneumoniae.
Kontraindikationen
Neomycin und Polymyxin B Sulfate und Hydrocortison Ophthalmic Suspension ist kontraindiziert bei den meisten viralen Erkrankungen der Hornhaut und der Bindehaut, einschließlich: epitheliale Herpes simplex Keratitis (dendritische Keratitis), Vaccinia und Varizellen, sowie bei mykobakteriellen Infektionen des Auges und Pilzerkrankungen der Augenstrukturen.
Neomycin und Polymyxin B Sulfate und Hydrocortison Ophthalmic Suspension ist auch bei Personen kontraindiziert, die eine Überempfindlichkeit gegen einen der Bestandteile gezeigt haben. Eine Überempfindlichkeit gegen die antibiotische Komponente tritt häufiger auf als gegen andere Komponenten.
Warnhinweise
NICHT ZUR INJEKTION IN DAS AUGE. Neomycin und Polymyxin B Sulfate und Hydrocortison Ophthalmic Suspension sollten niemals direkt in die vordere Augenkammer eingebracht werden.
Die längerfristige Anwendung von Kortikosteroiden kann zu einer okulären Hypertension und/oder einem Glaukom mit Schädigung des Sehnervs, Beeinträchtigung der Sehschärfe und des Gesichtsfeldes sowie zur Bildung eines hinteren subkapsulären Katarakts führen.
Die längerfristige Anwendung kann die Wirtsreaktion unterdrücken und damit die Gefahr von Sekundärinfektionen des Auges erhöhen. Bei Erkrankungen, die eine Ausdünnung der Hornhaut oder Sklera verursachen, sind Perforationen bei der Anwendung von topischen Kortikosteroiden bekannt. Bei akuten eitrigen Erkrankungen des Auges können Kortikosteroide eine Infektion verschleiern oder eine bestehende Infektion verstärken.
Werden diese Produkte 10 Tage oder länger angewendet, sollte der Augeninnendruck routinemäßig überwacht werden, auch wenn dies bei unkooperativen Patienten schwierig sein kann. Kortikosteroide sollten bei Vorliegen eines Glaukoms mit Vorsicht eingesetzt werden.
Die Anwendung von Kortikosteroiden nach einer Kataraktoperation kann die Heilung verzögern und das Auftreten von Filterblasen erhöhen. Die Anwendung von okulären Kortikosteroiden kann den Verlauf vieler viraler Infektionen des Auges (einschließlich Herpes simplex) verlängern und deren Schweregrad verschlimmern. Der Einsatz von Kortikosteroiden bei der Behandlung von Herpes simplex erfordert große Vorsicht.
Topische Antibiotika, insbesondere Neomycinsulfat, können eine Sensibilisierung der Haut verursachen. Eine genaue Inzidenz von Überempfindlichkeitsreaktionen (vor allem Hautausschlag) aufgrund topischer Antibiotika ist nicht bekannt. Die Symptome einer Sensibilisierung auf topische Antibiotika sind in der Regel Juckreiz, Rötung und Ödeme der Bindehaut und der Augenlider. Eine Sensibilisierungsreaktion kann sich auch einfach in einer fehlenden Abheilung äußern. Bei langfristiger Anwendung von topischen Antibiotika ist es ratsam, regelmäßig auf solche Anzeichen zu achten, und der Patient sollte darauf hingewiesen werden, das Produkt abzusetzen, wenn sie beobachtet werden. Die Symptome klingen in der Regel schnell ab, wenn das Medikament abgesetzt wird. Die Anwendung von Produkten, die diese Inhaltsstoffe enthalten, sollte für den Patienten danach vermieden werden.
Vorsichtsmaßnahmen
Allgemeines
Die Erstverschreibung und die Erneuerung der Medikamentenbestellung über 20 ml hinaus sollte von einem Arzt nur nach einer Untersuchung des Patienten mit Hilfe von Vergrößerung, wie z. B. Spaltlampen-Biomikroskopie und gegebenenfalls Fluorescein-Färbung, vorgenommen werden. Wenn sich die Anzeichen und Symptome nach 2 Tagen nicht bessern, sollte der Patient erneut untersucht werden.
Die Möglichkeit einer Pilzinfektion der Hornhaut sollte nach längerer Kortikosteroideinnahme in Betracht gezogen werden. Gegebenenfalls sollten Pilzkulturen angelegt werden.
Wenn dieses Produkt 10 Tage oder länger angewendet wird, sollte der Augeninnendruck überwacht werden.
Es gibt Berichte über bakterielle Keratitis im Zusammenhang mit der Anwendung von topischen ophthalmischen Produkten in Mehrfachdosisbehältern, die versehentlich von Patienten verunreinigt wurden, von denen die meisten eine gleichzeitige Hornhauterkrankung oder eine Störung der Augenepitheloberfläche hatten.
Allergische Kreuzreaktionen können auftreten, die die Verwendung eines oder aller der folgenden Antibiotika für die Behandlung zukünftiger Infektionen verhindern könnten: Kanamycin, Paromomycin, Streptomycin und möglicherweise Gentamicin.
Informationen für Patienten
Die Patienten sollten angewiesen werden, den Kontakt der Spitze des Spenderbehälters mit dem Auge, dem Augenlid, den Fingern oder einer anderen Oberfläche zu vermeiden. Die Verwendung dieses Produkts durch mehr als eine Person kann die Infektion verbreiten.
Die Patienten sollten auch darüber belehrt werden, dass Augenprodukte bei unsachgemäßer Handhabung durch häufige Bakterien kontaminiert werden können, die bekanntermaßen Augeninfektionen verursachen. Wenn der Zustand anhält oder sich verschlimmert, oder wenn ein Ausschlag oder eine allergische Reaktion auftritt, sollte der Patient angewiesen werden, die Anwendung abzubrechen und einen Arzt aufzusuchen. Verwenden Sie dieses Produkt nicht, wenn Sie auf einen der aufgeführten Inhaltsstoffe allergisch sind.
Bei Nichtgebrauch fest verschlossen halten. Außerhalb der Reichweite von Kindern aufbewahren.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Langzeitstudien an Tieren zur Bewertung des karzinogenen oder mutagenen Potentials wurden mit Polymyxin B-Sulfat nicht durchgeführt. Die Behandlung kultivierter menschlicher Lymphozyten in vitro mit Neomycin erhöhte die Häufigkeit von Chromosomenaberrationen bei den höchsten getesteten Konzentrationen (80 ug/mL); die Auswirkungen von Neomycin auf die Karzinogenese und Mutagenese beim Menschen sind jedoch unbekannt.
Langzeitstudien an Tieren (Ratten, Kaninchen, Mäuse) ergaben keine Hinweise auf Karzinogenität oder Mutagenität, die auf die orale Verabreichung von Kortikosteroiden zurückzuführen sind. Langfristige Tierstudien zur Bewertung des karzinogenen Potenzials topischer Kortikosteroide wurden nicht durchgeführt. Studien zur Bestimmung der Mutagenität von Hydrocortison haben negative Ergebnisse erbracht. Die Verwendung von Kortikosteroiden bei der Behandlung von Herpes simplex erfordert große Vorsicht. Es wurde berichtet, dass Polymyxin B die Beweglichkeit der Spermien von Pferden beeinträchtigt, aber seine Auswirkungen auf die männliche oder weibliche Fruchtbarkeit sind unbekannt. Es wurden keine Langzeitstudien an Tieren durchgeführt, um die Auswirkungen topischer Kortikosteroide auf die Fruchtbarkeit zu bewerten.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C. Kortikosteroide haben sich bei Kaninchen als teratogen erwiesen, wenn sie topisch in einer Konzentration von 0,5% an den Tagen 6 -18 der Trächtigkeit angewendet wurden, und bei Mäusen, wenn sie topisch in einer Konzentration von 15% an den Tagen 10 -13 der Trächtigkeit angewendet wurden. Es liegen keine angemessenen und gut kontrollierten Studien an schwangeren Frauen vor. Neomycin- und Polymyxin-B-Sulfate und Hydrocortison-Augensuspension sollten während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen das potentielle Risiko für den Fötus rechtfertigt.
Stillende Mütter
Es ist nicht bekannt, ob die topische Verabreichung von Kortikosteroiden zu einer ausreichenden systemischen Absorption führen könnte, um nachweisbare Mengen in der menschlichen Milch zu erzeugen. Systemisch verabreichte Kortikosteroide treten in der Muttermilch auf und könnten das Wachstum unterdrücken, die körpereigene Kortikosteroidproduktion beeinträchtigen oder andere unerwünschte Wirkungen hervorrufen. Aufgrund des Potenzials für schwerwiegende unerwünschte Wirkungen von Neomycin- und Polymyxin-B-Sulfaten und Hydrocortison-Augensuspension bei stillenden Säuglingen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen unterbrochen oder das Arzneimittel abgesetzt werden soll.
Pädiatrische Anwendung
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten ist nicht erwiesen.
Anwendung bei älteren Patienten
Es wurden keine allgemeinen Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet.
Nebenwirkungen
Nebenwirkungen sind bei Kortikosteroid/Antiinfektiva-Kombinationspräparaten aufgetreten, die auf die Kortikosteroid-Komponente, die Antiinfektiva-Komponente oder die Kombination zurückgeführt werden können. Die genaue Häufigkeit ist nicht bekannt.
Reaktionen, die am häufigsten auf das Vorhandensein des antiinfektiven Bestandteils zurückzuführen sind, sind allergische Sensibilisierungsreaktionen einschließlich Juckreiz, Schwellung und Bindehautrötung. Selten wurde über schwerwiegendere Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie, berichtet.
Die auf die Kortikosteroidkomponente zurückzuführenden Reaktionen sind in abnehmender Reihenfolge ihrer Häufigkeit: Erhöhung des Augeninnendrucks (IOD) mit möglicher Entwicklung eines Glaukoms und seltener Schädigung des Sehnervs, Bildung eines hinteren subkapsulären Katarakts und verzögerte Wundheilung.
Sekundärinfektionen
Die Entwicklung von Sekundärinfektionen ist nach der Anwendung von Kombinationen aus Kortikosteroiden und antimikrobiellen Mitteln aufgetreten. Pilz- und Virusinfektionen der Hornhaut sind besonders anfällig dafür, sich gleichzeitig mit der Langzeitanwendung eines Kortikosteroids zu entwickeln. Die Möglichkeit einer Pilzinvasion muss bei jeder persistierenden Hornhautulzeration in Betracht gezogen werden, die mit Kortikosteroiden behandelt wurde.
Es wurde auch über lokale Reizungen bei der Instillation berichtet.
Um VERMUTETE UNERWÜNSCHTE REAKTIONEN zu melden, wenden Sie sich an Sandoz Inc. unter 1-800-525-8747 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
DOSIERUNG UND ANWENDUNG
Ein oder zwei Tropfen in das betroffene Auge alle 3 oder 4 Stunden, je nach Schwere der Erkrankung. Die Suspension kann bei Bedarf häufiger angewendet werden.
Anfänglich sollten nicht mehr als 20 ml verschrieben werden, und das Rezept sollte nicht ohne weitere Prüfung, wie unter VORSICHTSMASSNAHMEN oben beschrieben, nachgefüllt werden.
VERBRAUCHSANWEIS
Neomycin und Polymyxin B Sulfate und Hydrocortison Augensuspension ist in einer Flasche mit 7,5 ml erhältlich. NDC 61314-641-75
Vor Gebrauch gut durchschütteln.
Bei 20° bis 25°C lagern.
Hergestellt von
Alcon Laboratories, Inc.
Fort Worth, Texas 76134 für
Sandoz Inc.
Princeton, NJ 08540
Rev. Juni 2020
PRINCIPAL DISPLAY PANEL
NDC 61314-641-75
Neomycin und
Polymyxin B Sulfate
und Hydrocortison
Ophthalmic
Suspension, USP
NUR ZUR TOPISCHEN OPHTHALMISCHEN VERWENDUNG
Nur Rx
STERILE
7.5 mL
SANDOZ
| NEOMYCIN UND POLYMYXIN B SULFATE UND HYDROCORTISONE Neomycinsulfat, Polymyxin-B-Sulfat und Hydrocortison-Suspension |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etikettierer – Sandoz Inc (005387188)
Mehr über Hydrocortison / Neomycin / Polymyxin b ophthalmic
- Nebenwirkungen
- Während der Schwangerschaft
- Dosierungshinweise
- Medikamentöse Wechselwirkungen
- Preisangaben &Gutscheine
- En Español
- 1 Bewertung
- Medikamentenklasse: Ophthalmische Steroide mit Antiinfektiva
Verbraucherinformationen
- Patienteninformationen
- Neomycin, Polymyxin b, und Hydrocortison Ophthalmic (Advanced Reading)
Fachinformationen
- Verschreibungsinformationen
Andere Marken Cortisporin Ophthalmic Suspension
Verwandte Behandlungsleitfäden
- Brennhautentzündung, Bakterielle
- Blepharitis
- Keratitis
- Keratoconjunctivitis
- Uveitis
Medizinischer Haftungsausschluss