Nombre genérico: Sulfato de neomicina, sulfato de polimixina b e hidrocortisona
Forma farmacéutica: suspensión oftálmica
Revisado médicamente por Drugs.com. Última actualización el 1 de marzo de 2020.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
Sólo con receta
DESCRIPCIÓN
Sulfatos de neomicina y polimixina B e hidrocortisona en suspensión oftálmica es una suspensión estéril antimicrobiana y antiinflamatoria para uso oftálmico.
Cada mL contiene: Activos: sulfato de neomicina (equivalente a 3,5 mg de neomicina base), sulfato de polimixina B equivalente a 10.000 unidades de polimixina B e hidrocortisona 10 mg (1%). Conservante: timerosal 0,001%. Inactivos: alcohol cetílico, monoestearato de glicerilo, aceite mineral, estearato de polioxilo 40, propilenglicol, ácido sulfúrico (para ajustar el pH) y agua para inyección.
El sulfato de neomicina es la sal de sulfato de la neomicina B y C, que se produce por el crecimiento de Streptomyces fradiae Waksman (Fam. Streptomycetacae). Tiene una potencia equivalente a no menos de 600 μg de neomicina estándar por mg, calculada en base anhidra. Su fórmula estructural es:
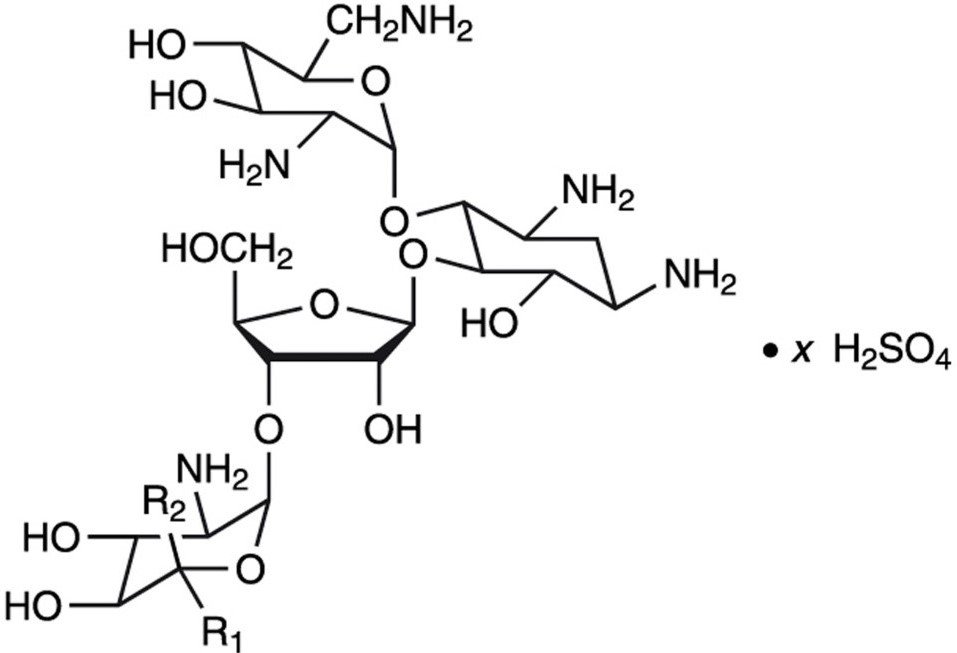
Neomicina B (R1=H, R2=CH2NH2)
Neomicina C (R1=CH2NH2, R2=H)
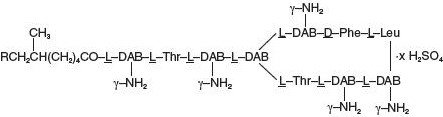
El sulfato de polimixina B es la sal de sulfato de la polimixina, B1 y B2, que se producen por el crecimiento de Bacillus polymyxa (Prazmowski) Migula (Fam. Bacillaceae). Tiene una potencia de no menos de 6.000 unidades de polimixina B por mg calculada en base anhidra. Su fórmula estructural es:

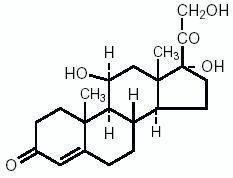
La hidrocortisona, 11β, 17, 21-trihidroxipregn-4-ene-3, 20 diona, es una hormona antiinflamatoria. Su fórmula estructural es:
Neomicina, Polimixina B, Hidrocortisona Suspensión Oftálmica – Farmacología Clínica
Los corticosteroides suprimen la respuesta inflamatoria a una variedad de agentes, y probablemente retrasan o retardan la cicatrización. Dado que los corticosteroides pueden inhibir el mecanismo de defensa del organismo contra las infecciones, pueden utilizarse fármacos antimicrobianos concomitantes cuando se considere que esta inhibición es clínicamente significativa en un caso concreto.
Cuando se decide administrar tanto un corticosteroide como antimicrobianos, la administración de dichos fármacos en combinación tiene la ventaja de un mayor cumplimiento y comodidad para el paciente, con la seguridad añadida de que se administra la dosis adecuada de todos los fármacos. Cuando cada tipo de fármaco está en la misma formulación, se asegura la compatibilidad de los ingredientes y se administra y retiene el volumen correcto de fármaco.
La potencia relativa de los corticosteroides depende de la estructura molecular, la concentración y la liberación del vehículo.
Microbiología
Los componentes antiinfecciosos de los sulfatos de neomicina y polimixina B y de la suspensión oftálmica de hidrocortisona se incluyen para proporcionar una acción contra organismos específicos susceptibles a ella. El sulfato de neomicina y el sulfato de polimixina B son activos in vitro contra cepas susceptibles de los siguientes microorganismos Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, especies de Klebsiella/Enterobacter, especies de Neisseria y Pseudomonas aeruginosa. El producto no proporciona una cobertura adecuada contra Serratia marcescens y estreptococos, incluido Streptococcus pneumoniae .
Indicaciones y uso de Neomicina, Polimixina B, Hidrocortisona Suspensión Oftálmica
Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica está indicada para las afecciones oculares inflamatorias que responden a los esteroides para las que está indicado un corticosteroide y en las que existe infección bacteriana o riesgo de infección ocular bacteriana.
Los corticosteroides oculares están indicados en las afecciones inflamatorias de la conjuntiva palpebral y bulbar, la córnea y el segmento anterior del globo donde se acepta el riesgo inherente al uso de corticosteroides en ciertas conjuntivitis infecciosas para obtener una disminución del edema y la inflamación. También están indicados en la uveítis anterior crónica y en las lesiones corneales producidas por quemaduras químicas, por radiación o térmicas, o por la penetración de cuerpos extraños.
El uso de un medicamento combinado con un componente antiinfeccioso está indicado cuando el riesgo de infección es elevado o cuando se espera que haya un número potencialmente peligroso de bacterias en el ojo.
Los medicamentos antiinfecciosos concretos de este producto son activos frente a los siguientes patógenos oculares bacterianos comunes: Staphylococcus aureus, Escherichia coli, Haemophilus influenzae, especies de Klebsiella/Enterobacter, especies de Neisseria y Pseudomonas aeruginosa.
El producto no proporciona una cobertura adecuada frente a Serratia marcescens y estreptococos, incluido Streptococcus pneumoniae.
Contraindicaciones
Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica está contraindicada en la mayoría de las enfermedades víricas de la córnea y la conjuntiva, incluyendo: queratitis epitelial por herpes simple (queratitis dendrítica), vaccinia y varicela, y también en la infección micobacteriana del ojo y en las enfermedades fúngicas de las estructuras oculares.
Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica está también contraindicada en individuos que hayan mostrado hipersensibilidad a cualquiera de sus componentes. La hipersensibilidad al componente antibiótico se produce en mayor proporción que a otros componentes.
Advertencias
NO SE DEBE INYECTAR EN EL OJO. Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica nunca deben introducirse directamente en la cámara anterior del ojo.
El uso prolongado de corticosteroides puede provocar hipertensión ocular y/o glaucoma, con daños en el nervio óptico, defectos en la agudeza visual y en los campos de visión, y formación de cataratas subcapsulares posteriores.
El uso prolongado puede suprimir la respuesta del huésped y aumentar así el riesgo de infecciones oculares secundarias. En aquellas enfermedades que provocan el adelgazamiento de la córnea o la esclerótica, se sabe que se producen perforaciones con el uso de corticosteroides tópicos. En las afecciones purulentas agudas del ojo, los corticosteroides pueden enmascarar la infección o potenciar la existente.
Si estos productos se utilizan durante 10 días o más, la presión intraocular debe controlarse de forma rutinaria, aunque pueda resultar difícil en pacientes poco colaboradores. Los corticosteroides deben utilizarse con precaución en presencia de glaucoma.
El uso de corticosteroides después de la cirugía de cataratas puede retrasar la cicatrización y aumentar la incidencia de hemorragias filtrantes. El uso de corticosteroides oculares puede prolongar el curso y puede exacerbar la gravedad de muchas infecciones víricas del ojo (incluido el herpes simple). El empleo de corticosteroides en el tratamiento del herpes simple requiere gran precaución.
Los antibióticos tópicos, en particular, el sulfato de neomicina, pueden causar sensibilización cutánea. No se conoce la incidencia exacta de las reacciones de hipersensibilidad (principalmente erupción cutánea) debidas a los antibióticos tópicos. Las manifestaciones de sensibilización a los antibióticos tópicos suelen ser picor, enrojecimiento y edema de la conjuntiva y el párpado. Una reacción de sensibilización puede manifestarse simplemente como una falta de curación. Durante el uso a largo plazo de productos antibióticos tópicos, es aconsejable un examen periódico para detectar estos signos, y debe indicarse al paciente que interrumpa el producto si los observa. Los síntomas suelen remitir rápidamente al retirar la medicación. A partir de entonces debe evitarse la aplicación de productos que contengan estos ingredientes al paciente.
Precauciones
Generales
La prescripción inicial y la renovación de la orden de medicación más allá de los 20 mL deben ser realizadas por un médico sólo después de examinar al paciente con la ayuda de una ampliación, como la biomicroscopía con lámpara de hendidura y, en su caso, la tinción con fluoresceína. Si los signos y síntomas no mejoran después de 2 días, el paciente debe ser reevaluado.
La posibilidad de infecciones fúngicas de la córnea debe considerarse después de una dosis prolongada de corticosteroides. Se deben realizar cultivos de hongos cuando sea apropiado.
Si este producto se utiliza durante 10 días o más, se debe monitorizar la presión intraocular.
Se han notificado queratitis bacterianas asociadas al uso de productos oftálmicos tópicos en envases de dosis múltiples que han sido contaminados inadvertidamente por los pacientes, la mayoría de los cuales tenían una enfermedad corneal concurrente o una alteración de la superficie epitelial ocular .
Pueden producirse reacciones cruzadas alérgicas que podrían impedir el uso de alguno o todos los siguientes antibióticos para el tratamiento de futuras infecciones: kanamicina, paromomicina, estreptomicina y, posiblemente, gentamicina.
Información para los pacientes
Se debe instruir a los pacientes para que eviten que la punta del envase dispensador entre en contacto con el ojo, el párpado, los dedos o cualquier otra superficie. El uso de este producto por parte de más de una persona puede propagar la infección.
También se debe instruir a los pacientes que los productos oculares, si se manipulan de forma inadecuada, pueden contaminarse con bacterias comunes conocidas por causar infecciones oculares. El uso de productos contaminados puede provocar daños graves en los ojos y la consiguiente pérdida de visión.
Si la afección persiste o empeora, o si se produce una erupción o una reacción alérgica, se debe aconsejar al paciente que interrumpa su uso y consulte a un médico. No utilice este producto si es alérgico a alguno de los ingredientes de la lista.
Mantener bien cerrado cuando no se utilice. Mantener fuera del alcance de los niños.
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico o mutagénico con el sulfato de polimixina B. El tratamiento de linfocitos humanos cultivados in vitro con neomicina aumentó la frecuencia de aberraciones cromosómicas a las concentraciones más altas (80 ug/mL) probadas; sin embargo, se desconocen los efectos de la neomicina sobre la carcinogénesis y la mutagénesis en humanos.
Los estudios a largo plazo en animales (ratas, conejos, ratones) no mostraron evidencia de carcinogenicidad o mutagenicidad atribuible a la administración oral de corticosteroides. No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de los corticosteroides tópicos. Los estudios para determinar la mutagenicidad con hidrocortisona han revelado resultados negativos. El uso de medicamentos corticosteroides en el tratamiento del herpes simple requiere gran precaución. Se ha informado de que la polimixina B deteriora la motilidad del esperma equino, pero se desconocen sus efectos sobre la fertilidad masculina o femenina. No se han realizado estudios a largo plazo en animales para evaluar el efecto sobre la fertilidad de los corticosteroides tópicos.
Embarazo
Efectos teratogénicos
Categoría de embarazo C. Se ha comprobado que los corticosteroides son teratogénicos en conejos cuando se aplican tópicamente a concentraciones del 0,5% en los días 6 -18 de gestación y en ratones cuando se aplican tópicamente a una concentración del 15% en los días 10 -13 de gestación. No existen estudios adecuados y bien controlados en mujeres embarazadas. Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica deben utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
No se sabe si la administración tópica de corticosteroides podría dar lugar a una absorción sistémica suficiente para producir cantidades detectables en la leche humana. Los corticosteroides administrados sistémicamente aparecen en la leche humana y podrían suprimir el crecimiento, interferir con la producción endógena de corticosteroides o causar otros efectos adversos. Debido a la posibilidad de que se produzcan reacciones adversas graves en los lactantes a causa de Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica, se debe decidir si se interrumpe la lactancia o se suspende el medicamento, teniendo en cuenta la importancia del mismo para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Uso geriátrico
No se han observado diferencias globales en cuanto a la seguridad o la eficacia entre los pacientes de edad avanzada y los más jóvenes.
Reacciones adversas
Se han producido reacciones adversas con los medicamentos combinados de corticosteroides y antiinfecciosos que pueden atribuirse al componente corticosteroide, al componente antiinfeccioso o a la combinación. No se conoce la incidencia exacta.
Las reacciones que se producen con mayor frecuencia por la presencia del ingrediente antiinfeccioso son reacciones de sensibilización alérgica que incluyen picor, hinchazón y eritema conjuntival . Raramente se han notificado reacciones de hipersensibilidad más graves, incluyendo anafilaxia.
Las reacciones debidas al componente corticoesteroide en orden decreciente de frecuencia son: elevación de la presión intraocular (PIO) con posible desarrollo de glaucoma, y daño infrecuente del nervio óptico; formación de cataratas subcapsulares posteriores; y retraso en la cicatrización de heridas.
Infección secundaria
El desarrollo de una infección secundaria se ha producido tras el uso de combinaciones que contienen corticosteroides y antimicrobianos. Las infecciones fúngicas y víricas de la córnea son especialmente propensas a desarrollarse coincidiendo con aplicaciones prolongadas de un corticosteroide. Debe considerarse la posibilidad de invasión fúngica en cualquier ulceración corneal persistente en la que se haya utilizado un tratamiento con corticosteroides.
También se ha notificado irritación local en la instilación.
Para notificar Sospechas de Reacciones Adversas, póngase en contacto con Sandoz Inc. en el 1-800-525-8747 o con la FDA en el 1-800-FDA-1088 o en www.fda.gov/medwatch.
DOSIS Y ADMINISTRACIÓN
Una o dos gotas en el ojo afectado cada 3 ó 4 horas, dependiendo de la gravedad de la afección. La suspensión puede utilizarse con más frecuencia si es necesario.
Inicialmente no deben prescribirse más de 20 mL y la prescripción no debe renovarse sin una evaluación adicional como se indica en las PRECAUCIONES anteriores.
Cómo se suministra
Neomicina y Polimixina B Sulfatos e Hidrocortisona Suspensión Oftálmica está disponible en un frasco que contiene 7,5 mL. NDC 61314-641-75
Aclarar bien antes de usar.
Almacenar entre 20° y 25°C (68° y 77°F).
Fabricado por
Alcon Laboratories, Inc.
Fort Worth, Texas 76134 para
Sandoz Inc.
Princeton, NJ 08540
Rev. Junio de 2020
Panel de presentación principal
NDC 61314-641-75
Neomicina y
Sulfatos de polimixina B
e hidrocortisona
Oftálmica
Suspensión, USP
SÓLO PARA USO OFTÁLMICO TÓPICO
Sólo Rx
Serpiente
7.5 mL
SANDOZ
| SULFATOS DE NEOMICINA Y POLIMIXINA B E HIDROCORTISONA Sulfato de neomicina, sulfato de polimixina b y suspensión de hidrocortisona |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiquetador – Sandoz Inc (005387188)
Más información sobre hidrocortisona / neomicina / polimixina b oftálmica
- Efectos secundarios
- Durante el embarazo
- Información sobre la dosis
- Interacciones con otros medicamentos
- Precios &Cupones
- En español
- 1 Revisión
- Clase de fármaco: Esteroides oftálmicos con antiinfecciosos
Recursos para el consumidor
- Información para el paciente
- Neomicina, polimixina b, e hidrocortisona Oftálmica (Lectura avanzada)
Recursos para profesionales
- Información para la prescripción
Otras marcas Cortisporina Suspensión Oftálmica
Guías de tratamiento relacionadas
- Conjuntivitis, bacteriana
- Blefaritis
- Queratitis
- Queratoconjuntivitis
- Uveítis
Descargo de responsabilidad médica