Elektronová konfigurace a tabulka
„Periodická“ povaha chemických vlastností, kterou objevil Mendělejev, souvisí s elektronovou konfigurací atomů prvků. Jinými slovy, způsob, jakým jsou elektrony atomu uspořádány kolem jeho jádra, ovlivňuje vlastnosti atomu.
Teorie atomu Nielse Bohra nám říká, že elektrony nejsou kolem jádra atomu rozmístěny náhodně, ale vyskytují se v určitých elektronových slupkách (více informací najdete v našem modulu Teorie atomu II). Každá slupka má omezenou kapacitu pro elektrony. Jak se zaplňují nižší slupky, další elektrony se nacházejí ve vzdálenějších slupkách.
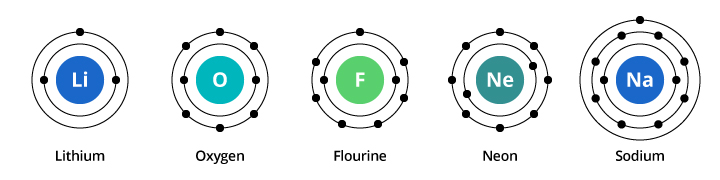
Kapacita první elektronové slupky je dva elektrony a pro druhou slupku je kapacita osm elektronů. V našem výše diskutovaném příkladu tedy kyslík s osmi protony a osmi elektrony nese dva elektrony v první slupce a šest elektronů ve druhé slupce. Fluor s devíti elektrony nese dva ve své první slupce a sedm ve druhé. Neon s deseti elektrony má dva elektrony v první slupce a osm ve druhé. Protože se počet elektronů ve druhé slupce zvyšuje, můžeme si začít představovat, proč se chemické vlastnosti postupně mění, jak přecházíme od kyslíku přes fluor k neonu.
Sodík má jedenáct elektronů. Dva se vejdou do jeho první slupky, ale nezapomeňte, že druhá slupka může nést pouze osm elektronů. Jedenáctý elektron sodíku se nevejde ani do první, ani do druhé slupky. Tento elektron se usídlí na dalším orbitu, třetím elektronovém obalu sodíku. Důvodem, proč dochází k dramatické změně chemických vlastností při přechodu od neonu k sodíku, je dramatický posun v elektronové konfiguraci mezi těmito dvěma prvky. Proč je ale sodík podobný lithiu? Podívejme se na elektronové konfigurace těchto prvků.
Jak vidíte na obrázku, zatímco sodík má tři elektronové slupky a lithium dvě, jejich společnou vlastností je, že oba mají v nejvnější elektronové slupce pouze jeden elektron. Tyto elektrony vnějšího obalu (nazývané valenční elektrony) jsou důležité pro určení chemických vlastností prvků.
Chemické vlastnosti prvku jsou určeny způsobem, jakým jeho atomy interagují s jinými atomy. Pokud si představíme vnější (valenční) elektronový obal atomu jako kouli zahrnující vše uvnitř, pak je to pouze valenční obal, který může interagovat s ostatními atomy – podobně jako je to pouze barva na vnější straně vašeho domu, která „interaguje“ s dešťovou vodou a smáčí se jí.
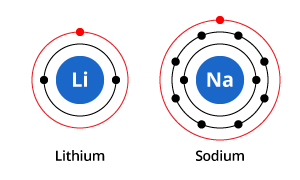
Elektrony valenčního obalu atomu určují způsob, jakým bude atom interagovat se sousedními atomy, a tím určují jeho chemické vlastnosti. Protože sodík i lithium mají jeden valenční elektron, mají podobné chemické vlastnosti.
Kontrola porozumění
Chemické vlastnosti prvku jsou určeny počtem elektronů v
valenčním obalu.