La configurazione degli elettroni e la tavola
La natura “periodica” delle proprietà chimiche che Mendeleev aveva scoperto è legata alla configurazione elettronica degli atomi degli elementi. In altre parole, il modo in cui gli elettroni di un atomo sono disposti intorno al suo nucleo influenza le proprietà dell’atomo.
La teoria dell’atomo di Niels Bohr ci dice che gli elettroni non sono disposti a caso intorno al nucleo di un atomo, ma si trovano in specifici gusci elettronici (vedi il nostro modulo Teoria Atomica II per maggiori informazioni). Ogni guscio ha una capacità limitata di elettroni. Man mano che i gusci inferiori vengono riempiti, altri elettroni risiedono in gusci più lontani.
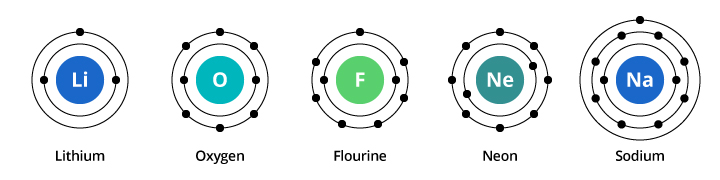
La capacità del primo guscio di elettroni è di due elettroni e per il secondo guscio la capacità è di otto. Così, nel nostro esempio discusso sopra, l’ossigeno, con otto protoni e otto elettroni, porta due elettroni nel suo primo guscio e sei nel suo secondo guscio. Il fluoro, con nove elettroni, ne porta due nel suo primo guscio e sette nel secondo. Il neon, con dieci elettroni, ne porta due nel primo e otto nel secondo. Poiché il numero di elettroni nel secondo guscio aumenta, possiamo cominciare a immaginare perché le proprietà chimiche cambiano gradualmente quando si passa dall’ossigeno al fluoro al neon.
Il sodio ha undici elettroni. Due stanno nel suo primo guscio, ma ricordate che il secondo guscio può portare solo otto elettroni. L’undicesimo elettrone del sodio non può stare né nel primo né nel secondo guscio. Questo elettrone prende residenza in un’altra orbita, un terzo guscio elettronico nel sodio. La ragione per cui c’è un drammatico cambiamento nelle proprietà chimiche quando si passa dal neon al sodio è perché c’è un drammatico cambiamento nella configurazione elettronica tra i due elementi. Ma perché il sodio è simile al litio? Guardiamo le configurazioni elettroniche di questi elementi.
Come puoi vedere nell’illustrazione, mentre il sodio ha tre gusci elettronici e il litio due, la caratteristica che hanno in comune è che entrambi hanno un solo elettrone nel loro guscio elettronico più esterno. Questi elettroni del guscio esterno (chiamati elettroni di valenza) sono importanti nel determinare le proprietà chimiche degli elementi.
Le proprietà chimiche di un elemento sono determinate dal modo in cui i suoi atomi interagiscono con altri atomi. Se immaginiamo il guscio elettronico esterno (di valenza) di un atomo come una sfera che racchiude tutto ciò che c’è dentro, allora è solo il guscio di valenza che può interagire con altri atomi – allo stesso modo in cui è solo la vernice all’esterno della tua casa che “interagisce” con l’acqua piovana e la bagna.
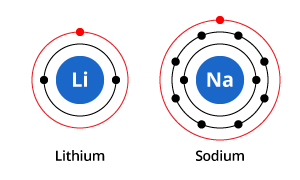
Gli elettroni del guscio di valenza di un atomo determinano il modo in cui esso interagirà con gli atomi vicini, e quindi determinano le sue proprietà chimiche. Poiché sia il sodio che il litio hanno un solo elettrone di valenza, condividono proprietà chimiche simili.
Comprensione Checkpoint
Le proprietà chimiche di un elemento sono determinate dal numero di elettroni in