電子配置と表
メンデレーエフが発見した化学的性質の「周期性」は、元素の原子の電子配置と関係がある。 つまり、原子の電子が原子核の周りにどのように配置されているかによって、原子の性質が左右されるのである。
ニールス・ボーアの原子論では、電子は原子核の周りにランダムに配置されているのではなく、特定の電子殻(詳しくは原子論IIモジュールを参照)内に存在していることが示されています。 各殻の電子の収容量には限りがあります。 低い殻が満たされると、より遠くの殻に電子が存在するようになります。
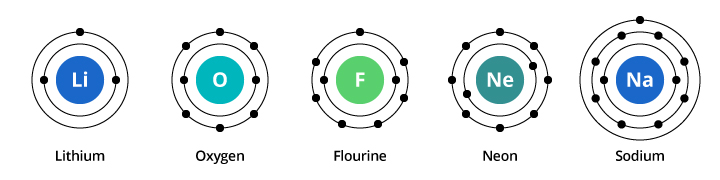
第一電子殻の容量は2個で、第二電子殻の容量は8個です。 したがって、前述の例では、8個の陽子と8個の電子を持つ酸素は、第1殻に2個の電子を、第2殻に6個の電子を持ちます。 フッ素は9個の電子を持ち、第1殻に2個、第2殻に7個の電子を持ちます。 ネオンは10個の電子を持ち、第一殻に2個、第二殻に8個の電子を持っています。 酸素、フッ素、ネオンと進むにつれて、第2殻の電子の数が増えていくので、化学的性質が徐々に変化していくことが想像できるようになります。
ナトリウムは11個の電子を持っています。 2個は第1殻に入りますが、第2殻には8個の電子しか入らないことを覚えておいてください。 ナトリウムの11個目の電子は、第1殻にも第2殻にも入りません。 この電子は、さらに別の軌道、つまりナトリウムの第3電子殻に居を構えることになります。 ネオンからナトリウムに移ると化学的性質が劇的に変化するのは、この2つの元素の間で電子配置が劇的に変化しているからなのです。 しかし、なぜナトリウムはリチウムと似ているのでしょうか? これらの元素の電子配置を見てみましょう。
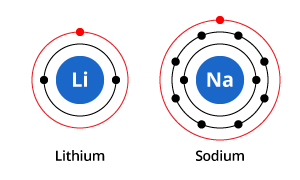
図にあるように、ナトリウムは電子殻が3つ、リチウムは2つですが、両者に共通する特徴は、最外殻に1つだけ電子を持っていることです。 この外殻の電子(価電子といいます)は、元素の化学的性質を決める上で重要なものです。
元素の化学的性質は、その原子が他の原子とどのように相互作用するかによって決定されます。 原子の外側の(価)電子殻を、内側のすべてを包む球体と見なすと、他の原子と相互作用できるのは価電子殻だけです。これは、雨水と「相互作用」して濡れるのは家の外壁の塗料だけであるのとほぼ同じです。
原子の価電子帯によって、隣接する原子との相互作用が決まり、その化学特性が決定されるのである。
理解度チェックポイント
元素の化学的性質は、
の電子の数で決まります。