Elektronkonfiguration og tabellen
Den “periodiske” karakter af kemiske egenskaber, som Mendelejev havde opdaget, er relateret til elektronkonfigurationen af grundstoffernes atomer. Med andre ord påvirker den måde, hvorpå et atoms elektroner er anbragt omkring dets kerne, atomets egenskaber.
Niels Bohrs teori om atomet fortæller os, at elektronerne ikke er placeret tilfældigt omkring et atoms kerne, men at de optræder i bestemte elektronskaller (se vores modul Atomteori II for flere oplysninger). Hver skal har en begrænset kapacitet for elektroner. Efterhånden som de nederste skaller er fyldt op, befinder yderligere elektroner sig i mere fjerntliggende skaller.
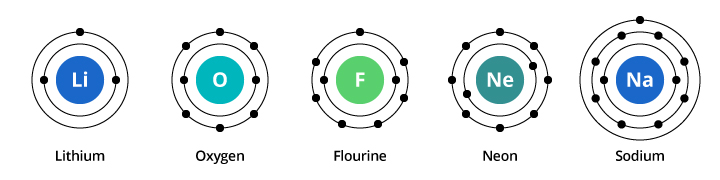
Kapaciteten i den første elektronskal er to elektroner, og for den anden skal er kapaciteten otte elektroner. I vores ovenfor behandlede eksempel bærer ilt med otte protoner og otte elektroner således to elektroner i sin første skal og seks i sin anden skal. Fluor med ni elektroner har to elektroner i sin første skal og syv i den anden. Neon, der har ti elektroner, har to i den første og otte i den anden. Da antallet af elektroner i den anden skal stiger, kan vi begynde at forestille os, hvorfor de kemiske egenskaber gradvist ændrer sig, når vi bevæger os fra ilt til fluor til neon.
Sodium har elleve elektroner. To passer i dets første skal, men husk, at den anden skal kun kan bære otte elektroner. Natriums ellevte elektron kan ikke passe ind i hverken den første eller den anden skal. Denne elektron tager plads i endnu en bane, en tredje elektronskal i natrium. Grunden til, at der sker et dramatisk skift i de kemiske egenskaber, når man går fra neon til natrium, er, at der sker et dramatisk skift i elektronkonfiguration mellem de to grundstoffer. Men hvorfor ligner natrium og lithium hinanden? Lad os se på elektronkonfigurationen for disse grundstoffer.
Som du kan se på illustrationen, har natrium tre elektronskaller og lithium to, men det fælles kendetegn er, at de begge kun har én elektron i deres yderste elektronskal. Disse elektroner i den yderste elektronskal (kaldet valenselektroner) er vigtige for at bestemme grundstoffernes kemiske egenskaber.
Et grundstofs kemiske egenskaber bestemmes af den måde, hvorpå dets atomer interagerer med andre atomer. Hvis vi forestiller os et atoms ydre (valens)elektronskal som en kugle, der omslutter alt indeni, så er det kun valensskallen, der kan interagere med andre atomer – på samme måde som det kun er malingen på ydersiden af dit hus, der “interagerer” med og bliver våd af regnvand.
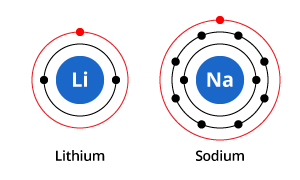
Valensskalelektronerne i et atom bestemmer den måde, det vil interagere med naboatomer på, og bestemmer derfor dets kemiske egenskaber. Da både natrium og lithium har én valenselektron, har de samme kemiske egenskaber.
Forståelseskontrolpunkt
De kemiske egenskaber af et grundstof bestemmes af antallet af elektroner i