Elektronenconfiguratie en de tabel
Het “periodieke” karakter van de chemische eigenschappen, dat Mendelejev had ontdekt, houdt verband met de elektronenconfiguratie van de atomen van de elementen. Met andere woorden, de wijze waarop de elektronen van een atoom rond de kern zijn gerangschikt, beïnvloedt de eigenschappen van het atoom.
Niels Bohrs atoomtheorie vertelt ons dat elektronen niet willekeurig rond de kern van een atoom zijn gerangschikt, maar dat zij in specifieke elektronenschillen voorkomen (zie onze module Atoomtheorie II voor meer informatie). Elke schil heeft een beperkte capaciteit voor elektronen. Naarmate lagere schillen gevuld zijn, komen er elektronen bij in verder weg gelegen schillen.
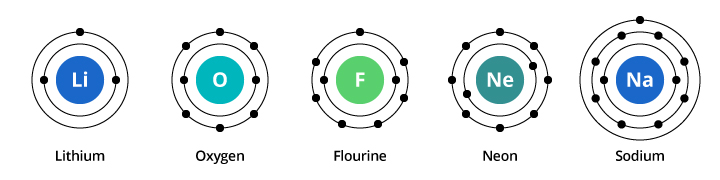
De capaciteit van de eerste elektronenschil is twee elektronen en voor de tweede schil is de capaciteit acht. In ons hierboven besproken voorbeeld draagt zuurstof, met acht protonen en acht elektronen, dus twee elektronen in zijn eerste schil en zes in zijn tweede schil. Fluor, met negen elektronen, heeft twee elektronen in de eerste schil en zeven in de tweede. Neon, met tien elektronen, heeft twee in de eerste en acht in de tweede schil. Omdat het aantal elektronen in de tweede schil toeneemt, kunnen we ons voorstellen waarom de chemische eigenschappen geleidelijk veranderen naarmate we van zuurstof naar fluor naar neon gaan.
Natrium heeft elf elektronen. Twee passen in de eerste schil, maar vergeet niet dat de tweede schil slechts acht elektronen kan bevatten. Het elfde elektron van natrium past noch in de eerste, noch in de tweede schil. Dit elektron neemt zijn intrek in nog een andere baan, een derde elektronenschil in natrium. De reden voor de dramatische verschuiving in chemische eigenschappen van neon naar natrium is de dramatische verschuiving in elektronenconfiguratie tussen de twee elementen. Maar waarom is natrium vergelijkbaar met lithium? Laten we eens kijken naar de elektronenconfiguraties van deze elementen.
Zoals u in de illustratie kunt zien, heeft natrium drie elektronenschillen en lithium twee, maar hebben ze gemeen dat ze allebei slechts één elektron in hun buitenste elektronenschil hebben. Deze elektronen in de buitenste schil (valentie-elektronen genoemd) zijn belangrijk voor het bepalen van de chemische eigenschappen van de elementen.
De chemische eigenschappen van een element worden bepaald door de manier waarop zijn atomen met andere atomen interageren. Als we ons de buitenste (valentieschil) van een atoom voorstellen als een bol die alles binnenin omvat, dan is het alleen de valentieschil die met andere atomen kan interageren – ongeveer zoals alleen de verf op de buitenkant van uw huis “interageert” met, en nat wordt door, regenwater.
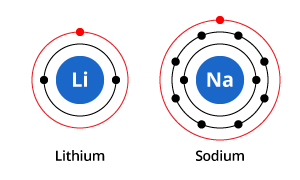
De valentieschil-elektronen in een atoom bepalen de manier waarop het met naburige atomen zal interageren, en bepalen dus zijn chemische eigenschappen. Omdat zowel natrium als lithium één valentie-elektron hebben, hebben ze vergelijkbare chemische eigenschappen.
Comprehension Checkpoint
De chemische eigenschappen van een element worden bepaald door het aantal elektronen in