La configuración de los electrones y la tabla
El carácter «periódico» de las propiedades químicas que había descubierto Mendeléyev está relacionado con la configuración electrónica de los átomos de los elementos. En otras palabras, la forma en que los electrones de un átomo están dispuestos alrededor de su núcleo afecta a las propiedades del átomo.
La teoría del átomo de Niels Bohr nos dice que los electrones no están situados aleatoriamente alrededor del núcleo de un átomo, sino que se encuentran en capas de electrones específicas (ver nuestro módulo de Teoría Atómica II para más información). Cada capa tiene una capacidad limitada de electrones. A medida que se llenan las envolturas inferiores, los electrones adicionales residen en envolturas más lejanas.
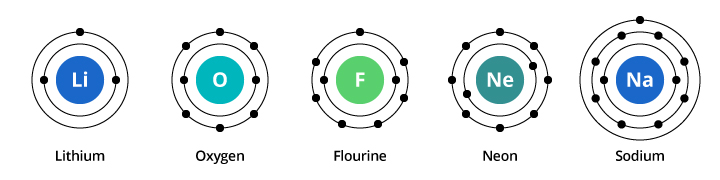
La capacidad de la primera envoltura de electrones es de dos electrones y la de la segunda es de ocho. Así, en nuestro ejemplo discutido anteriormente, el oxígeno, con ocho protones y ocho electrones, lleva dos electrones en su primera capa y seis en su segunda capa. El flúor, con nueve electrones, lleva dos en su primera capa y siete en la segunda. El neón, con diez electrones, lleva dos en la primera y ocho en la segunda. Como el número de electrones en la segunda capa aumenta, podemos empezar a imaginar por qué las propiedades químicas cambian gradualmente a medida que pasamos del oxígeno al flúor y al neón.
El sodio tiene once electrones. Dos caben en su primera envoltura, pero recuerda que la segunda envoltura sólo puede llevar ocho electrones. El undécimo electrón del sodio no cabe ni en su primera ni en su segunda capa. Este electrón se instala en otra órbita, una tercera capa de electrones en el sodio. La razón por la que hay un cambio drástico en las propiedades químicas al pasar del neón al sodio es porque hay un cambio drástico en la configuración de los electrones entre los dos elementos. Pero, ¿por qué el sodio es similar al litio? Veamos las configuraciones electrónicas de estos elementos.
Como puedes ver en la ilustración, mientras que el sodio tiene tres cáscaras de electrones y el litio dos, la característica que comparten en común es que ambos tienen sólo un electrón en su cáscara electrónica más externa. Estos electrones de la capa exterior (llamados electrones de valencia) son importantes para determinar las propiedades químicas de los elementos.
Las propiedades químicas de un elemento están determinadas por la forma en que sus átomos interactúan con otros átomos. Si imaginamos la cáscara de electrones exterior (de valencia) de un átomo como una esfera que abarca todo lo que hay dentro, entonces es sólo la cáscara de valencia la que puede interactuar con otros átomos – de la misma manera que es sólo la pintura en el exterior de su casa la que «interactúa» con, y se moja con, el agua de lluvia.
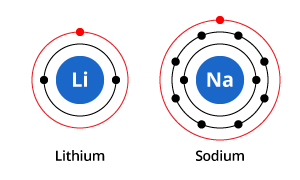
Los electrones de la capa de valencia de un átomo determinan la forma en que interactuará con los átomos vecinos, y por lo tanto determinan sus propiedades químicas. Como tanto el sodio como el litio tienen un electrón de valencia, comparten propiedades químicas similares.
Punto de verificación de la comprensión
Las propiedades químicas de un elemento están determinadas por el número de electrones en