Elektronenkonfiguration und die Tabelle
Die „periodische“ Natur der chemischen Eigenschaften, die Mendelejew entdeckt hatte, hängt mit der Elektronenkonfiguration der Atome der Elemente zusammen. Mit anderen Worten: Die Art und Weise, wie die Elektronen eines Atoms um seinen Kern angeordnet sind, beeinflusst die Eigenschaften des Atoms.
Niels Bohrs Atomtheorie besagt, dass die Elektronen nicht wahllos um den Atomkern angeordnet sind, sondern in bestimmten Elektronenschalen vorkommen (siehe unser Modul Atomtheorie II für weitere Informationen). Jede Schale hat eine begrenzte Kapazität für Elektronen. Wenn die unteren Schalen gefüllt sind, befinden sich zusätzliche Elektronen in weiter entfernten Schalen.
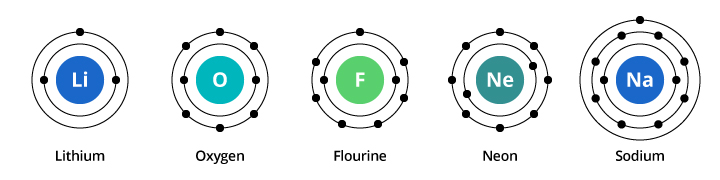
Die Kapazität der ersten Elektronenschale beträgt zwei Elektronen und die der zweiten Schale acht. In unserem oben besprochenen Beispiel trägt also Sauerstoff mit acht Protonen und acht Elektronen zwei Elektronen in seiner ersten Schale und sechs in seiner zweiten Schale. Fluor, mit neun Elektronen, trägt zwei in seiner ersten Schale und sieben in der zweiten. Neon, mit zehn Elektronen, trägt zwei in der ersten und acht in der zweiten Schale. Da die Anzahl der Elektronen in der zweiten Schale zunimmt, können wir uns vorstellen, warum sich die chemischen Eigenschaften allmählich ändern, wenn wir uns von Sauerstoff über Fluor zu Neon bewegen.
Natrium hat elf Elektronen. Zwei davon passen in die erste Schale, aber man muss bedenken, dass die zweite Schale nur acht Elektronen aufnehmen kann. Das elfte Elektron des Natriums kann weder in der ersten noch in der zweiten Schale untergebracht werden. Dieses Elektron befindet sich in einer anderen Umlaufbahn, einer dritten Elektronenschale des Natriums. Der Grund für die dramatische Veränderung der chemischen Eigenschaften beim Übergang von Neon zu Natrium ist die dramatische Veränderung der Elektronenkonfiguration zwischen den beiden Elementen. Aber warum ist Natrium dem Lithium so ähnlich? Schauen wir uns die Elektronenkonfigurationen dieser Elemente an.
Wie in der Abbildung zu sehen ist, hat Natrium zwar drei und Lithium zwei Elektronenschalen, aber das gemeinsame Merkmal ist, dass beide nur ein Elektron in ihrer äußersten Elektronenschale haben. Diese Elektronen der äußeren Schale (Valenz-Elektronen genannt) sind wichtig für die chemischen Eigenschaften der Elemente.
Die chemischen Eigenschaften eines Elements werden durch die Art und Weise bestimmt, in der seine Atome mit anderen Atomen interagieren. Wenn wir uns die äußere (Valenz-)Elektronenschale eines Atoms als eine Kugel vorstellen, die alles im Inneren umschließt, dann ist es nur die Valenzschale, die mit anderen Atomen in Wechselwirkung treten kann – so wie auch nur die Farbe an der Außenseite deines Hauses mit dem Regenwasser „in Wechselwirkung tritt“ und davon nass wird.
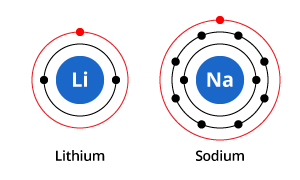
Die Valenzschalenelektronen eines Atoms bestimmen die Art und Weise, wie es mit den benachbarten Atomen wechselwirkt, und bestimmen daher seine chemischen Eigenschaften. Da sowohl Natrium als auch Lithium ein Valenzelektron haben, haben sie ähnliche chemische Eigenschaften.
Verstehenskontrolle
Die chemischen Eigenschaften eines Elements werden durch die Anzahl der Elektronen in