Configurația electronică și tabelul
Natura „periodică” a proprietăților chimice descoperite de Mendeleev este legată de configurația electronică a atomilor elementelor. Cu alte cuvinte, modul în care electronii unui atom sunt dispuși în jurul nucleului său afectează proprietățile atomului.
Teoria atomului a lui Niels Bohr ne spune că electronii nu sunt amplasați la întâmplare în jurul nucleului unui atom, ci ei se află în învelișuri electronice specifice (pentru mai multe informații, consultați modulul Teoria atomică II). Fiecare înveliș are o capacitate limitată pentru electroni. Pe măsură ce învelișurile inferioare sunt umplute, electronii suplimentari locuiesc în învelișuri mai îndepărtate.
Capacitatea primului înveliș de electroni este de doi electroni, iar pentru al doilea înveliș capacitatea este de opt. Astfel, în exemplul nostru discutat mai sus, oxigenul, cu opt protoni și opt electroni, poartă doi electroni în prima sa cochilie și șase în cea de-a doua cochilie. Fluorul, cu nouă electroni, poartă doi în prima sa cochilie și șapte în cea de-a doua. Neonul, cu zece electroni, poartă doi în prima și opt în cea de-a doua. Deoarece numărul de electroni din cea de-a doua cochilie crește, putem începe să ne imaginăm de ce proprietățile chimice se schimbă treptat pe măsură ce trecem de la oxigen la fluor și la neon.
Sodiul are unsprezece electroni. Doi încap în primul său înveliș, daramintiți-vă că al doilea înveliș poate transporta doar opt electroni. Cel de-al unsprezecelea electron al sodiului nu poate încăpea nici în primul, nici în al doilea înveliș. Acest electron își stabilește reședința pe o altă orbită, un al treilea înveliș electronic al sodiului. Motivul pentru care există o schimbare dramatică a proprietăților chimice atunci când se trece de la neon la sodiu se datorează faptului că există o schimbare dramatică a configurației electronice între cele două elemente. Dar de ce este sodiul similar cu litiul? Să ne uităm la configurațiile electronice ale acestor elemente.
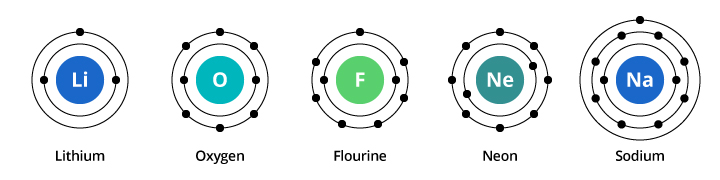
După cum puteți vedea în ilustrație, în timp ce sodiul are trei învelișuri electronice, iar litiul două, caracteristica pe care o au în comun este că ambele au doar un singur electron în învelișul electronic cel mai exterior. Acești electroni din învelișul exterior (numiți electroni de valență) sunt importanți în determinarea proprietăților chimice ale elementelor.
Proprietățile chimice ale unui element sunt determinate de modul în care atomii săi interacționează cu alți atomi. Dacă ne imaginăm învelișul exterior (de valență) al electronilor unui atom ca pe o sferă care cuprinde tot ce se află înăuntru, atunci numai învelișul de valență poate interacționa cu alți atomi – în același mod în care numai vopseaua de pe exteriorul casei dumneavoastră „interacționează” cu apa de ploaie și se udă de aceasta.
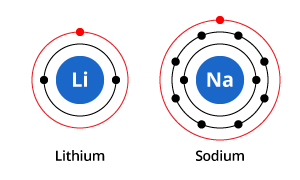
Electronii din învelișul de valență al unui atom determină modul în care acesta va interacționa cu atomii vecini și, prin urmare, determină proprietățile sale chimice. Deoarece atât sodiul, cât și litiul au câte un electron de valență, au proprietăți chimice similare.
Computere de control al înțelegerii
Proprietățile chimice ale unui element sunt determinate de numărul de electroni din
.