Configuration des électrons et tableau
La nature « périodique » des propriétés chimiques que Mendeleïev avait découverte est liée à la configuration électronique des atomes des éléments. En d’autres termes, la façon dont les électrons d’un atome sont disposés autour de son noyau affecte les propriétés de l’atome.
La théorie de l’atome de Niels Bohr nous dit que les électrons ne sont pas localisés au hasard autour du noyau d’un atome, mais qu’ils se trouvent dans des coquilles électroniques spécifiques (voir notre module Théorie atomique II pour plus d’informations). Chaque enveloppe a une capacité limitée d’électrons. Au fur et à mesure que les coquilles inférieures sont remplies, des électrons supplémentaires résident dans des coquilles plus éloignées.
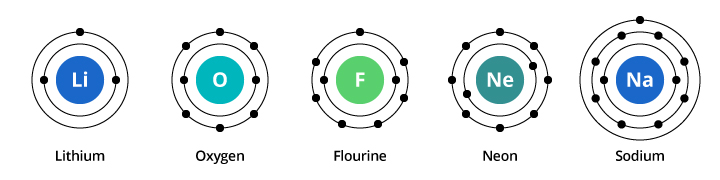
La capacité de la première coquille électronique est de deux électrons et pour la deuxième coquille, la capacité est de huit. Ainsi, dans notre exemple discuté ci-dessus, l’oxygène, avec huit protons et huit électrons, porte deux électrons dans sa première coquille et six dans sa deuxième coquille. Le fluor, avec neuf électrons, en porte deux dans sa première coquille et sept dans la seconde. Le néon, avec dix électrons, en porte deux dans la première coquille et huit dans la seconde. Comme le nombre d’électrons dans la deuxième coquille augmente, nous pouvons commencer à imaginer pourquoi les propriétés chimiques changent progressivement lorsque nous passons de l’oxygène au fluor et au néon.
Le sodium a onze électrons. Deux rentrent dans sa première coquille, mais rappelez-vous que la deuxième coquille ne peut porter que huit électrons. Le onzième électron du sodium ne peut s’insérer ni dans la première ni dans la seconde coquille. Cet électron s’installe sur une autre orbite, une troisième enveloppe électronique du sodium. La raison pour laquelle on observe un changement spectaculaire des propriétés chimiques lorsqu’on passe du néon au sodium est qu’il y a un changement spectaculaire de la configuration électronique entre les deux éléments. Mais pourquoi le sodium est-il similaire au lithium ? Regardons les configurations électroniques de ces éléments.
Comme vous pouvez le voir sur l’illustration, alors que le sodium possède trois coquilles électroniques et le lithium deux, la caractéristique qu’ils partagent en commun est qu’ils n’ont tous deux qu’un seul électron dans leur coquille électronique la plus externe. Ces électrons de la coquille externe (appelés électrons de valence) sont importants pour déterminer les propriétés chimiques des éléments.
Les propriétés chimiques d’un élément sont déterminées par la façon dont ses atomes interagissent avec les autres atomes. Si nous nous représentons l’enveloppe électronique extérieure (de valence) d’un atome comme une sphère englobant tout ce qui se trouve à l’intérieur, alors c’est seulement l’enveloppe de valence qui peut interagir avec d’autres atomes – de la même manière que c’est seulement la peinture sur l’extérieur de votre maison qui « interagit » avec, et se fait mouiller par, l’eau de pluie.
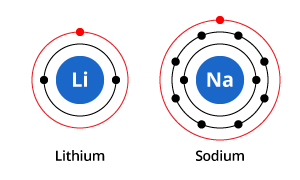
Les électrons de la coquille de valence d’un atome déterminent la façon dont il va interagir avec les atomes voisins, et donc déterminent ses propriétés chimiques. Comme le sodium et le lithium ont tous deux un électron de valence, ils partagent des propriétés chimiques similaires.
Vérification de la compréhension
Les propriétés chimiques d’un élément sont déterminées par le nombre d’électrons dans
l’atome.