Az elektronkonfiguráció és a táblázat
A Mendelejev által felfedezett kémiai tulajdonságok “periodikus” jellege az elemek atomjainak elektronkonfigurációjával függ össze. Más szóval, az atom tulajdonságait befolyásolja az a mód, ahogyan az atom elektronjai az atommag körül helyezkednek el.
Niels Bohr atomelmélete szerint az elektronok nem véletlenszerűen helyezkednek el az atommag körül, hanem meghatározott elektronhéjakban fordulnak elő (további információkért lásd az Atomelmélet II. modulunkat). Minden héjnak korlátozott befogadóképessége van az elektronok számára. Ahogy az alacsonyabb héjak megtelnek, további elektronok tartózkodnak távolabbi héjakban.
Az első elektronhéj kapacitása két elektron, a második héjé pedig nyolc elektron. Így a fent tárgyalt példánkban az oxigén nyolc protonjával és nyolc elektronjával két elektront hordoz az első héjában és hatot a második héjában. A kilenc elektronnal rendelkező fluor két elektront hordoz az első héjában és hetet a másodikban. A tíz elektronnal rendelkező neon két elektront hordoz az első és nyolcat a második héjban. Mivel a második héjban lévő elektronok száma növekszik, kezdhetjük elképzelni, miért változnak fokozatosan a kémiai tulajdonságok, ahogy az oxigéntől a fluoronon át a neonig haladunk.
A nátriumnak tizenegy elektronja van. Kettő elfér az első héjában, de ne feledjük, hogy a második héjba csak nyolc elektron fér be. A nátrium tizenegyedik elektronja nem fér el sem az első, sem a második héjban. Ez az elektron egy másik pályán, a nátrium harmadik elektronhéjában foglal helyet. Azért van drámai változás a kémiai tulajdonságokban, amikor a neonról a nátriumra térünk át, mert a két elem között drámai változás következik be az elektronkonfigurációban. De miért hasonlít a nátrium a lítiumhoz? Nézzük meg ezen elemek elektronkonfigurációit.
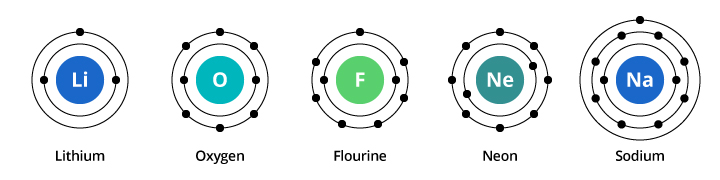
Amint az ábrán látható, míg a nátriumnak három, a lítiumnak pedig két elektronhéja van, a közös jellemzőjük az, hogy mindkettőnek csak egy elektron van a legkülső elektronhéjában. Ezek a külső héjelektronok (az úgynevezett valenciaelektronok) fontosak az elemek kémiai tulajdonságainak meghatározásában.
Egy elem kémiai tulajdonságait az határozza meg, hogy az atomjai milyen módon lépnek kölcsönhatásba más atomokkal. Ha egy atom külső (valencia)elektronhéját úgy képzeljük el, mint egy gömböt, amely mindent magába foglal, akkor csak a valenciahéj képes kölcsönhatásba lépni más atomokkal – hasonlóan ahhoz, ahogyan a házad külső festéke is csak az esővízzel “lép kölcsönhatásba”, és attól nedvesedik meg.
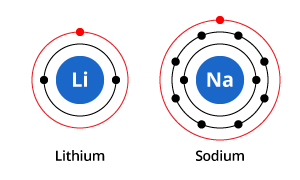
A valenciahéj elektronjai egy atomban meghatározzák, hogy milyen módon lép kölcsönhatásba a szomszédos atomokkal, és így meghatározzák kémiai tulajdonságait. Mivel mind a nátriumnak, mind a lítiumnak egy-egy valenciaelektronja van, hasonló kémiai tulajdonságokkal rendelkeznek.
Érthetőségi ellenőrzőpont
Az elem kémiai tulajdonságait az elektronok száma határozza meg
.