Configuração electrónica e a tabela
A natureza “periódica” das propriedades químicas que Mendeleev descobriu está relacionada com a configuração electrónica dos átomos dos elementos. Em outras palavras, a forma como os elétrons de um átomo estão dispostos em torno de seu núcleo afeta as propriedades do átomo.
Niels A teoria do átomo de Bohr diz-nos que os electrões não estão localizados aleatoriamente em torno do núcleo de um átomo, mas ocorrem em conchas de electrões específicas (ver o nosso módulo de Teoria Atómica II para mais informações). Cada concha tem uma capacidade limitada para elétrons. À medida que as conchas inferiores são preenchidas, os electrões adicionais residem em conchas mais distantes.
A capacidade do primeiro escudo de elétrons é de dois elétrons e para o segundo escudo a capacidade é de oito. Assim, no nosso exemplo discutido acima, oxigênio, com oito prótons e oito elétrons, carrega dois elétrons em sua primeira concha e seis em sua segunda concha. O flúor, com nove elétrons, carrega dois em sua primeira concha e sete na segunda. O néon, com dez elétrons, carrega dois na primeira e oito na segunda. Como o número de elétrons na segunda concha aumenta, podemos começar a imaginar porque as propriedades químicas mudam gradualmente à medida que passamos do oxigênio para o flúor, passando para o neônio.
Sódio tem onze elétrons. Dois cabem na primeira concha, mas lembre-se que a segunda concha só pode carregar oito elétrons. O décimo primeiro electrão do sódio não cabe nem na primeira nem na segunda concha. Este elétron se fixa em mais uma órbita, uma terceira concha de elétron em sódio. A razão pela qual há uma mudança dramática nas propriedades químicas quando se passa de néon para sódio é porque há uma mudança dramática na configuração dos elétrons entre os dois elementos. Mas porque é que o sódio é semelhante ao lítio? Vejamos as configurações dos elétrons desses elementos.
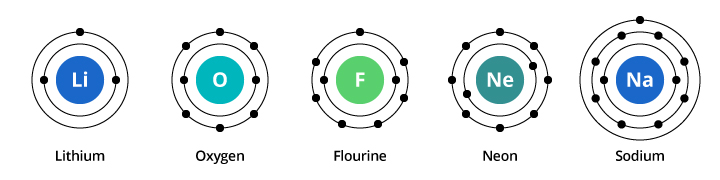
Como você pode ver na ilustração, enquanto o sódio tem três conchas de elétrons e o lítio duas, a característica que ambos têm em comum é que ambos têm apenas um elétron em sua concha eletrônica mais externa. Estes elétrons de concha externa (chamados valenceelectrons) são importantes para determinar as propriedades químicas dos elementos.
As propriedades químicas de um elemento são determinadas pela forma como os seus átomos interagem com outros átomos. Se imaginarmos o invólucro externo (valência) de um átomo como uma esfera que engloba tudo no seu interior, então é apenas o invólucro de valência que pode interagir com outros átomos – da mesma forma que é apenas a tinta no exterior da sua casa que “interage” com, e esquece a água da chuva.
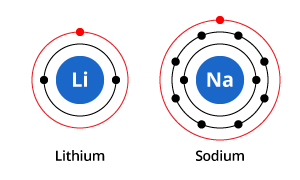
Os electrões da casca de valência de um átomo determinam a forma como este irá interagir com os átomos vizinhos, e portanto determinar as suas propriedades químicas. Como tanto o sódio como o lítio têm um elétron de valência, eles compartilham propriedades químicas semelhantes.
Ponto de verificação da compreensão
As propriedades químicas de um elemento são determinadas pelo número de elétrons em