Elektronikonfiguraatio ja taulukko
Mendelejevin löytämä kemiallisten ominaisuuksien ”jaksollinen” luonne liittyy alkuaineiden atomien elektronikonfiguraatioon. Toisin sanoen tapa, jolla atomin elektronit ovat sijoittuneet sen ytimen ympärille, vaikuttaa atomin ominaisuuksiin.
Niels Bohrin atomiteoria kertoo, että elektronit eivät ole satunnaisesti sijoittuneet atomin ytimen ympärille, vaan ne esiintyvät tietyissä elektronikuorissa (katso lisätietoja Atomiteoria II -moduulista). Kullakin kuorella on rajallinen kapasiteetti elektroneille. Kun alemmat kuoret täyttyvät, lisää elektroneja asuu kauempana olevissa kuorissa.
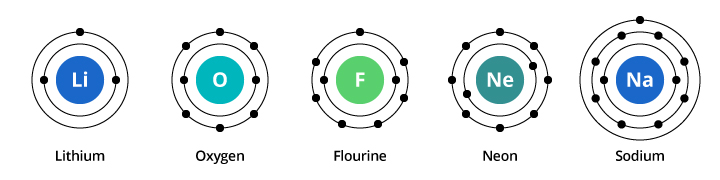
Ensimmäisen elektronikuoren kapasiteetti on kaksi elektronia ja toisen kuoren kapasiteetti on kahdeksan elektronia. Näin ollen edellä käsitellyssä esimerkissämme happi, jossa on kahdeksan protonia ja kahdeksan elektronia, kantaa kaksi elektronia ensimmäisessä kuoressaan ja kuusi elektronia toisessa kuoressaan. Fluori, jolla on yhdeksän elektronia, kantaa kaksi elektronia ensimmäisessä kuoressaan ja seitsemän toisessa kuoressaan. Neonilla, jolla on kymmenen elektronia, on kaksi elektronia ensimmäisessä kuoressa ja kahdeksan toisessa kuoressa. Koska toisella kuorella olevien elektronien määrä kasvaa, voimme alkaa kuvitella, miksi kemialliset ominaisuudet muuttuvat vähitellen siirryttäessä hapesta fluoriin ja neoniin.
Natriumilla on yksitoista elektronia. Kaksi mahtuu sen ensimmäiseen kuoreen, muttamuistakaa, että toiseen kuoreen mahtuu vain kahdeksan elektronia. Natriumin yhdestoista elektroni ei mahdu sen ensimmäiseen eikä toiseen kuoreen. Tämä elektroni asettuu toiselle radalle, natriumin kolmannelle elektronikuorelle. Syy siihen, että kemialliset ominaisuudet muuttuvat dramaattisesti siirryttäessä neonista natriumiin, on se, että elektronikonfiguraatio muuttuu dramaattisesti näiden kahden alkuaineen välillä. Mutta miksi natrium muistuttaa litiumia? Tarkastellaanpa näiden alkuaineiden elektronikonfiguraatioita.
Kuten kuvasta näkyy, vaikka natriumilla on kolme elektronikuorta ja litiumilla kaksi, yhteinen piirre on se, että molemmilla on uloimmassa elektronikuoressaan vain yksi elektroni. Nämä ulomman kuoren elektronit (joita kutsutaan valenssielektroneiksi) ovat tärkeitä alkuaineiden kemiallisten ominaisuuksien määrittämisessä.
Elementin kemialliset ominaisuudet määräytyvät sen mukaan, miten sen atomit ovat vuorovaikutuksessa muiden atomien kanssa. Jos kuvittelemme atomin ulomman (valenssi)elektronikuoren pallona, joka ympäröi kaiken sen sisällä olevan, niin vain valenssikuori voi olla vuorovaikutuksessa muiden atomien kanssa – aivan samalla tavalla kuin vain talosi ulkopinnan maali on ”vuorovaikutuksessa” sadeveden kanssa ja kastuu siitä.
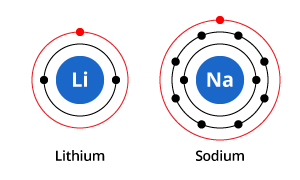
Atomin valenssikuoren elektronit määräävät sen tavan, jolla se vuorovaikuttaa naapuriatomien kanssa, ja näin ollen määräävät sen kemialliset ominaisuudet. Koska sekä natriumilla että litiumilla on yksi valenssielektroni, niillä on samankaltaiset kemialliset ominaisuudet.
Ymmärtämisen tarkistuspiste
Alkuaineen kemialliset ominaisuudet määräytyvät sen elektronien lukumäärän mukaan