Elektronkonfiguration och tabellen
Den ”periodiska” karaktären hos de kemiska egenskaperna som Mendelejev hade upptäckt är relaterad till elektronkonfigurationen hos atomerna i grundämnena. Med andra ord påverkar det sätt på vilket en atoms elektroner är placerade runt atomkärnan atomens egenskaper.
Niels Bohrs teori om atomen säger oss att elektronerna inte är placerade slumpmässigt runt en atomkärna, utan att de förekommer i specifika elektronskal (se vår modul Atomteori II för mer information). Varje skal har en begränsad kapacitet för elektroner. När lägre skal fylls finns ytterligare elektroner i mer avlägsna skal.
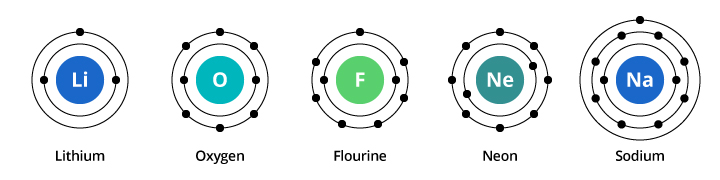
Kapaciteten för det första elektronskalet är två elektroner och för det andra skalet är kapaciteten åtta. I vårt exempel som diskuterats ovan bär syre, med åtta protoner och åtta elektroner, alltså två elektroner i sitt första skal och sex i sitt andra skal. Fluor, med nio elektroner, har två i sitt första skal och sju i det andra. Neon, med tio elektroner, har två i det första skalet och åtta i det andra. Eftersom antalet elektroner i det andra skalet ökar kan vi börja föreställa oss varför de kemiska egenskaperna gradvis förändras när vi går från syre till fluor till neon.
Natrium har elva elektroner. Två ryms i dess första skal, men kom ihåg att det andra skalet bara kan bära åtta elektroner. Natriums elfte elektron kan inte rymmas i vare sig det första eller det andra skalet. Denna elektron tar plats i ännu en omloppsbana, ett tredje elektronskal hos natrium. Anledningen till att de kemiska egenskaperna förändras dramatiskt när man går från neon till natrium är att det sker en dramatisk förändring av elektronkonfigurationen mellan de två grundämnena. Men varför liknar natrium litium? Låt oss titta på elektronkonfigurationerna hos dessa grundämnen.
Som du kan se i illustrationen har natrium visserligen tre elektronskal och litium två, men den gemensamma egenskapen är att de båda har endast en elektron i sitt yttersta elektronskal. Dessa elektroner i det yttersta skalet (som kallas valenselektroner) är viktiga för att bestämma grundämnenas kemiska egenskaper.
Ett grundämnes kemiska egenskaper bestäms av hur dess atomer interagerar med andra atomer. Om vi föreställer oss en atoms yttre (valens)elektronskal som en sfär som omfattar allt inuti, så är det bara valensskalet som kan interagera med andra atomer – ungefär på samma sätt som det bara är färgen på utsidan av ditt hus som ”interagerar” med, och blir blöt av, regnvatten.
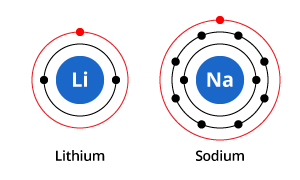
Valensskalets elektroner i en atom bestämmer hur den kommer att interagera med närliggande atomer, och bestämmer därför dess kemiska egenskaper. Eftersom både natrium och litium har en valenselektron har de liknande kemiska egenskaper.
Förståelsekontrollpunkt
De kemiska egenskaperna hos ett grundämne bestäms av antalet elektroner i
.