Konfiguracja elektronów i tablica
„Okresowy” charakter właściwości chemicznych, który odkrył Mendelejew, jest związany z konfiguracją elektronową atomów pierwiastków. Innymi słowy, sposób, w jaki elektrony atomu są rozmieszczone wokół jego jądra, wpływa na właściwości atomu.
Teoria atomu Nielsa Bohra mówi nam, że elektrony nie są rozmieszczone losowo wokół jądra atomu, ale występują w określonych powłokach elektronowych (zobacz nasz moduł Teoria Atomu II po więcej informacji). Każda powłoka ma ograniczoną pojemność dla elektronów. Gdy niższe powłoki są wypełnione, dodatkowe elektrony rezydują w bardziej odległych powłokach.
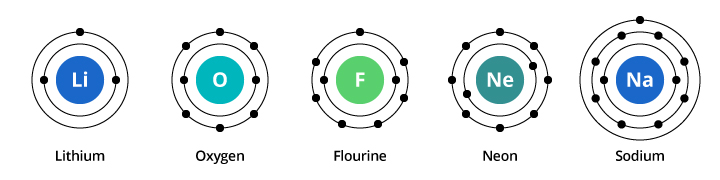
Pojemność pierwszej powłoki elektronowej wynosi dwa elektrony, a dla drugiej powłoki pojemność wynosi osiem. Tak więc, w naszym przykładzie omówionym powyżej, tlen, z ośmioma protonami i ośmioma elektronami, przenosi dwa elektrony w swojej pierwszej powłoce i sześć w swojej drugiej powłoce. Fluor, z dziewięcioma elektronami, przenosi dwa elektrony w pierwszej powłoce i siedem w drugiej. Neon, z dziesięcioma elektronami, posiada dwa elektrony w pierwszej powłoce i osiem w drugiej. Ponieważ liczba elektronów w drugiej powłoce wzrasta, możemy zacząć sobie wyobrażać, dlaczego właściwości chemiczne stopniowo zmieniają się w miarę przechodzenia od tlenu przez fluor do neonu.
Sód ma jedenaście elektronów. Dwa mieszczą się w jego pierwszej powłoce, ale pamiętaj, że druga powłoka może przenosić tylko osiem elektronów. Jedenasty elektron sodu nie może zmieścić się ani w jego pierwszej, ani w drugiej powłoce. Ten elektron zajmuje miejsce na jeszcze innej orbicie, trzeciej powłoce elektronowej w sodzie. Powodem, dla którego następuje dramatyczna zmiana właściwości chemicznych przy przejściu od neonu do sodu jest dramatyczna zmiana konfiguracji elektronowej pomiędzy tymi dwoma pierwiastkami. Ale dlaczego sód jest podobny do litu? Spójrzmy na konfiguracje elektronowe tych elementów.
Jak widać na rysunku, podczas gdy sód ma trzy powłoki elektronowe, a lit dwie, cechą wspólną jest to, że oba mają tylko jeden elektron w swojej najbardziej zewnętrznej powłoce elektronowej. Te elektrony zewnętrznej powłoki (zwane elektronami walencyjnymi) są ważne w określaniu właściwości chemicznych pierwiastków.
Właściwości chemiczne pierwiastka są określane przez sposób, w jaki jego atomy oddziałują z innymi atomami. Jeśli wyobrazimy sobie zewnętrzną (walencyjną) powłokę elektronową atomu jako sferę obejmującą wszystko wewnątrz, to tylko powłoka walencyjna może oddziaływać z innymi atomami – podobnie jak tylko farba na zewnątrz domu „oddziałuje” z wodą deszczową i jest przez nią mokra.
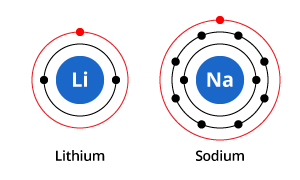
Elektrony powłoki walencyjnej w atomie określają sposób, w jaki będzie on oddziaływał z sąsiednimi atomami, a zatem określają jego właściwości chemiczne. Ponieważ zarówno sód jak i lit mają jeden elektron walencyjny, mają podobne właściwości chemiczne.
Punkt kontrolny
Właściwości chemiczne pierwiastka są określane przez liczbę elektronów w