El acero es el material de ingeniería más importante. El endurecimiento del acero es muy importante.
Vídeos de conferencias
![]() Acero frente a acero
Acero frente a acero
(Metraje sin editar)
![]() Acero: Parte 1 ,
Acero: Parte 1 , ![]() Acero: Parte 2 ,
Acero: Parte 2 , ![]() Acero: Parte 3
Acero: Parte 3
![]() Propiedades y estructura del grano: BBC 1973 (Antiguo pero muy bueno)
Propiedades y estructura del grano: BBC 1973 (Antiguo pero muy bueno)
El hierro es abundante en el universo, se encuentra en el sol y en muchos tipos de estrellas en cantidad considerable. Se cree que el núcleo de la Tierra está formado por níquel y hierro, y que está más caliente que la superficie del Sol. Este intenso calor del núcleo interno hace que el material del núcleo externo y del manto se desplace (corrientes de convección).
(Nota: Es curioso que no lo sepamos realmente ¿eh? – Sabemos que se calienta más a medida que se profundiza, pero sólo podemos hacer una estimación de lo caliente que está en el centro de la tierra. Incluso a 12 km bajo tierra, los cálculos de los científicos se equivocaron en más de un 100%: hacía más calor del esperado. Al intentar perforar a esas profundidades, la roca se calienta tanto que se vuelve plástica y se aprieta en el agujero y atasca el taladro. Ratas. Demasiado para cavar hasta el centro de la tierra).
Acero al carbono
El acero es una aleación de hierro (Fe) y carbono (C), con un 0,2 a 2,04% de carbono en peso. El carbono es el material de aleación más rentable para el hierro, pero se utilizan otros elementos de aleación como el manganeso, el cromo, el vanadio y el tungsteno.
| Acero al carbono | ANSI def’n | General Def’n | Aplicaciones y propiedades |
| Acero de bajo carbono | 0.05-0,15% | <0,1% | Suave, dúctil. Fácil de formar. |
| Acero dulce | 0,16-0,29% | 0,1-0,25% | Poca resistencia a la tracción, pero es barato y maleable; la dureza de la superficie puede aumentarse mediante carburación. |
| Acero al carbono medio | 0,30-0,59% | 0,25-0,45% | Equilibra la ductilidad y la resistencia y tiene buena resistencia al desgaste; se utiliza para piezas grandes, forja y componentes de automoción. |
| Acero al carbono alto | 0.6-0,99% | 0,45-1,0% | Muy fuerte, utilizado para muelles y alambres de alta resistencia. |
| Acero de muy alto carbono | 1,0-2,0% | 1,0-1,50% (>1,5% raro) |
Muy duro – cuchillos, punzones. Normalmente, todo lo que supere el 1,2% requerirá otras aleaciones para evitar una excesiva fragilidad. Se puede conseguir un contenido de carbono muy alto utilizando la pulvimetalurgia. |
| Fundición de hierro | – | 2,5-4,0% | Punto de fusión más bajo, facilidad de fundición, menor dureza y resistencia que el acero. |
Porcentajes de carbono en diversas aplicaciones del acero;


Variar la cantidad de elementos de aleación y la forma en que se incorporan al acero (elementos solubles, fase precipitada) influye en propiedades como la dureza, la ductilidad y la resistencia a la tracción del acero resultante. Al aumentar el contenido de carbono, el acero se vuelve más duro y resistente que el hierro, pero también más frágil. La solubilidad máxima del carbono en el hierro (en la región de la austenita) es del 2,14% en peso, y se produce a 1149 °C; concentraciones más altas de carbono o temperaturas más bajas producirán cementita (muy frágil). Si se añade más carbono, se obtiene hierro fundido, que tiene un punto de fusión más bajo y es más fácil de fundir.
Hierro forjado que contiene sólo una cantidad muy pequeña de otros elementos, pero contiene entre un 1 y un 3% en peso de escoria en forma de partículas alargadas en una dirección, lo que da al hierro un grano característico. Es más resistente a la oxidación que el acero y se suelda más fácilmente. Hoy en día es común hablar de «la industria del hierro y del acero» como si fuera una sola entidad, pero históricamente eran productos separados.
El acero se produce desde hace miles de años, pero se generalizó después de que se idearan métodos de producción más eficaces en el siglo XVII. El proceso de Bessemer, a mediados del siglo XIX, hizo que el acero fuera relativamente barato para los bienes producidos en masa. Otros perfeccionamientos del proceso, como la siderurgia de oxígeno básico, redujeron aún más el coste de producción y aumentaron la calidad del metal. Hoy en día, el acero es uno de los materiales más comunes del mundo y es uno de los principales componentes de edificios, herramientas, automóviles y electrodomésticos.

Obtener pdf: XLER_International_Compare.pdf
VIDEO: Propiedades y estructura del grano. BBC 1973
No te rías de la fecha: este vídeo supera a todos esos patéticos modernos que te dan una introducción elegante pero nada más que una cabeza parlante. Nunca se aventuran a salir del estudio. Este viejo video es fabuloso para una clara introducción a la estructura del grano de acero.
Parte 1: ¿Qué es un grano? (Video 11MB)
- Las manchas que se ven en un objeto galvanizado son cristales o granos de zinc.
- Todos los metales están formados por granos, pero suelen ser invisibles (demasiado pequeños para verlos o del mismo brillo/color).
- Proceso de grabado: Acabado de espejo, ácido potente, lavado y sellado.
- En un metal puro, los granos son de diferentes colores debido a la forma en que reflejan la luz.
- Los cristales diminutos crecen hacia fuera hasta que se encuentran. Cada cristal completamente crecido se llama grano.
Parte 2: Recristalización (Vídeo 13MB)
- Antes del trabajo en frío los granos tienen un tamaño y una forma similares
- El trabajo en frío alarga los granos, aumenta la dureza y la resistencia, reduce la ductilidad.
- A 350C, se forman nuevos granos en el Al que sustituyen a los antiguos. Se llama recristalización
- La recristalización ablanda, disminuye la resistencia, aumenta la ductilidad
- Una temperatura de recristalización excesiva da malas propiedades mecánicas
Parte 3: Tratamiento térmico del acero (Vídeo 23MB)
- Los granos de acero son demasiado pequeños para ser visibles – se necesita un microscopio de aproximadamente 250 aumentos.
- Ferrita: De color claro. Hecho de hierro. Ductilidad al acero
- Perlita: de color más oscuro. Capas de hierro + carburo de hierro. Dureza y resistencia al acero
- 100% Perlita es de aproximadamente 0,8%C. Perlita, temperatura de recristalización 720C.
- Normalización – enfriamiento en aire, reducción del tamaño de grano y forma más uniforme, aumento de la tenacidad
- Enfriamiento – aumenta la dureza. No hay tiempo suficiente para que se forme la perlita, por lo que se forma una estructura en forma de aguja: la martensita. Muy duro y frágil.
- Templado – (después del temple) restablece la dureza. Modifica las agujas de martensita con pequeñas escamas de carbono. Esto proporciona dureza Y tenacidad.
- Acero al 0,1%C (acero dulce). Recristalización 900C. No hay suficiente carbono para producir martensita.
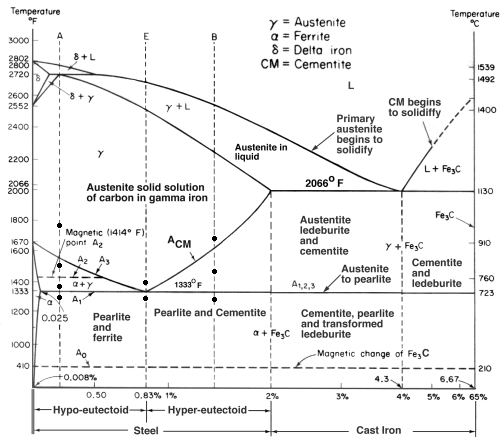
Diagrama de equilibrio hierro-carbono
Excelente enlace (Universidad de Cambridge): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Un Diagrama de Equilibrio es un gráfico de las diferentes disposiciones estructurales que se producen dentro de un rango de un elemento de aleación.
Este diagrama muestra cómo se combinan el hierro y el carbono SI se enfría lentamente (en equilibrio). Por debajo del 2% es acero, por encima del 2% se dirige al rango de hierro fundido donde el carbono tiende a coagularse (agruparse). La cementita Fe3C tiene un 6,67% de C y es básicamente una cerámica. El eutectoide (perlita) en E tiene 0,83% C, menos carbono es un acero hipoeutectoide (A), y mayor es hipereutectoide (B). Hierro alfa (ferrita), hierro gamma (austenita, que sólo existe a alta temperatura) y hierro delta (otra estructura de alta temperatura).
Dos cambios de fase muy importantes tienen lugar a 0,83%C y a 4,3% C. A 0,83%C y 723ºC, la transformación es eutectoide, llamada perlita. Estas dos fases se separan en capas. De gamma (austenita) –> alfa + Fe3C (cementita)
A 4,3% C y 1130ºC, la transformación es eutéctica, llamada ledeburita. L(líquido) –> gamma (austenita) + Fe3C (cementita). Esto es el hierro fundido.
BTW. Como el carbono (12) es mucho más ligero que el Fe (56), el % atómico real de carbono (contando los átomos) es en realidad unas 4,6 veces mayor que el %C en peso. Así que no es tan sorprendente, ¿verdad? Me refiero a cómo el 0,5% de Carbono puede transformar totalmente el hierro blando… en realidad es alrededor del 2% si se cuentan los átomos – no la masa.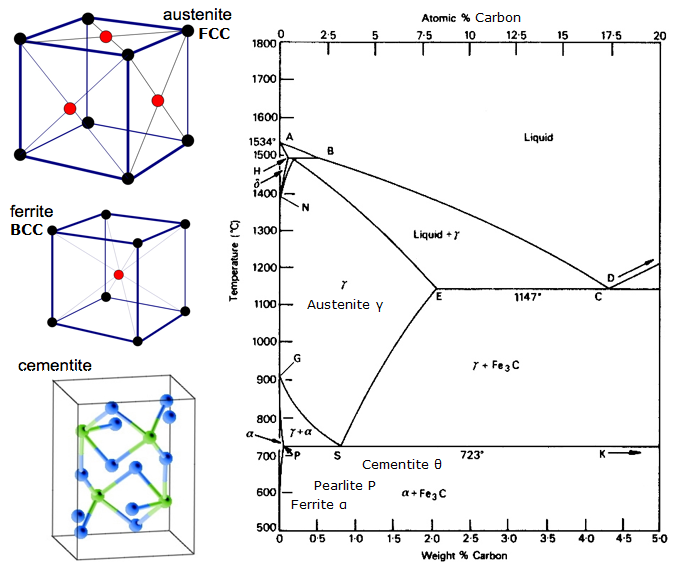
Resumen de las estructuras Fe-C (granos)
- Austenita (γ-hierro). Sólo existe por encima de 723C, que es cuando se produce la estructura FCC γ-hierro. Puede disolverse hasta el 2,1%C en masa. No es magnético, es blando (de ahí que se trabaje en caliente). La austenita también puede existir a temperatura ambiente si se cambian algunos átomos de hierro por otros, como el níquel. Esto es lo que es el acero inoxidable austenítico, como el 316, por ejemplo. Y, al igual que la austenita de alta temperatura, estos aceros inoxidables no son magnéticos. Algunos otros tipos de acero inoxidable son magnéticos.
- Cementita (carburo de hierro Fe3C, 6,67%C en masa. Hay doce átomos de hierro y cuatro átomos de carbono por celda unitaria, por lo que hay un 33% de átomos de carbono). Muy duro y quebradizo porque es una cerámica. ¿Ha oído hablar del carburo de tungsteno? Bueno, esto es Carburo de Hierro.
- Ledeburita (El eutéctico Ferrita-Cementita, 4,3% de carbono.)
- Ferrita (α-hierro, δ-hierro; suave). Sin carbono, BCC. Suave y dúctil.
- Perlita (88% ferrita, 12% cementita, que es 0,83%C) Más fuerte que la ferrita
- Martensita. Se produce cuando el enfriamiento es demasiado rápido para formar Perlita, por lo que bloquea picos de Cementita en el grano. Esto ocurre con el endurecimiento por enfriamiento del acero con suficiente Carbono. Muy duro.
Micrografías (fotos de un microscopio).
(A) = 0,1%C ferrita/perlita, (B) = 0,25%C más perlita, (C) = 0,83%C todo perlita, (D) = 1,4%C perlita/cementita
Vista cercana de la perlita mostrando capas de ferrita (blanco) y cementita (oscuro).
Más sobre la perlita: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Diagrama de equilibrio de la FC

Versión de impresión grande 2000x2658px
Deslizamiento
Cuando una pieza de metal se deforma, son los granos los que se deforman. Un grano es un cristal, una disposición ordenada de átomos en una cuadrícula. Si los átomos se estiran, se trata de una deformación elástica porque los átomos se mantienen unidos por las atracciones de los electrones, que actúan como un muelle. Sin embargo, la deformación permanente (o plástica) significa que los átomos se deslizan entre sí en capas o planos.
Los cristales reales no se deslizan en todo un plano a la vez. Esto requeriría una fuerza muy elevada. En su lugar, las imperfecciones del cristal permiten que el deslizamiento se produzca átomo a átomo. Cuanto más amplia sea la gama de átomos afectados, más dúctil (fácil de deslizar) será el grano. Aquí hay un ejemplo de una imperfección llamada dislocación que puede viajar fácilmente a través del cristal.
Aquí hay un ejemplo real de deslizamiento. (¡no nos lo estamos inventando!)
Micrografía electrónica de barrido de un único cristal de cadmio que se deforma por deslizamiento de dislocaciones en 100 planos, formando escalones
en la superficie.
La siguiente animación muestra una red de átomos (como en un metal). Sólo hay 2 formas de distorsionar los átomos: axial (tensión y compresión) y cizallamiento (lateral).
Esta animación muestra sólo la parte elástica de la curva de tensión/deformación, donde no se produce ningún deslizamiento atómico.
El contenido de esta página requiere una versión más reciente de Adobe Flash Player.

Más información aquí: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
¿Qué es el BCC y el FCC?
Las estructuras cristalinas BCC (Body Centred Cubic) y FCC (Face Centred Cubic) son dos formas alternativas de empaquetar los átomos de hierro.
- La BCC es la disposición a temperatura ambiente llamada ferrita
- La FCC es la disposición a alta temperatura (>723oC) llamada austenita.
Descargue los archivos de Inventor: SC, BCC, FCC, Los tres (SC+BCC+FCC)
![]()
SC es cúbico simple y no se da con átomos de hierro. Esta es la red de la sal – NaCl.
El arreglo más pequeño (unidad) se muestra abajo. Observe cómo la rejilla cúbica (coloreada en azul) se expande a medida que los otros átomos se encajan entre ellos en las retículas BCC y FCC.
![]()
A menudo hay cierta confusión sobre estos diagramas de abajo.

El problema es que los átomos rojos parecen de carbono y los negros de hierro. ¡No, no, no!
¡Todos los átomos son de hierro! Sólo coloreamos los átomos de Hierro que no están en las esquinas para que sean fáciles de ver.
El otro problema de estos diagramas es que no hay ninguna indicación real de que el espaciado de los átomos de las esquinas AUMENTA a medida que se pasa de SC a BCC a FCC.
Estructura SC (cúbica simple). NO HIERROCon una estructura SC (Cúbica Simple) (que no hace el hierro), la distancia entre los átomos es D. (Donde D es el diámetro de los átomos) Así que el volumen de esta unidad es D3, y el volumen del átomo es 4/3Πr3. Así que la densidad es el 52% del átomo sólido. No es muy compacto. |
 |
Estructura BCC (Body Centred Cubic). FERRITACon una estructura BCC (Body Centred Cubic) (que el hierro hace bajo 723oC), la distancia entre los átomos de hierro es 1,1547D. (Donde D es el diámetro de los átomos) Así que el volumen de esta unidad es (1.1547D)3, y esto se ajusta a 2 átomos así que el volumen de los átomos es 2×4/3Πr3. Así que la densidad es 68% del átomo sólido. Más compacto. Esta estructura se llama Ferrita. El carbono no encaja en esta estructura en absoluto (Bueno, digo una mentira. Puede disolver un patético 0,025% de C, que es prácticamente cero, o un 0,035% a la temperatura de transición, que sigue siendo nada) |
 |
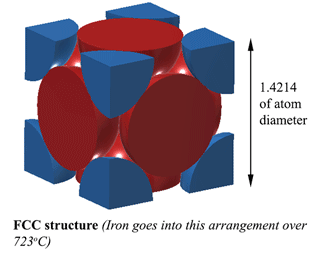
Estructura FCC (Face Centred Cubic). AUSTENITACon una estructura FCC (Face Centred Cubic) (que el Hierro hace por encima de los 723oC), la distancia entre los átomos de Hierro es de 1,4214D. (Donde D es el diámetro de los átomos) Así que el volumen de esta unidad es (1.4214D)3, y esto se ajusta a 4 átomos así que el volumen de los átomos es 4×4/3Πr3. Así que la densidad es 74% del átomo sólido. Esta es la más compacta, haciéndola 6% más densa que la Ferrita! Esta estructura se llama Austenita, y puede disolver 2% de Carbono en su estructura. Eso es un 2% en peso, no lo olvidemos, y como el Hierro (56) es 4,7 veces el peso del Carbono (12), puede disolver alrededor de un 21% de átomos de Carbono (Aproximadamente 1 Carbono por cada 5 átomos de Hierro). |
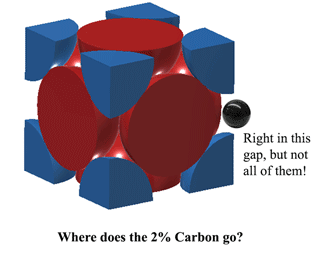
 |
¿Entonces dónde encaja el Carbono en la Austenita?El carbono puede encajar justo en ese espacio en el centro de cada borde de la unidad. Sin embargo, esto provoca un poco de distorsión, por lo que no se puede encajar un átomo de Carbono en CADA arista. En el mejor de los casos, a 1130oC la Austenita puede encajar un poco más de 2 átomos de Carbono cada 3 unidades. (2C:12Fe o 1:6 por átomos). De ahí sale el 2% en peso. Más aquí (bastante pesado) https://hal.archives-ouvertes.fr/jpa-00246587/document |
 |
Más información sobre BCC y FCC aquí:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Video de las estructuras cristalinas Cúbica Simple, Cúbica Centrada en el Cuerpo y Cúbica Centrada en la Cara. Los átomos de hierro no forman el cúbico simple.
Cúbico simple, cúbico centrado en el cuerpo y cúbico centrado en la cara
El endurecimiento del acero
El endurecimiento consiste en impedir que se produzca el deslizamiento.
Hay 3 formas de hacerlo.
- Deshacerse de todas las imperfecciones (tarea bastante imposible, aunque esta es la razón por la que las fibras muy finas pueden dar resistencias locas)
- Acabar con todos los deslizamientos para que no puedan producirse más. Esto se llama endurecimiento por trabajo.
- Bloquea el deslizamiento para que no se produzca a lo largo de los granos. El carbono (y el nitrógeno) forman compuestos que actúan como agente endurecedor, impidiendo que las dislocaciones de la red cristalina del hierro (ferrita) se deslicen entre sí. La martensita hace esto maravillosamente. Esto es el endurecimiento por tratamiento térmico.
El enfriamiento del acero no se muestra en el diagrama de equilibrio Fe-C, ¡porque el enfriamiento no está en equilibrio! (es decir, el enfriamiento es demasiado rápido para que la austenita con carbono en ella se meta en la complicada estructura de la perlita.

De https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
El enfriamiento rápido (temple) produce una estructura de grano diferente llamada martensita. Este grano es extremadamente duro y fuerte, y frágil. Los picos de carburo de hierro que penetran a través del grano ahora impiden el deslizamiento, por lo que se pierde la ductilidad.

Martensita: Universidad de Cambridge
Para reducir la fragilidad tras el temple, se utiliza el revenido para añadir dureza al acero. Esto modifica las dendritas de carburo para darles un poco de ductilidad, sin perder demasiada resistencia y dureza.
El temple debe realizarse a una temperatura inferior a la de recristalización. Un horno es lo mejor para el templado, pero se puede hacer con llama juzgando el color del acero. Los colores del revenido pueden servir de guía para la temperatura. Cuanto más caliente sea el revenido, más blando será el acero.
Las aleaciones como el acero inoxidable forman películas más finas que los aceros al carbono para una temperatura determinada y, por tanto, producen un color más bajo en la serie. Por ejemplo, la paja pálida corresponde a 300°C para el SS, en lugar de 230°C para el CS. Los colores más fríos que los rojos (por debajo de 500°C) son en realidad decoloraciones de los óxidos, no el propio brillo de la radiación de la temperatura. (Que sería infrarrojo, e invisible. Así que todo está brillando, ¡sólo que no se ve la luz!)
| Color de la radiación | Celcius | Farenht | Aplicaciones de la pintura / Otros |
| Amarillo-Blanco | 1539°C | 2800°F | Punto de fusión más alto (0%C hierro puro) |
| Amarillo brillante | 1130°C | 2066°F | Punto de fusión más bajo (4%C de hierro fundido) |
| Amarillo | 1093°C | 2000°F | El cobre se funde a 1084°C, Oro 1063°C |
| Amarillo oscuro | 1038°C | 1900°F | |
| Amarillo naranja | 982°C | 1800°F | |
| Naranja | 927°C | 1700°F | El latón se funde a 930°C |
| Rojo naranja | 871°C | 1600°F | |
| Rojo brillante | 816°C | 1500°F | |
| Rojo | 760°C | 1400°F | Temperatura de recristalización del acero 723°C |
| Rojo medio | 704°C | 1300°F | |
| Rojo mate | 649°C | 1200°F | El aluminio funde 600-660°C |
| Rojo claro | 593°C | 1100°F | Tensado para aceros de construcción. |
| Rojo muy ligero, mayoritariamente gris | 538°C | 1000°F | Tensado para aceros de construcción. |
| Gris oscuro | 427°C | 0800°F | Tensado para aceros de construcción. Cambio magnético 410 |
| Color de oxidación | Celcius | Farenht | Aplicaciones de temple |
| Azul | 302°C | 0575°F | Sierras para madera, resortes |
| Púrpura oscuro | 282°C | 0540°F | Escortes en frío, setts para acero |
| Púrpura | 271°C | 0520°F | Herramientas de prensado, ejes |
| Marrón/Púrpura | 260°C | 0500°F | Punzones, copas, broches, brocas helicoidales, escariadores |
| Marrón | 249°C | 0480°F | Tapas cuchillas para metales |
| Paja oscura | 241°C | 0465°F | Fresas, brocas |
| Paja clara | 229°C | 0445°F | Herramientas de cepillado y ranurado |
| Paja tenue | 199°C | 0390°F |
Enfriamiento:
Velocidad de enfriamiento: Los aceros de mayor carbono pueden ser enfriados más lentamente, pero un acero de menor C necesitará ser enfriado rápidamente para tener algún efecto de endurecimiento.
Velocidad de enfriamiento: (MÁS RÁPIDO) Agua salada > agua > aceite > aire > aislado. (MÁS LENTO)
Para un trabajo complejo y costoso, es mejor una aleación de temple lento porque es menos sensible a las variaciones de temperatura. Por eso, la mayoría de los aceros para herramientas, como las de inyección, se templan en aceite. El temple al agua está bien para formas simples que pueden ser controladas más fácilmente, pero puede causar grietas en secciones más gruesas porque la superficie se encoge antes que el interior.
Dureza por inducción. Endurecimiento por inducción en el que la inducción eléctrica (cambios magnéticos rápidos) calienta el acero que es seguido rápidamente por el enfriamiento en chorro de agua. Forma alternativa de calentamiento en lugar de la llama o el horno.

Dureza por inducción. http://www.thermobondflame.com/Services.page?i=4
Cómo endurecer la superficie: Endurecimiento por CASO.
Tratamiento térmico = temple >Martensita (detiene el deslizamiento).
Tratamiento térmico de la superficie exterior >Silencio. Llama local o temple por inducción con agua (engranajes).
Carbono penetrando en la superficie exterior > temple. Carburización (Calentamiento en empaque de carbono o gas de carbono o soluciones calentadas). La nitruración utiliza nitrógeno en lugar de carbono para conseguir un efecto similar, y es más fácil conseguir que penetre en la superficie.

Dureza a la llama del rollo de acero.: http://www.thermobondflame.com/Services.page?i=2
Aceros aleados
Efectos de los elementos de aleación en las propiedades del acero para herramientas: (Muy aproximadamente)
- Carbono: El aumento del contenido de carbono aumenta ligeramente la dureza y la resistencia al desgaste considerablemente. Aumenta drásticamente la dureza & la resistencia cuando se trata térmicamente.
- Manganeso: Pequeñas cantidades de manganense reducen la fragilidad y mejoran la forjabilidad. Mayores cantidades de manganeso mejoran la templabilidad, permiten el temple en aceite (se requiere un temple menos severo – lo que reduce la deformación por temple).
- Silicio: Mejora la fuerza, la tenacidad y la resistencia a los golpes.
- Tungsteno: Mejora la «dureza en caliente» – utilizado en el acero para herramientas de alta velocidad. Muy denso (pesado)
- Vanadio: Refina la estructura del carburo y mejora la forjabilidad, mejorando también la dureza y la resistencia al desgaste.
- Molibdeno: Mejora el endurecimiento profundo, la tenacidad y, en mayores cantidades, la «dureza en caliente». Se utiliza en el acero para herramientas de alta velocidad porque es más barato que el tungsteno.
- Cromo: Mejora la templabilidad, la resistencia al desgaste y la tenacidad.
- Níquel: Mejora la tenacidad y la resistencia al desgaste en menor grado.
La inclusión de estos elementos en diversas combinaciones puede actuar de forma sinérgica, aumentando los efectos de su uso por separado. (Por ejemplo, ciertos elementos de aleación pueden permitir más carbono, donde tanto carbono sería inviable en un acero al carbono simple). Otro ejemplo es la interesante forma en que el acero inoxidable (cromo y níquel añadidos al hierro) es bastante resistente a la corrosión.
Códigos de identificación de los aceros
Sistema de codificación AISI-SAE (American Iraon and Steel Institute – Society of Automotive Engineers). Se trata de un código de 4 dígitos, los 2 primeros indican el tipo de acero en general y los 2 últimos son el % de carbono x 100. Por ejemplo, 1010 es un acero al carbono con 0,10% de C, 5120 es un acero al cromo con 0,20% de C. Más detalles aquí

Códigos de acero americanos: De Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p21
La BSA (British Standards Association) utiliza un código de 6 dígitos. Los dígitos se separan en 3 grupos como se muestra a continuación. Por ejemplo, un acero con el código 070M20 sería 070 = acero al carbono o al carbono-manganeso, M = especificación de propiedades mecánicas, 20 = contenido de carbono 0,20%.

Códigos del acero británico: De Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p20
El número UNS (abreviatura de «Unified Numbering System for Metals and Alloys») es un esquema sistemático en el que cada metal se designa con una letra seguida de cinco números. Es un sistema basado en la composición de los materiales comerciales y no garantiza ninguna especificación de rendimiento o composición exacta con límites de impurezas. Se han incorporado otros sistemas de nomenclatura al sistema de numeración UNS para minimizar la confusión. Por ejemplo, el aluminio 6061 (AA6061) se convierte en UNS A96061. A continuación se ofrece una visión general del sistema UNS, con especial énfasis en las aleaciones comerciales más comunes. Como en cualquier sistema, existen ambigüedades como la distinción entre una superaleación basada en el níquel y un acero inoxidable con alto contenido de níquel.
-Axxxxx – Aleaciones de aluminio
-Cxxxxx – Aleaciones de cobre, incluidos el latón y el bronce
-Fxxxxx – Hierro, incluyendo Hierros Dúctiles y Hierros Fundidos
-Gxxxxx – Aceros al Carbono y Aleados
-Hxxxxx – Aceros – Aceros AISI H
-Jxxxxx – Aceros – Fundidos
-Kxxxxx – Aceros, incluyendo Maraging, Acero Inoxidable, HSLA, Superaleaciones Base Hierro
-L5xxxx – Aleaciones de Plomo, incluidas las aleaciones Babbit y las aleaciones para soldar
-M1xxxx – Aleaciones de magnesio
-Nxxxxx – Aleaciones de níquel
-Rxxxxx – Aleaciones refractarias ◦R03xxx- Aleaciones de molibdeno ◦R04xxx- Aleaciones de niobio (columbio) ◦R05xxx- Aleaciones de tantalio ◦R3xxxx- Aleaciones de cobalto ◦R5xxxx- Aleaciones de titanio ◦R6xxxx- Aleaciones de circonio
-Sxxxxx – Aceros inoxidables, incluidos los aceros inoxidables de endurecimiento por precipitación y las superaleaciones a base de hierro
-Txxxxx – Aceros para herramientas
-Zxxxxx – Aleaciones de zinc
Aceros para herramientas
Los aceros para herramientas están contemplados en la norma australiana AS1239 y es prácticamente la misma que la clasificación americana de aceros para herramientas AISI. (De forma similar a la norma británica 4659)
Por ejemplo: El acero para herramientas de trabajo en caliente AS 1239 de grado H13 que contiene 0,35% de carbono, 5,0% de cromo, 1,5% de molibdeno y 1% de vanadio se escribiría como X40CrMoV51 en DIN (alemán). Aceros rápidos, por ejemplo: AS 1239 grado M2 Contiene 0,85% de carbono, 4,0% de cromo, 5,0% de molibdeno, 6,0% de tungsteno, 2,0% de vanadio se escribiría como S 6-5-2 en DIN.
Selector de Aceros
Tamaño grande (400kB): steel_types_large.jpg
Tamaño imprimible (1.7MB): steel_types_fullsize.jpg
Grados de acero comunes en Australia (Edcon)
Fundición de hierro
Cuando se añade demasiado carbono al acero, éste no puede disolverse en la solución y crea una estructura totalmente diferente. A partir del diagrama Fe-C que vimos antes, la fundición se forma en el rango del 2% al 7% de carbono (en peso).
Hay muchos tipos de fundición, pero la fundición gris es la más conocida, utilizada a menudo para las bases de las máquinas herramienta. Es útil y popular por varias razones.
En primer lugar, la temperatura de fusión es más baja, lo que hace que sea más fácil de fundir. Esto se debe a que el eutéctico está a 4,3% C, dando un punto de fusión de sólo 1147oC. Este eutéctico produce un nuevo grano llamado ledeburita, que es una mezcla de austenita y cementita. (¿Recuerda la perlita? Era un eutectoide y estaba formado por capas de ferrita y cementita). Pero como un eutectoide es un punto bajo en la transición líquido-sólido, es el punto de fusión.
En segundo lugar, la fundición gris es genial para las bases de las máquinas. Normalmente, tanto carbono sería una pesadilla de fragilidad debido a la martensita y cementita extremas. Pero resulta que con el enfriamiento adecuado, el exceso de carbono forma escamas de grafito. Esto es completamente diferente a todos estos granos de Fe-C de los que hemos estado hablando, como la ferrita y la cementita y la perlita y la ledeburita. En cambio, el grafito es como una inclusión en el metal, y da a la fundición gris las propiedades de amortiguación adecuadas para las bases de las máquinas. Sin embargo, es un material con poca resistencia a la tracción, por lo que la fundición gris se suele utilizar cuando está en compresión. Sin embargo, la fundición gris es propensa a endurecerse debido al exceso de calor, por lo que no es fácil de soldar. Lo más frecuente es que se suelde, pero incluso eso es un poco dudoso comparado con la unión del acero.

Micrografía fotográfica de la fundición gris que muestra escamas de grafito en una matriz de ferrita. Fuente
| Nombre | Composición nominal | Forma y estado | Resistencia a la tracción | Alargamiento | Dureza | Usos | |
|---|---|---|---|---|---|---|---|
| Fundición gris (ASTM A48) | C 3.4, Si 1,8, Mn 0.5 | Fundición | – | 50 | 0,5 | 260 | Bloques de cilindros de motores, volantes, engranajes, bases de máquinas-herramienta |
| Fundición blanca | C 3.4, Si 0,7, Mn 0,6 | Fundición (en bruto) | – | 25 | 0 | 450 | Superficies de apoyo |
| Hierro maleable (ASTM A47) | C 2.5, Si 1,0, Mn 0,55 | Fundición (recocido) | 33 | 52 | 12 | 130 | Rodamientos de ejes, ruedas de rodadura, cigüeñales de automóviles |
| Hierro dúctil o nodular | C 3.4, P 0,1, Mn 0,4, Ni 1,0, Mg 0.06 | Fundición | 53 | 70 | 18 | 170 | Engranajes, árboles de levas, cigüeñales |
| Ni-duro tipo 2 | C 2,7, Si 0,6, Mn 0,5, Ni 4.5, Cr 2,0 | Fundición en arena | – | 55 | – | 550 | Aplicaciones de alta resistencia |
Glosario
- Aleación: Sustancia metálica que se compone de dos o más elementos.
- Austenita: Hierro cúbico centrado en la cara o una aleación de hierro basada en esta estructura.
- Bainita: El producto de la transformación final de la descomposición de la austenita.
- Cuerpo centrado: Estructura en la que cada átomo está rodeado por ocho átomos adyacentes, tanto si el átomo está situado en una esquina como en el centro de una celda unitaria.
- Cementita: La segunda fase que se forma cuando el carbono supera el límite de solubilidad.
- Punto crítico: Punto en el que las densidades del líquido y del vapor se igualan y la interfaz entre ambos desaparece. Por encima de este punto, sólo puede existir una fase.
- Delta hierro: La fase cúbica centrada en el cuerpo que resulta cuando la austenita deja de ser la forma más estable del hierro. Existe entre 2802 y 2552 grados F, tiene estructura de red BCC y es magnética.
- Eutéctico: Un sistema eutéctico ocurre cuando una fase líquida se transforma directamente en un sólido de dos fases.
- Eutectoide: Un sistema eutectoide se produce cuando un sólido monofásico se transforma directamente en un sólido bifásico.
- Centrada en la cara: Una estructura en la que hay un átomo en la esquina de cada celda unitaria y uno en el centro de cada cara, pero ningún átomo en el centro del cubo.
- Ferrita: Hierro cúbico centrado en el cuerpo o una aleación de hierro basada en esta estructura.
- Perlita fina:Resultado de las láminas finas cuando las velocidades de enfriamiento se aceleran y la difusión se limita a distancias más cortas.
- Hipereutectoide: Los sistemas hipereutectoides existen por debajo de la temperatura eutectoide.
- Hipoeutectoide: Los sistemas hipoeutectoides existen por encima de la temperatura eutectoide.
- Ledeburita: Eutéctico del hierro fundido. Existe cuando el contenido de carbono es superior al 2 por ciento. Contiene un 4,3 por ciento de carbono en combinación con el hierro.
- Línea de Líquido: En un diagrama de fase binaria, aquella línea o límite que separa las regiones de fase líquida y líquida + sólida. Para una aleación, la temperatura de liquidus es aquella temperatura a la que se forma por primera vez una fase sólida en condiciones de enfriamiento de equilibrio.
- Martensita: Una fase polimórfica inestable del hierro que se forma a temperaturas inferiores a la eutectoide porque la estructura cúbica centrada en la cara de la austenita se vuelve inestable. Cambia espontáneamente a una estructura centrada en el cuerpo por acción de cizallamiento, no por difusión.
- Microestructura: Estructura de las fases de un material. Sólo puede verse con un mircoscopio óptico o electrónico.
- Perlita: Mezcla laminar de ferrita y carburo formada por la descomposición de la austenita de composición eutectoide.
- Fase: Una porción homogénea de un sistema que tiene características físicas y químicas uniformes.
- Diagrama de fases: Una representación gráfica de las relaciones entre las restricciones ambientales, la composición y las regiones de estabilidad de fase, ordinariamente en condiciones de equilibrio.
- Polimórfico: La capacidad de un material sólido de existir en más de una forma o estructura cristalina.
- Enfriar: Enfriar rápidamente – por lo general cuando es demasiado rápido para formar perlita, y crear martensita en su lugar
- Línea de Sólido: En un diagrama de fases, el lugar de los puntos en los que se completa la solidificación tras el enfriamiento de equilibrio, o en el que comienza la fusión tras el calentamiento de equilibrio.
- Solubilidad: La cantidad de sustancia que se disolverá en una cantidad dada de otra sustancia.
DVDs:
Asignación:
Tratamiento de calor

Preguntas:
Asignación: