L’acier est le matériau d’ingénierie le plus important. La trempe de l’acier est très importante.
Vidéos de cours
![]() Acier contre acier
Acier contre acier
(séquences non montées)
![]() Acier : Partie 1 ,
Acier : Partie 1 , ![]() Acier : Partie 2 ,
Acier : Partie 2 , ![]() Acier : Partie 3
Acier : Partie 3
![]() Propriétés et structure du grain : BBC 1973 (Vieux mais très bon)
Propriétés et structure du grain : BBC 1973 (Vieux mais très bon)
Le fer est abondant dans l’univers, on le trouve dans le soleil et de nombreux types d’étoiles en quantité considérable. On pense que le noyau de la terre est composé de nickel et de fer, et qu’il est plus chaud que la surface du soleil. Cette chaleur intense du noyau interne provoque des déplacements de matière dans le noyau externe et le manteau (courants de convection).
(Note : C’est drôle comme on ne le sait pas vraiment hein ? – Nous savons qu’il fait de plus en plus chaud à mesure que l’on creuse plus profondément, mais nous ne pouvons que deviner à quel point il fait chaud au centre de la terre. Même à 12 km sous terre, les calculs des scientifiques étaient erronés à plus de 100 % – il faisait plus chaud que prévu. Lorsqu’on essaie de forer à ces profondeurs, la roche devient si chaude qu’elle se plastifie, se resserre sur le trou et bloque la foreuse. Des rats. Autant pour creuser jusqu’au centre de la terre).
Acier au carbone
L’acier est un alliage de fer (Fe) et de carbone (C), avec 0,2 à 2,04% de carbone en poids. Le carbone est le matériau d’alliage le plus rentable pour le fer, mais divers autres éléments d’alliage sont utilisés comme le manganèse, le chrome, le vanadium et le tungstène.
| Acier au carbone | ANSI def’n | Déf’n général | Applications et propriétés |
| Acier à faible teneur en carbone | 0.05-0,15% | <0,1% | Souple, ductile. Facile à former. |
| Acier doux | 0,16-0,29% | 0,1-0,25% | Faible résistance à la traction, mais il est bon marché et malléable ; la dureté de surface peut être augmentée par cémentation. |
| Acier à carbone moyen | 0,30-0,59% | 0,25-0,45% | Equilibre la ductilité et la résistance et présente une bonne résistance à l’usure ; utilisé pour les grandes pièces, le forgeage et les composants automobiles. |
| Acier à carbone élevé | 0.6-0,99% | 0,45-1,0% | Très résistant, utilisé pour les ressorts et les fils à haute résistance. |
| Acier à ultra-haut carbone | 1,0-2,0% | 1,0-1,50% (>1,5% rare) |
Très dur – couteaux, poinçons. Habituellement, tout ce qui dépasse 1,2% nécessiterait d’autres alliages pour éviter une fragilité excessive. Une teneur en carbone très élevée peut être obtenue en utilisant la métallurgie des poudres. |
| Fonte | – | 2,5-4,0% | Point de fusion plus bas, coulée facile, ténacité et résistance plus faibles que l’acier. |
Pourcentages de carbone dans diverses applications de l’acier;

Variation de la quantité d’éléments d’alliage et de la façon dont ils sont incorporés dans l’acier (éléments solutés, phase précipitée) influence des propriétés telles que la dureté, la ductilité et la résistance à la traction de l’acier résultant. Avec l’augmentation de la teneur en carbone, l’acier devient plus dur et plus résistant que le fer, mais aussi plus cassant. La solubilité maximale du carbone dans le fer (dans la région de l’austénite) est de 2,14 % en poids et se produit à 1149 °C ; des concentrations plus élevées de carbone ou des températures plus basses produiront de la cémentite (très cassante). Ajoutez un peu plus de carbone et vous obtenez de la fonte, dont le point de fusion est plus bas et qui est plus facile à couler.
Le fer forgé ne contient qu’une très faible quantité d’autres éléments, mais contient 1 à 3% en poids de laitier sous forme de particules allongées dans une direction, ce qui donne au fer un grain caractéristique. Il est plus résistant à la rouille que l’acier et se soude plus facilement. Il est courant aujourd’hui de parler de « l’industrie du fer et de l’acier » comme s’il s’agissait d’une seule entité, mais historiquement, il s’agissait de produits distincts.
L’acier est produit depuis des milliers d’années, mais il est devenu courant après que des méthodes de production plus efficaces ont été conçues au 17e siècle. Le processus Bessemer au milieu des années 1800 a rendu l’acier relativement peu coûteux pour les marchandises produites en masse. D’autres perfectionnements du procédé, tels que l’élaboration de l’acier à l’oxygène, ont permis de réduire encore le coût de production tout en améliorant la qualité du métal. Aujourd’hui, l’acier est l’un des matériaux les plus courants dans le monde et constitue un composant majeur des bâtiments, des outils, des automobiles et des appareils électroménagers.

Get pdf : XLER_International_Compare.pdf
VIDEO : Propriétés et structure du grain. BBC 1973
Ne riez pas de la date – cette vidéo bat toutes ces pathétiques vidéos modernes qui vous donnent une intro fantaisiste mais rien de plus qu’une tête parlante. Ils ne s’aventurent jamais hors du studio. Cette vieille vidéo est fabuleuse pour une introduction claire à la structure du grain de l’acier.
Partie 1 : Qu’est-ce qu’un grain ? (Vidéo 11MB)
- Les taches que l’on voit sur un objet galvanisé sont des cristaux ou des grains de zinc.
- Tous les métaux sont constitués de grains, mais ils sont généralement invisibles (trop petits pour être vus ou même brillance/couleur).
- Procédé de gravure : Finition miroir, acide puissant, lavée et scellée.
- Dans un métal pur, les grains sont de couleurs différentes en raison de la façon dont ils reflètent la lumière.
- De minuscules cristaux se développent vers l’extérieur jusqu’à se rencontrer. Chaque cristal entièrement développé est appelé un grain.
Partie 2 : Recristallisation (Vidéo 13MB)
- Avant le travail à froid, les grains sont de taille et de forme similaires
- Le travail à froid allonge les grains, augmente la dureté et la résistance, réduit la ductilité.
- A 350C, de nouveaux grains se forment dans l’Al pour remplacer les anciens grains. Appelé recristallisation
- La recristallisation ramollit, diminue la résistance, la ductilité augmente
- Une température de recristallisation excessive donne de mauvaises propriétés mécaniques
Partie 3 : Traitement thermique de l’acier (Vidéo 23MB)
- Les grains d’acier sont trop petits pour être visibles – besoin d’un microscope d’environ 250 fois de grossissement.
- Ferrite : De couleur claire. Composée de fer. Ductilité à l’acier
- Perlite : couleur plus foncée. Couches de fer + carbure de fer. Dureté et résistance à l’acier
- 100% Pearlite est d’environ 0,8%C. Pearlite, température de recristallisation 720C.
- Normalisation – refroidissement à l’air, réduction de la taille des grains et forme plus uniforme, ténacité accrue
- Trempe – augmente la dureté. Pas assez de temps pour que la perlite se forme, donc une structure en forme d’aiguille se forme – martensite. Très dur et cassant.
- Revenu – (après la trempe) restaure la ténacité. Modifie les aiguilles de martensite avec de petites paillettes de carbone. Cela donne de la dureté ET de la ténacité.
- Acier à 0,1%C (acier doux). Recristallisation 900C. Pas assez de carbone pour produire de la martensite.
Diagramme d’équilibre fer-carbone
Excellent lien (Université de Cambridge) : http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Un diagramme d’équilibre est un graphique des différents arrangements structurels qui se produisent dans une gamme d’un élément d’alliage.
Ce diagramme montre comment le fer et le carbone se combinent SI on les refroidit lentement (en équilibre). Moins de 2% est de l’acier, plus de 2% se dirige vers la gamme de la fonte où le carbone a tendance à coaguler (s’agglutiner). La cémentite Fe3C contient 6,67 % de carbone et est essentiellement une céramique. L’eutectoïde (perlite) à E a 0,83% C, moins de carbone est un acier hypoeutectoïde (A), et plus grand est hypereutectoïde (B). Fer alpha (ferrite), fer gamma (austénite, qui n’existe qu’à haute température), et fer delta (autre structure à haute température).
Deux changements de phase très importants ont lieu à 0,83%C et à 4,3% C. A 0,83%C et 723ºC, la transformation est eutectoïde, appelée perlite. Ces 2 phases se séparent en couches. De gamma (austénite) –> alpha + Fe3C (cémentite)
À 4,3% C et 1130ºC, la transformation est eutectique, appelée ledeburite. L(liquide) –> gamma (austénite) + Fe3C (cémentite). C’est la fonte.
BTW. Le carbone (12) étant beaucoup plus léger que le Fe (56), le % atomique réel de carbone (en comptant les atomes) est en fait environ 4,6 fois plus élevé que le %C en poids. Ce n’est donc pas si étonnant, n’est-ce pas ? Je veux dire comme comment 0,5% de Carbone peut totalement transformer le fer doux… c’est en fait environ 2% si on compte les atomes – et non la masse.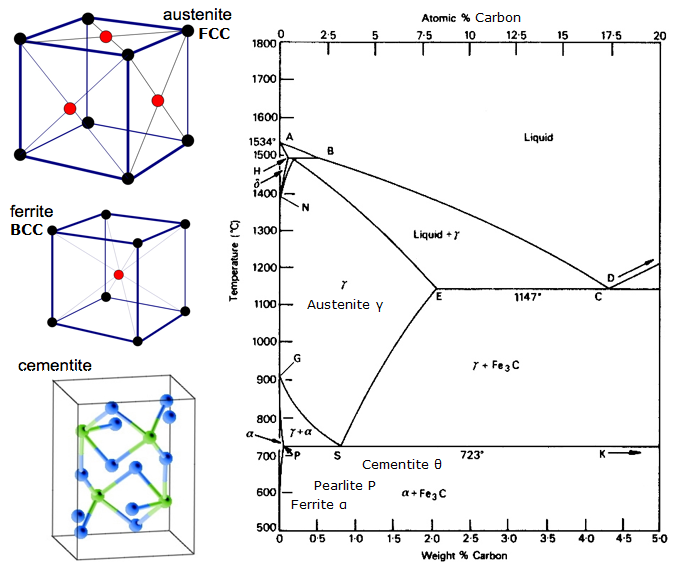
Résumé des structures Fe-C (grains)
- Austenite (fer γ). N’existe qu’au-dessus de 723C, ce qui correspond à l’apparition de la structure FCC γ-fer. Peut se dissoudre jusqu’à 2,1%C en masse. Non magnétique, doux (d’où le travail à chaud). L’austénite peut également exister à température ambiante si vous remplacez certains atomes de fer par d’autres, comme le nickel. C’est ce qu’est l’acier inoxydable austénitique, comme le 316 par exemple. Et, comme l’austénite à haute température, ces aciers inoxydables sont non magnétiques. Certains autres types d’acier inoxydable sont magnétiques.
- Cémentite (Carbure de fer Fe3C, 6,67%C en masse. Il y a douze atomes de fer et quatre atomes de carbone par cellule unitaire, donc 33% d’atomes de carbone). Très dur et cassant car c’est une céramique. Avez-vous déjà entendu parler du carbure de tungstène ? Eh bien, c’est du carbure de fer.
- Ledeburite (L’eutectique ferrite-cémentite, 4,3% de carbone.)
- Ferrite (α-fer, δ-fer ; mou). Sans carbone, BCC. Mou et ductile.
- Perlite (88% ferrite, 12% cémentite, soit 0,83%C) Plus solide que la ferrite
- Martensite. Se produit lorsque le refroidissement est trop rapide pour former de la perlite, ce qui bloque des pointes de cémentite dans le grain. Cela se produit lors du durcissement par trempe d’un acier contenant suffisamment de carbone. Très dur.
Micrographies (photos prises au microscope).
(A) = 0,1%C ferrite/perlite, (B) = 0,25%C plus de perlite, (C) = 0,83%C toute perlite, (D) = 1,4%C perlite/cémentite
Vue rapprochée de la perlite montrant des couches de ferrite (blanc) et de cémentite (foncé).
Plus sur la perlite : https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Grand diagramme d’équilibre FC

Version grand format 2000x2658px
Glissement
Lorsqu’une pièce de métal se déforme, ce sont les grains qui se déforment. Un grain est un cristal, un arrangement ordonné d’atomes dans une grille. Si les atomes sont étirés les uns des autres, il s’agit d’une déformation élastique car les atomes sont maintenus ensemble par les attractions électroniques – ce qui agit comme un ressort. Cependant, la déformation permanente (ou plastique) signifie que les atomes glissent réellement les uns sur les autres en couches ou en plans.
Les cristaux réels ne glissent pas dans tout un plan à la fois. Cela nécessiterait une force très élevée. Au lieu de cela, les imperfections du cristal permettent au glissement de se déplacer un atome à la fois. Plus l’éventail des atomes concernés est large, plus le grain est ductile (il glisse facilement). Voici un exemple d’une imperfection appelée dislocation qui peut se déplacer facilement dans le cristal.
Voici un exemple réel de glissement. (Nous ne sommes pas en train d’inventer !)
Micrographie électronique à balayage d’un monocristal de cadmium se déformant par glissement de dislocation sur 100 plans, formant des marches
sur la surface.
L’animation suivante montre un réseau d’atomes (comme dans un métal). Il n’y a que 2 façons de déformer les atomes – axial (tension et compression) et cisaillement (latéralement).
Cette animation ne montre que la partie élastique de la courbe de contrainte/déformation, où aucun glissement atomique ne se produit.
Le contenu de cette page nécessite une version plus récente d’Adobe Flash Player.

Plus d’informations ici : http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
De toute façon, qu’est-ce que le BCC et le FCC ?
Les structures cristallines BCC (Body Centred Cubic) et FCC (Face Centred Cubic) sont deux façons alternatives d’emballer les atomes de fer.
- Le BCC est l’arrangement à température ambiante appelé ferrite
- Le FCC est l’arrangement à haute température (>723oC) appelé austénite.
Télécharger les fichiers Inventor : SC, BCC, FCC, Les trois (SC+BCC+FCC)
![]()
SC est cubique simple et ne se produit pas avec des atomes de fer. C’est le réseau du sel – NaCl.
Le plus petit arrangement (unité) est montré ci-dessous. Remarquez comment la grille cubique (colorée en bleu) s’étend au fur et à mesure que les autres atomes sont ajustés entre eux dans les treillis BCC et FCC.
![]()
Il y a souvent une certaine confusion à propos de ces diagrammes ci-dessous.

Le problème est que les atomes rouges ressemblent à du carbone et les atomes noirs à du fer. Non, non, non !
Chaque atome est du fer ! Nous colorons juste les atomes de Fer qui ne sont pas sur les coins pour les rendre faciles à voir.
L’autre problème avec ces diagrammes est qu’il n’y a aucune indication réelle que l’espacement des atomes de coin AUGMENTE au fur et à mesure que vous allez de SC à BCC à FCC.
Structure SC (cubique simple). PAS LE FERAvec une structure SC (Simple Cubique) (ce que le fer ne fait pas), la distance entre les atomes est D. (Où D est le diamètre des atomes) Donc le volume de cette unité est D3, et le volume de l’atome est 4/3Πr3. Donc la densité est de 52% de l’atome solide. Pas très compact. |
 |
Structure BCC (Body Centred Cubic). FERRITEAvec une structure BCC (Body Centred Cubic) (ce que fait le fer sous 723oC), la distance entre les atomes de fer est de 1,1547D. (Où D est le diamètre des atomes) Donc le volume de cette unité est (1,1547D)3, et cela correspond à 2 atomes donc le volume des atomes est 2×4/3Πr3. Donc la densité est de 68% de l’atome solide. Plus compact. Cette structure est appelée ferrite. Le carbone ne rentre pas du tout dans cette structure. (Enfin, je dis un mensonge. Il peut dissoudre un pathétique 0,025% de C, ce qui est pratiquement nul, ou 0,035% à la température de transition, ce qui n’est toujours rien) |
 |
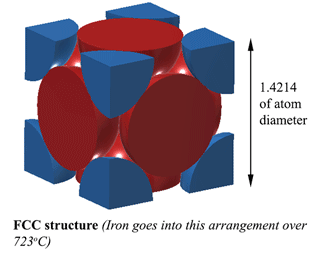
Structure FCC (Face Centred Cubic). AUSTENITEAvec une structure FCC (Face Centred Cubic) (que le fer fait sur 723oC), la distance entre les atomes de fer est de 1,4214D. (Où D est le diamètre des atomes) Donc le volume de cette unité est (1,4214D)3, et cela correspond à 4 atomes donc le volume des atomes est 4×4/3Πr3. La densité est donc de 74% de l’atome solide. C’est le plus compact, ce qui le rend 6% plus dense que la ferrite! Cette structure est appelée austenite, et elle peut dissoudre 2% de carbone dans sa structure. C’est 2% en poids n’oubliez pas, et puisque le fer (56) est 4,7 fois le poids du carbone (12), il peut dissoudre environ 21% d’atomes de carbone (Environ 1 carbone pour 5 atomes de fer). |
 |
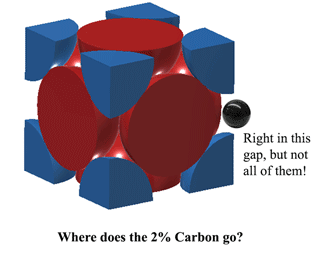
Alors, où se situe le carbone dans l’austénite ?Le carbone peut s’insérer directement dans cet espace au milieu de chaque bord unitaire. Cependant, cela provoque un peu de distorsion, donc vous ne pouvez pas adapter un atome de carbone sur CHAQUE bord. Au mieux, à 1130oC, l’austénite peut loger un peu plus de 2 atomes de carbone toutes les 3 unités. (2C:12Fe ou 1:6 par atomes). C’est de là que viennent les 2% en poids. Plus ici (assez lourd) https://hal.archives-ouvertes.fr/jpa-00246587/document |
 |
Plus d’informations sur le BCC et le FCC ici :
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Vidéo des structures cristallines cubique simple, cubique centrée sur le corps et cubique centrée sur la face. Les atomes de fer ne forment pas de cubique simple.
Cubique simple, cubique centré sur le corps et cubique centré sur la face
Durcissement de l’acier
Le durcissement consiste à empêcher le glissement de se produire.
Il y a 3 façons de le faire.
- Se débarrasser de toutes les imperfections (tâche plutôt impossible, bien que ce soit la raison pour laquelle des fibres très fines peuvent donner des résistances folles)
- Utiliser tous les glissements pour qu’il n’y ait plus de glissement. C’est ce qu’on appelle l’écrouissage.
- Bloquer le glissement pour qu’il ne se déplace plus à travers les grains. Le carbone (et l’azote) forment des composés qui agissent comme un agent de durcissement, empêchant les dislocations du réseau cristallin du fer (ferrite) de glisser les unes sur les autres. La martensite fait cela à merveille. C’est le durcissement par traitement thermique.
La trempe de l’acier n’apparaît pas sur le diagramme d’équilibre Fe-C, car la trempe n’est pas en équilibre ! (c’est-à-dire que le refroidissement est trop rapide pour que l’austénite contenant du carbone se retrouve dans la structure compliquée de la perlite.

De https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Le refroidissement rapide (trempe) produit une structure de grain différente appelée martensite. Ce grain est extrêmement dur et résistant, et cassant. Les pointes de carbure de fer qui pénètrent dans le grain empêchent maintenant le glissement, donc la ductilité est perdue.

Martensite : Université de Cambridge
Pour réduire la fragilité après la trempe, on utilise le revenu pour ajouter de la ténacité à l’acier. Cela modifie les dendrites de carbure pour leur donner un peu de ductilité – sans perdre trop de résistance et de dureté.
Le revenu doit se faire à une température inférieure à la recristallisation. Un four est préférable pour le tempérage, mais il peut être fait à la flamme en jugeant de la couleur de l’acier. La couleur de la trempe peut être utilisée comme un guide pour la température. Plus le revenu est chaud, plus l’acier est doux.
Les alliages comme l’acier inoxydable forment des films plus fins que les aciers au carbone pour une température donnée et produisent donc une couleur plus basse dans la série. Par exemple, la paille pâle correspond à 300°C pour l’acier inoxydable, au lieu de 230°C pour l’acier au carbone. Les couleurs plus froides que les rouges (en dessous de 500°C) sont en fait des décolorations d’oxydes, et non le rayonnement de la température elle-même. (Qui serait infrarouge, et invisible. Donc tout brille, vous ne pouvez simplement pas voir la lumière !)
| Couleur de rayonnement | Celcius | Farenht | Applications de trempe / Autres |
| Jaune-Blanc | 1539°C | 2800°F | Point de fusion le plus élevé (0%C fer pur) |
| Jaune vif | 1130°C | 2066°F | Point de fusion le plus bas (fonte à 4%C) |
| Jaune | 1093°C | 2000°F | Le cuivre fond à 1084°C, Or 1063°C |
| Jaune foncé | 1038°C | 1900°F | |
| Jaune orangé | 982°C | 1800°F | |
| Orange | 927°C | 1700°F | Le laiton fond à 930°C |
| Orange rouge | 871°C | 1600°F | |
| Rouge vif | 816°C | 1500°F | |
| Rouge | 760°C | 1400°F | Température de recristallisation de l’acier 723°C |
| Rouge moyen | 704°C | 1300°F | |
| Rouge terne | 649°C | 1200°F | L’aluminium fond à 600-660°C |
| Rouge clair | 593°C | 1100°F | Durcissement pour aciers de construction. |
| Très léger rouge, principalement gris | 538°C | 1000°F | Renforcement pour aciers de construction. |
| Gris foncé | 427°C | 0800°F | Renforcement pour aciers de construction. Changement magnétique 410 |
| Couleur d’oxydation | Celcius | Farenht | Applications de trempe |
| Bleu | 302°C | 0575°F | Scies pour bois, ressorts |
| Pourpre foncé | 282°C | 0540°F | Ciseaux à froid, setts pour acier |
| Pourpre | 271°C | 0520°F | Outils de presse, axes |
| Brun/Pourpre | 260°C | 0500°F | Poinçons, coupes, boutons-pression, forets hélicoïdaux, alésoirs |
| Brun | 249°C | 0480°F | Taps, lames de cisaillement pour métaux |
| Paille sombre | 241°C | 0465°F | Fraises, forets |
| Paille claire | 229°C | 0445°F | Outils de rabotage et de rainurage |
| Paille fine | 199°C | 0390°F |
Traitement thermique :
Vitesse de la trempe : Les aciers à haute teneur en carbone peuvent être trempés plus lentement, mais un acier à faible teneur en C devra être trempé rapidement pour avoir un quelconque effet de durcissement.
Vitesse de trempe : (LE PLUS RAPIDE) Eau salée > eau > huile > air > isolé. (LE PLUS LENT)
Pour un travail complexe et coûteux, il est préférable d’avoir un alliage à trempe lente car il est moins sensible aux variations de température. C’est pourquoi la plupart des aciers à outils pour des choses comme les outils de moulage par injection sont trempés à l’HUILE. La trempe à l’eau est bien pour les formes simples qui peuvent être contrôlées plus facilement, mais elle peut provoquer des fissures sur des sections plus épaisses parce que la surface se rétracte avant l’intérieur.
Durcissement par induction. Trempe par induction où l’induction électrique (changements magnétiques rapides) chauffe l’acier qui est rapidement suivi d’une trempe au jet d’eau. Mode de chauffage alternatif à la flamme ou au four.

Durcissement par induction. http://www.thermobondflame.com/Services.page?i=4
Comment durcir la surface : Trempe CASE.
Traitement thermique = trempe >Martensite (arrête le glissement).
Traitement thermique de la surface extérieure >trempe. Trempe locale à la flamme ou par induction avec de l’eau (engrenages).
Carbone pénétrant la surface extérieure >trempe. Carburation (Réchauffement dans une garniture de carbone ou un gaz de carbone ou des solutions chauffées). La nitruration utilise l’azote au lieu du carbone pour avoir un effet similaire, et il est plus facile de le faire pénétrer dans la surface.

Durcissement à la flamme du rouleau d’acier. : http://www.thermobondflame.com/Services.page?i=2
Aciers alliés
Effets des éléments d’alliage sur les propriétés de l’acier à outils : (Très grossièrement)
- Carbone : L’augmentation de la teneur en carbone augmente légèrement la dureté et considérablement la résistance à l’usure. Augmentation spectaculaire de la dureté & et de la résistance lors du traitement thermique.
- Manganèse : De petites quantités de Manganense réduisent la fragilité et améliorent la forgeabilité. De plus grandes quantités de manganèse améliorent la trempabilité, permettent la trempe à l’huile (une trempe moins sévère est nécessaire – ce qui réduit la déformation de la trempe).
- Silicium : Améliore la résistance, la ténacité et la résistance aux chocs.
- Tungstène : Améliore la « dureté à chaud » – utilisé dans l’acier à outils à haute vitesse. Très dense (lourd)
- Vanadium : Affine la structure du carbure et améliore la forgeabilité, améliorant également la dureté et la résistance à l’usure.
- Molybdène : Améliore la trempe profonde, la ténacité et, en plus grande quantité, la « dureté à chaud ». Utilisé dans l’acier à outils à haute vitesse parce qu’il est moins cher que le tungstène.
- Chrome : Améliore la trempabilité, la résistance à l’usure et la ténacité.
- Nickel : Améliore la ténacité et la résistance à l’usure dans une moindre mesure.
L’inclusion de ces éléments dans des combinaisons variables peut agir en synergie, augmentant les effets de leur utilisation seule. (Par exemple, cetain élément d’alliage peut permettre plus de carbone, là où autant de carbone serait irréalisable dans un acier ordinaire au carbone). Un autre exemple est la façon intéressante dont l’acier inoxydable (Chrome et Nickel ajoutés au fer) est assez résistant à la corrosion.
Codes d’identification des aciers
Système de codageAISI-SAE (American Iraon and Steel Institute – Society of Automotive Engineers). Un code à 4 chiffres, les 2 premiers chiffres donnent le type d’acier général, et les 2 derniers chiffres sont le % de carbone x 100. Par exemple, 1010 est un acier au carbone ordinaire avec 0,10% de C, 5120 est un acier au chrome avec 0,20% de C. Plus de détails ici

Codes américains de l’acier : D’après Higgins : Materials for Engineers aand Technicians 5th Ed. 2010. p21
La BSA (British Standards Association) utilise un code à 6 chiffres. Les chiffres sont séparés en 3 groupes comme indiqué ci-dessous. Par exemple, un acier avec le code 070M20 serait 070 = acier au carbone ou au carbone-manganèse, M = spécification des propriétés mécaniques, 20 = teneur en carbone 0,20%.

Codes des aciers britanniques : D’après Higgins : Materials for Engineers aand Technicians 5th Ed. 2010. p20
Le numéro UNS (abréviation de « Unified Numbering System for Metals and Alloys ») est un schéma systématique dans lequel chaque métal est désigné par une lettre suivie de cinq chiffres. Il s’agit d’un système basé sur la composition des matériaux commerciaux et ne garantit aucune spécification de performance ou de composition exacte avec des limites d’impuretés. D’autres systèmes de nomenclature ont été intégrés au système de numérotation UNS afin de minimiser la confusion. Par exemple, l’aluminium 6061 (AA6061) devient UNS A96061. Vous trouverez ci-dessous un aperçu du système UNS, avec un accent particulier sur les alliages commerciaux courants. Comme pour tout système, il existe des ambiguïtés telles que la distinction entre un superalliage à base de nickel et un acier inoxydable à haute teneur en nickel.
-Axxxxx – Alliages d’aluminium
-Cxxxxx – Alliages de cuivre, y compris le laiton et le bronze
-Fxxxxx – Fer, y compris les fers ductiles et les fers moulés
-Gxxxxx – Aciers au carbone et alliés
-Hxxxxx – Aciers – AISI H
-Jxxxxx – Aciers – moulés
-Kxxxxx – Aciers, y compris les aciers maraging, les aciers inoxydables, les HSLA, les superalliages à base de fer
-L5xxxx – Alliages de plomb, y compris les alliages Babbit et les alliages à braser
-M1xxxx – Alliages de magnésium
-Nxxxxx – Alliages de nickel
-Rxxxxx – Alliages réfractaires ◦R03xxx- Alliages de molybdène ◦R04xxx- Alliages de Niobium (Columbium) ◦R05xxx- Alliages de Tantale ◦R3xxxxx- Alliages de Cobalt ◦R5xxxxx- Alliages de Titane ◦R6xxxxx- Alliages de Zirconium
-Sxxxxx – Aciers Inoxydables, y compris l’acier inoxydable à durcissement par précipitation et les superalliages à base de fer
-Txxxxx – Aciers à outils
-Zxxxxx – Alliages de zinc
Aciers à outils
Les aciers à outils sont couverts par la norme australienne AS1239 et sont pratiquement identiques à la classification américaine AISI des aciers à outils. (De même que la norme britannique 4659)
Par exemple : L’acier à outils pour travail à chaud AS 1239 grade H13 contenant 0,35% de carbone, 5,0% de chrome, 1,5% de molybdène et 1% de vanadium s’écrirait comme X40CrMoV51 en DIN (allemand). Les aciers à grande vitesse, par exemple : AS 1239 grade M2 contenant 0,85% de carbone, 4,0% de chrome, 5,0% de molybdène, 6,0% de tungstène, 2,0% de vanadium s’écrirait comme S 6-5-2 dans la norme DIN.
Sélecteur d’aciers
Grande taille (400kB) : steel_types_large.jpg
Grande taille imprimable (1.7MB) : steel_types_fullsize.jpg
Common steel grades in Australia (Edcon)
Cast Iron
Lorsque trop de carbone est ajouté à l’acier, le carbone ne peut pas se dissoudre dans la solution et crée une structure totalement différente. D’après le diagramme Fe-C que nous avons vu précédemment, la Fonte se forme dans une fourchette de 2% à 7% de carbone (en poids).
Il existe de nombreux types de fonte, mais la Fonte grise est la plus connue, souvent utilisée pour les bases de machines-outils. Elle est utile et populaire pour plusieurs raisons.
Premièrement, sa température de fusion est plus basse, ce qui la rend plus facile à couler. En effet, l’eutectique est à 4,3% C, ce qui donne un point de fusion de seulement 1147oC. Cet eutectique produit un nouveau grain appelé ledeburite, qui est un mélange d’austénite et de cémentite. (Vous vous souvenez de la perlite ? C’était un eutectoïde et elle était composée de couches de ferrite et de cémentite). Mais comme un eutectoïde est un point bas dans la transition liquide-solide, c’est le point de fusion.
Deuxièmement, la fonte grise est formidable pour les bases de machines. Normalement, autant de carbone serait un cauchemar de fragilité en raison de la martensite et de la cémentite extrêmes. Mais il s’avère qu’avec le bon refroidissement, l’excès de carbone forme des paillettes de graphite. C’est complètement différent de tous ces grains de Fe-C dont nous avons parlé – comme la ferrite, la cémentite, la perlite et la ledéburite. Au lieu de cela, le graphite est comme une inclusion dans le métal, et il donne à la fonte grise des propriétés d’amortissement adaptées aux bases des machines. Il s’agit toutefois d’un matériau à faible résistance à la traction, de sorte que la fonte grise est généralement utilisée en compression. Le GCI a tendance à durcir sous l’effet d’un excès de chaleur et n’est donc pas facile à souder. Plus souvent, il serait brasé, mais même cela est un peu douteux par rapport à l’assemblage de l’acier.

Photo micrographique de la fonte grise montrant des flocons de graphite dans une matrice de ferrite. Source
| Nom | Composition nominale | Forme et condition | Résistance | Résistance à la traction | Elongation | Dureté | Utilisations |
|---|---|---|---|---|---|---|---|
| Fonte grise (ASTM A48) | C 3.4, Si 1,8, Mn 0.5 | Fonte | – | 50 | 0,5 | 260 | Blocs-cylindres de moteurs, volants, engrenages, bases de machines-outils |
| Fonte blanche | C 3.4, Si 0,7, Mn 0,6 | Fonte (telle que moulée) | – | 25 | 0 | 450 | Surfaces d’appui |
| Fonte malléable (ASTM A47) | C 2.5, Si 1,0, Mn 0,55 | Fonte (recuit) | 33 | 52 | 12 | 130 | Roulements d’essieux, roues de chenilles, vilebrequins d’automobiles |
| Fonte ductile ou nodulaire | C 3.4, P 0,1, Mn 0,4, Ni 1,0, Mg 0.06 | Fonte | 53 | 70 | 18 | 170 | Engrenages, arbres à cames, vilebrequins |
| Dureté du nickel de type 2 | C 2,7, Si 0,6, Mn 0,5, Ni 4.5, Cr 2,0 | Coulée au sable | – | 55 | – | 550 | Applications à haute résistance |
Glossaire
- Alliage : Substance métallique qui est composée de deux éléments ou plus.
- Austenite : Fer cubique à faces centrées ou un alliage de fer basé sur cette structure.
- Bainite : Le produit de la transformation finale de la décomposition de l’austénite.
- Centre du corps : Structure dans laquelle chaque atome est entouré de huit atomes adjacents, que l’atome soit situé à un coin ou au centre d’une cellule unitaire.
- Cementite : La seconde phase formée lorsque le carbone est en excès par rapport à la limite de solubilité.
- Point critique : Point où les densités du liquide et de la vapeur deviennent égales et où l’interface entre les deux disparaît. Au-dessus de ce point, une seule phase peut exister.
- Delta fer : La phase cubique centrée sur le corps qui résulte lorsque l’austénite n’est plus la forme la plus stable du fer. Existe entre 2802 et 2552 degrés F, a une structure de réseau BCC et est magnétique.
- Eutectique : Un système eutectique se produit lorsqu’une phase liquide se transforme directement en un solide à deux phases.
- Eutectoïde : Un système eutectoïde se produit lorsqu’un solide monophasé se transforme directement en un solide biphasé.
- Face centrée : Structure dans laquelle il y a un atome au coin de chaque cellule unitaire et un au centre de chaque face, mais aucun atome au centre du cube.
- Ferrite : Fer cubique centré sur le corps ou un alliage de fer basé sur cette structure.
- Parallite fine :résulte de lamelles fines lorsque les vitesses de refroidissement sont accélérées et que la diffusion est limitée à des distances plus courtes.
- Hypereutectoïde : Les systèmes hypereutectoïdes existent en dessous de la température eutectoïde.
- Hypoeutectoïde : Les systèmes hypoeutectoïdes existent au-dessus de la température eutectoïde.
- Ledeburite : Eutectique de la fonte. Elle existe lorsque la teneur en carbone est supérieure à 2 pour cent. Elle contient 4,3 pour cent de carbone en combinaison avec le fer.
- La ligne de liquidus : Sur un diagramme de phase binaire, cette ligne ou frontière séparant les régions de phase liquide et liquide + solide. Pour un alliage, la température de liquidus est la température à laquelle une phase solide se forme pour la première fois dans des conditions de refroidissement à l’équilibre.
- Martensite : Phase polymorphe instable du fer qui se forme à des températures inférieures à l’eutectoïde parce que la structure cubique à faces centrées de l’austénite devient instable. Elle se transforme spontanément en une structure centrée sur le corps par action de cisaillement, et non par diffusion.
- Microstructure : Structure des phases d’un matériau. Ne peut être vue qu’avec un mircoscope optique ou électronique.
- Pearlite : Mélange lamellaire de ferrite et de carbure formé par la décomposition de l’austénite de composition eutectoïde.
- Phase : Une portion homogène d’un système qui présente des caractéristiques physiques et chimiques uniformes.
- Diagramme de phase : Représentation graphique des relations entre les contraintes environnementales, la composition et les régions de stabilité de phase, ordinairement dans des conditions d’équilibre.
- Polymorphe : La capacité d’un matériau solide à exister sous plus d’une forme ou structure cristalline.
- Traitement : Refroidir rapidement – généralement lorsqu’il est trop rapide pour former de la perlite, et créer de la martensite à la place
- Ligne de solidus : Sur un diagramme de phase, le lieu des points auxquels la solidification est complète lors d’un refroidissement à l’équilibre, ou auxquels la fusion commence lors d’un chauffage à l’équilibre.
- Solubilité : La quantité de substance qui se dissout dans une quantité donnée d’une autre substance.
DVD:
Dossier :
Traitement thermique

Questions:
Dossier :