Staal is het belangrijkste constructiemateriaal. Het harden van staal is zeer belangrijk.
Lezing Video’s
![]() Staal vs staal
Staal vs staal
(Onbewerkt beeldmateriaal)
![]() Staal: Deel 1 ,
Staal: Deel 1 , ![]() Staal: Deel 2 ,
Staal: Deel 2 , ![]() Staal: Deel 3
Staal: Deel 3
![]() Eigenschappen en korrelstructuur: BBC 1973 (Oud maar zeer goed)
Eigenschappen en korrelstructuur: BBC 1973 (Oud maar zeer goed)
Iron is overvloedig aanwezig in het heelal, en wordt in aanzienlijke hoeveelheid aangetroffen in de zon en vele soorten sterren. Men denkt dat de kern van de aarde uit nikkel en ijzer bestaat, en heter is dan het oppervlak van de zon. Deze intense hitte van de binnenkern zorgt ervoor dat materiaal in de buitenkern en mantel in beweging komt (convectiestromingen).
(Opmerking: Grappig dat we dat niet echt weten, hè? – We weten dat het heter wordt naarmate je dieper graaft, maar we kunnen alleen maar gissen hoe heet het in het centrum van de aarde is. Zelfs op 12 km diepte zaten de berekeningen van de wetenschappers er meer dan 100% naast – het was er heter dan verwacht. Als je naar zo’n diepte probeert te boren, wordt het gesteente zo heet dat het plastisch wordt en zich tegen het gat drukt en de boor vastklemt. Ratten. Tot zover het graven naar het middelpunt van de aarde).
Koolstofstaal
Staal is een legering van ijzer (Fe) en koolstof (C), met 0,2 tot 2,04% koolstof in gewicht. Koolstof is het meest rendabele legeringsmateriaal voor ijzer, maar diverse andere legeringselementen worden gebruikt, zoals mangaan, chroom, vanadium en wolfraam.
| Koolstofstaal | ANSI def’n | General Def’n | Toepassingen en eigenschappen |
| Laag koolstofstaal | 0.05-0,15% | <0,1% | Zacht, kneedbaar. Gemakkelijk te vormen. |
| Mild staal | 0,16-0,29% | 0,1-0,25% | Lage treksterkte, maar het is goedkoop en smeedbaar; de hardheid van het oppervlak kan worden verhoogd door carboneren. |
| Medium koolstofstaal | 0,30-0,59% | 0,25-0,45% | Balanceert taaiheid en sterkte en heeft goede slijtvastheid; gebruikt voor grote onderdelen, smeedwerk en auto-onderdelen. |
| Hoog koolstofstaal | 0.6-0,99% | 0,45-1,0% | Zeer sterk, gebruikt voor veren en draden met hoge sterkte. |
| Ultra-hoog koolstofstaal | 1,0-2,0% | 1,0-1,50% (>1,5% zeldzaam) |
Zeer hard – messen, ponsen. Gewoonlijk zijn voor alles boven 1,2% andere legeringen nodig om overmatige brosheid te voorkomen. Een zeer hoog koolstofgehalte kan worden bereikt met poedermetallurgie. |
| Gietijzer | – | 2,5-4,0% | Lager smeltpunt, gemakkelijk gieten, lagere taaiheid en sterkte dan staal. |
Koolstofpercentages in diverse staaltoepassingen;

Het variëren van de hoeveelheid legeringselementen en de manier waarop ze in het staal zijn opgenomen (opgeloste elementen, geprecipiteerde fase) beïnvloedt eigenschappen als hardheid, ductiliteit en treksterkte van het resulterende staal. Naarmate het koolstofgehalte toeneemt, wordt staal harder en sterker dan ijzer, maar ook brosser. De maximale oplosbaarheid van koolstof in ijzer (in de austenietfase) bedraagt 2,14 gewichtspercenten en treedt op bij 1149 °C; hogere koolstofconcentraties of lagere temperaturen leiden tot cementiet (zeer bros). Voeg je meer koolstof toe, dan krijg je gietijzer, dat een lager smeltpunt heeft en gemakkelijker te gieten is.
Smeedijzer bevat slechts een zeer kleine hoeveelheid andere elementen, maar bevat 1-3% gewichtspercenten slak in de vorm van in één richting uitgerekte deeltjes, waardoor het ijzer een karakteristieke korrel krijgt. Het is roestbestendiger dan staal en laat zich gemakkelijker lassen. Het is tegenwoordig gebruikelijk om over “de ijzer- en staalindustrie” te spreken alsof het om één enkele entiteit gaat, maar historisch gezien waren het afzonderlijke producten.
Staal wordt al duizenden jaren geproduceerd, maar het werd algemeen nadat in de 17e eeuw efficiëntere productiemethoden waren bedacht. Het Bessemer-proces in het midden van de jaren 1800 maakte staal relatief goedkoop voor massaproduktie. Verdere verfijningen van het proces, zoals de productie van basiszuurstofstaal, verlaagden de productiekosten nog verder en verhoogden tegelijk de kwaliteit van het metaal. Tegenwoordig is staal een van de meest gebruikte materialen ter wereld en een belangrijk bestanddeel van gebouwen, gereedschap, auto’s en apparaten.

Geef pdf: XLER_International_Compare.pdf
VIDEO: Eigenschappen en korrelstructuur. BBC 1973
Lach niet om de datum – deze video verslaat al die zielige moderne video’s die je een mooie intro geven maar niet meer dan een pratend hoofd. Ze komen nooit de studio uit. Deze oude video is fantastisch voor een duidelijke inleiding in de staalkorrelstructuur.
Deel 1: Wat is een korrel? (Video 11MB)
- De vlekken op een gegalvaniseerd voorwerp zijn kristallen of zinkkorrels.
- Alle metalen bestaan uit korrels, maar ze zijn meestal onzichtbaar (te klein om te zien of dezelfde glans/kleur).
- Ets-proces: Spiegelafwerking, krachtig zuur, gewassen en verzegeld.
- In een zuiver metaal zijn de korrels verschillend van kleur door de manier waarop ze het licht weerkaatsen.
- Kleine kristallen groeien naar buiten tot ze elkaar ontmoeten. Elk volgroeid kristal wordt een korrel genoemd.
Deel 2: Herkristallisatie (Video 13MB)
- Vóór het koud bewerken hebben de korrels dezelfde grootte en vorm
- Koud bewerken verlengt de korrels, verhoogt de hardheid en sterkte, vermindert de vervormbaarheid.
- Bij 350C, vormen zich nieuwe korrels in het Al om oude korrels te vervangen. Dit noemt men herkristallisatie
- Herkristallisatie verzacht, verlaagt de sterkte, verhoogt de ductiliteit
- Overmatige herkristallisatietemperatuur geeft slechte mechanische eigenschappen
Deel 3: Warmtebehandeling van staal (Video 23MB)
- Staalkorrels zijn te klein om zichtbaar te zijn – hiervoor is een microscoop nodig met een vergroting van ongeveer 250 keer.
- Ferriet: Licht gekleurd. Gemaakt van ijzer. Vervormbaar tot het staal
- Pareliet: donkerder gekleurd. Lagen van ijzer + ijzerkoolcarbide. Hardheid en sterkte aan het staal
- 100% Pearliet is ongeveer 0,8%C. Pearliet, herkristallisatie temperatuur 720C.
- Normaliseren – afgekoeld in lucht, verkleinde korrelgrootte en meer uniforme vorm, taaiheid toegenomen
- Quenching – verhoogt hardheid. Niet genoeg tijd voor pareliet om zich te vormen, dus een naaldachtige structuur wordt gevormd – martensiet. Zeer hard en bros.
- Temperen – (na afschrikken) herstelt de taaiheid. Wijzigt de martensietnaalden met kleine vlokjes koolstof. Dit geeft hardheid EN taaiheid.
- 0,1%C staal (Mild staal). Herkristallisatie 900C. Niet genoeg koolstof om martensiet te produceren.
Iron-Carbon Equilibrium Diagram
Uitstekende link (Cambridge University): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Een evenwichtsdiagram is een grafiek van de verschillende structurele rangschikkingen die voorkomen binnen een bereik van een legeringselement.
Dit diagram laat zien hoe ijzer en koolstof zich combineren ALS het langzaam wordt afgekoeld (in evenwicht). Minder dan 2% is staal, meer dan 2% is op weg naar het gietijzer bereik waar koolstof de neiging heeft te coaguleren (samenklonteren). Cementiet Fe3C heeft 6,67%C en is in feite een keramiek. De eutectoïde (pearliet) bij E heeft 0,83% C, minder koolstof is een hypoeutectoïde staal (A), en meer is hypereutectoïde (B). Alfa-ijzer (ferriet), gamma-ijzer (austeniet, dat alleen bij hoge temperatuur bestaat), en delta-ijzer (een andere structuur bij hoge temperatuur).
Twee zeer belangrijke faseveranderingen vinden plaats bij 0,83%C en bij 4,3% C. Bij 0,83%C en 723ºC is de transformatie eutectoïde, pearliet genoemd. Deze 2 fasen scheiden zich in lagen. Van gamma (austeniet) –> alpha + Fe3C (cementiet)
Bij 4,3% C en 1130ºC is de transformatie eutectisch, ledeburiet genoemd. L(vloeibaar) –> gamma (austeniet) + Fe3C (cementiet). Dit is gietijzer.
BTW. Aangezien koolstof (12) veel lichter is dan Fe (56), is het werkelijke atomaire % koolstof (door atomen te tellen) in feite ongeveer 4,6 maal hoger dan het %C naar gewicht. Dus zo verbazingwekkend is het nu ook weer niet? Ik bedoel, zoals 0,5% koolstof een totale transformatie van zacht ijzer kan veroorzaken… het is eigenlijk ongeveer 2% als je atomen telt – niet massa.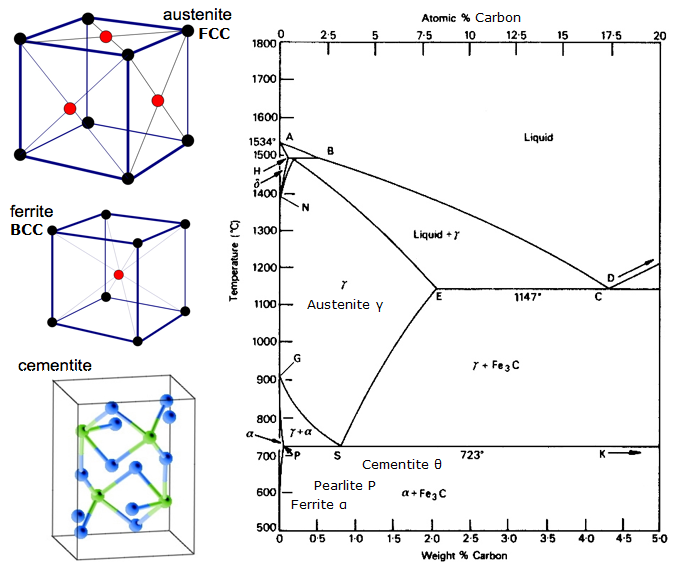
Samenvatting van Fe-C-structuren (korrels)
- Austeniet (γ-ijzer). Bestaat alleen boven 723C, dat is wanneer de FCC γ-ijzerstructuur optreedt. Kan oplossen tot 2,1%C in massa. Niet-magnetisch, zacht (vandaar warm bewerken). Austeniet kan ook bestaan bij kamertemperatuur als je enkele ijzeratomen verwisselt met iets anders – zoals nikkel. Dit is wat Austenitisch roestvast staal is – zoals 316 bijvoorbeeld. En, net als het Austeniet bij hoge temperatuur, is dit roestvast staal niet magnetisch. Sommige andere soorten roestvrij staal zijn magnetisch.
- Cementiet (ijzercarbide Fe3C, 6,67%C in massa. Er zijn twaalf ijzeratomen en vier koolstofatomen per eenheidscel, dus 33% koolstofatomen). Zeer hard en bros omdat het een keramiek is. Ooit gehoord van Tungsten Carbide? Wel, dit is Ijzer Carbide.
- Ledeburiet (Het Ferriet-Cementiet eutecticum, 4,3% koolstof.)
- Ferriet (α-ijzer, δ-ijzer; zacht). Geen koolstof, BCC. Zacht en kneedbaar.
- Pearlite (88% ferriet, 12% cementiet, dat is 0,83%C) Sterker dan Ferriet
- Martensiet. Treedt op wanneer de koeling te snel is om Pearliet te vormen, zodat pieken van Cementiet in de korrel worden opgesloten. Dit komt voor bij het afschrikken van staal met voldoende koolstof erin. Zeer hard.
Micrografen (foto’s uit een microscoop).
(A) = 0,1%C ferriet/parliet, (B) = 0,25%C meer parliet, (C) = 0,83%C alle parliet, (D) = 1,4%C parliet/cementiet
Opname van pareliet van dichtbij met lagen ferriet (wit) en cementiet (donker).
Meer over pareliet: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Large FC Equilibrium Diagram

Large Print Version 2000x2658px
Slip
Wanneer een stuk metaal wordt vervormd, zijn het de korrels die worden vervormd. Een korrel is een kristal, een ordelijke ordening van atomen in een rooster. Als atomen uit elkaar worden getrokken, is er sprake van elastische vervorming, omdat de atomen bij elkaar worden gehouden door elektronenaantrekkingskracht – die werkt als een veer. Permanente (of plastische) vervorming betekent echter dat de atomen in feite in lagen of vlakken langs elkaar heen glijden.
Echte kristallen glijden niet in één keer in een heel vlak langs elkaar heen. Daarvoor zou een zeer grote kracht nodig zijn. In plaats daarvan zorgen de onvolkomenheden in het kristal ervoor dat het glijden één atoom per keer gebeurt. Hoe groter het bereik van de betrokken atomen, hoe buigzamer (gemakkelijker glijdend) de korrel is. Hier is een voorbeeld van een imperfectie die een dislocatie wordt genoemd en die zich gemakkelijk door het kristal kan verplaatsen.
Hier is een echt voorbeeld van uitglijden. (We verzinnen dit niet zomaar!)
Een scan-elektronenmicrografie van een enkel cadmiumkristal dat vervormt door dislocatieverschuiving op 100 vlakken, waardoor
stappen
op het oppervlak worden gevormd.
De volgende animatie toont een raster van atomen (zoals in een metaal). Er zijn slechts 2 manieren om de atomen te vervormen – axiaal (spanning en compressie) en afschuiving (zijwaarts).
Deze animatie toont alleen het elastische deel van de spanning/rek kromme, waar geen atomaire slip optreedt.
Inhoud op deze pagina vereist een nieuwere versie van Adobe Flash Player.

Meer informatie vindt u hier: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
Wat zijn BCC en FCC eigenlijk?
De BCC (Body Centred Cubic) en FCC (Face Centred Cubic) kristalstructuren zijn twee alternatieve manieren om ijzeratomen te verpakken.
- BCC is de kamertemperatuur opstelling genoemd Ferriet
- FCC is de hoge temperatuur (>723oC) opstelling genoemd Austenite.
Download Inventor bestanden: SC, BCC, FCC, Alle drie (SC+BCC+FCC)
![]()
SC is Simple Cubic en komt niet voor met ijzeratomen. Dit is het rooster van zout – NaCl.
De kleinste rangschikking (eenheid) is hieronder afgebeeld. Merk op hoe het kubische rooster (blauw gekleurd) zich uitbreidt wanneer de andere atomen ertussen worden gepast in BCC- en FCC-roosters.
![]()
Er is vaak enige verwarring over deze diagrammen hieronder.

Het probleem is dat de rode atomen op koolstof lijken en de zwarte op ijzer. Nee, nee, nee!
Elk atoom is ijzer! We kleuren alleen de ijzeratomen die niet op de hoeken liggen, zodat ze gemakkelijk te zien zijn.
Het andere probleem met deze diagrammen is dat er geen echte aanwijzing is dat de afstand tussen de hoekatomen toeneemt als je van SC naar BCC naar FCC gaat.
SC (Eenvoudige Kubische) structuur. NIET IJZERBij een SC (Simple Cubic) structuur (die ijzer niet heeft), is de afstand tussen de atomen D. (Waarbij D de diameter van de atomen is) Dus volume van deze eenheid is D3, en volume van atoom is 4/3Πr3. Dichtheid is dus 52% van vast atoom. Niet erg compact. |
 |
BCC (Body Centred Cubic) structuur. FERRITEMet een BCC (Body Centred Cubic) structuur (wat ijzer doet onder 723oC), is de afstand tussen de ijzeratomen 1.1547D. (Waarbij D de diameter van de atomen is) Dus het volume van deze eenheid is (1.1547D)3, en hierin passen 2 atomen dus het volume van de atomen is 2×4/3Πr3. Dus dichtheid is 68% van vast atoom. Compacter. Deze structuur wordt Ferriet genoemd. Koolstof past helemaal niet in deze structuur (Nou ja, ik vertel een leugen. Het kan een zielige 0,025% C oplossen, wat vrijwel nul is, of 0,035% bij de overgangstemperatuur, wat nog steeds niets is) |
 |
FCC (Face Centred Cubic) structuur. AUSTENITEMet een FCC (Face Centred Cubic) structuur (wat ijzer doet boven 723oC), is de afstand tussen de ijzeratomen 1.4214D. (Waarbij D de diameter van de atomen is) Dus het volume van deze eenheid is (1.4214D)3, en hier passen 4 atomen in dus het volume van de atomen is 4×4/3Πr3. De dichtheid is dus 74% van het vaste atoom. Dit is de meest compacte, waardoor het 6% dichter is dan Ferriet! Deze structuur wordt Austeniet genoemd, en het kan 2% Koolstof in zijn structuur oplossen. Dat is 2% in gewicht, vergeet dat niet, en aangezien ijzer (56) 4,7 keer zo zwaar is als koolstof (12), kan het ongeveer 21% koolstofatomen oplossen (ongeveer 1 koolstof voor elke 5 ijzeratomen). |
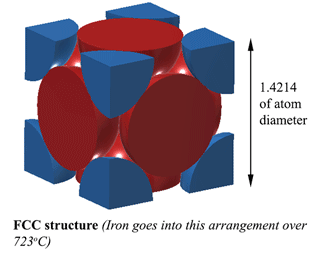 |
Dus waar past de koolstof in Austeniet?Koolstof past precies in die ruimte in het midden van elke eenheidsrand. Dit veroorzaakt echter een beetje vervorming, zodat niet op IEDERE rand een koolstofatoom past. Bij 1130oC past er in Austeniet hoogstens iets meer dan 2 Koolstofatomen per 3 eenheden. (2C:12Fe of 1:6 in atomen). Dat is waar 2% van het gewicht vandaan komt. Meer hier (vrij zwaar) https://hal.archives-ouvertes.fr/jpa-00246587/document |
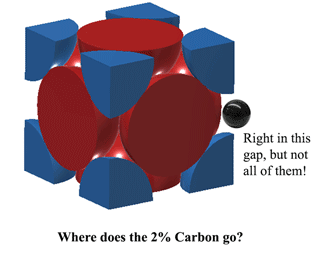 |
Verder informatie over BCC en FCC hier:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Video van Simple Cubic, Body-Centred Cubic en Face Centred Cubic kristalstructuren. IJzeratomen vormen geen enkelvoudige kubus.
Eenvoudige kubus, gecentreerd kubus en gecentreerd kubus
Harden van staal
Harden heeft alles te maken met het voorkomen van doorslippen.
Er zijn 3 manieren om dit te doen.
- Alle onvolkomenheden wegwerken (vrij onmogelijke taak, hoewel dit de reden is waarom zeer fijne vezels waanzinnige sterktes kunnen geven)
- Alle slippen opgebruiken zodat er geen slippen meer kan optreden. Dit noemt men werkharding.
- Blokkeer slip van het reizen helemaal door de korrels. Koolstof (en Stikstof) vormen verbindingen die als een hardingsmiddel fungeren en voorkomen dat dislocaties in het ijzerkristalrooster (Ferriet) langs elkaar heen glijden. Martensiet doet dit prachtig. Dit is warmtebehandeling harden.
Harden van staal is niet te zien op het Fe-C evenwichtsdiagram, omdat afkoelen niet in evenwicht is! (d.w.z. de afkoeling is te snel voor het Austeniet met koolstof erin om zich in de gecompliceerde Pearlietstructuur te nestelen.

Van https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
De snelle afkoeling (quenching) produceert een andere korrelstructuur, Martensiet genaamd. Deze korrel is extreem hard en sterk, en bros. De ijzerkoolstofpikels die door de korrel heen dringen, verhinderen nu het wegglijden, zodat de ductiliteit verloren gaat.

Martensiet: University of Cambridge
Om de brosheid na het afschrikken te verminderen, wordt ontlaten gebruikt om taaiheid aan het staal toe te voegen. Dit wijzigt de dendrieten van carbide om ze een beetje taaiheid te geven – zonder al te veel sterkte en hardheid te verliezen.
Tempereren moet gebeuren bij een temperatuur die lager is dan herkristallisatie. Een oven is het beste voor het temperen, maar het kan ook met de vlam worden gedaan door de kleur van het staal te beoordelen. De kleur van het staal kan als richtlijn voor de temperatuur worden gebruikt. Hoe heter de ontlaten, hoe zachter het staal.
Legeringen zoals roestvrij staal vormen dunnere lagen dan koolstofstaal voor een bepaalde temperatuur en geven dus een kleur lager in de reeks. Zo komt bijvoorbeeld bleek stro overeen met 300°C voor SS, in plaats van 230°C voor CS. De kleuren kouder dan de rode (onder 500°C) zijn eigenlijk verkleuring van oxiden, niet de eigenlijke stralingsgloed van de temperatuur zelf. (Die zou infra-rood zijn, en onzichtbaar. Dus alles gloeit, je kunt het licht alleen niet zien!)
| Stralingskleur | Celcius | Farenht | Temperingstoepassingen / Andere |
| Geel-Wit | 1539°C | 2800°F | Hoogste smeltpunt (0%C zuiver ijzer) |
| Bright Yellow | 1130°C | 2066°F | Laagste smeltpunt (4%C gietijzer) |
| Geel | 1093°C | 2000°F | Koper smelt bij 1084°C, Goud 1063°C |
| Donkergeel | 1038°C | 1900°F | |
| Oranjegeel | 982°C | 1800°F | |
| Oranje | 927°C | 1700°F | Bras smelt 930°C |
| Oranje rood | 871°C | 1600°F | |
| Glanzend rood | 816°C | 1500°F | |
| Rood | 760°C | 1400°F | Steel herkristallisatie temperatuur 723°C |
| Middelrood | 704°C | 1300°F | |
| Dof rood | 649°C | 1200°F | Aluminium smelt 600-660°C |
| Lichtrood | 593°C | 1100°F | Harding voor constructiestaal. |
| Zeer licht rood, overwegend grijs | 538°C | 1000°F | Harding voor constructiestaal. |
| Donkergrijs | 427°C | 0800°F | Harding voor constructiestaal. Magnetische verandering 410 |
| Oxidatiekleur | Celcius | Farenht | Temperingstoepassingen |
| Blauw | 302°C | 0575°F | Zaagt voor hout, veren |
| Donkerpaars | 282°C | 0540°F | Koude beitels, boren voor staal |
| Paars | 271°C | 0520°F | Drukgereedschap, assen |
| Bruin/Paars | 260°C | 0500°F | Punchen, cups, snaps, twistboren, ruimers |
| Bruin | 249°C | 0480°F | Taps, schaarmessen voor metalen |
| Donkere stro | 241°C | 0465°F | frezen, boren |
| Licht stro | 229°C | 0445°F | Gereedschap voor schaven en sleuven |
| Vleine stro | 199°C | 0390°F |
Kalken:
Snelheid van afschrikken: Hoger koolstofstaal kan langzamer worden afgeschrikt, maar een lager C-staal zal snel moeten worden afgeschrikt om enig afschrikkingseffect te hebben.
Snelheid van afschrikken: (SNELST) Zout water > water > olie > lucht > geïsoleerd. (SLOWEST)
Voor een complexe en dure job, is het beter om een traag dovende legering te hebben omdat het minder gevoelig is voor temperatuurschommelingen. Dit is de reden waarom de meeste gereedschapsstalen voor dingen zoals spuitgietmatrijzen OLIE-gequenched zijn. Water afschrikken is prima voor eenvoudige vormen die gemakkelijker gecontroleerd kunnen worden, maar het kan scheurvorming veroorzaken bij dikkere delen omdat het oppervlak krimpt voordat de binnenkant dat doet.
Inductieharden. Inductieharden waarbij elektrische inductie (snelle magnetische veranderingen) het staal verhit dat snel gevolgd wordt door afschrikken in een waterstraal. Alternatieve manier van verhitten in plaats van vlam of oven.

Inductieharden. http://www.thermobondflame.com/Services.page?i=4
Hoe het oppervlak te harden: CASE Hardening.
Heat treat = quench > Martensiet (arresteert slip).
Het buitenoppervlak > quench. Plaatselijk vlam of inductie gequenched met water (tandwielen).
Koolstof doordringend in het buitenoppervlak > quench. Carboneren (opwarmen in koolstofpakking of koolstofgas of verwarmde oplossingen). Nitreren gebruikt stikstof in plaats van koolstof om een vergelijkbaar effect te hebben, en het is gemakkelijker om het in het oppervlak te laten doordringen.

Vlamharden van staalrol.: http://www.thermobondflame.com/Services.page?i=2
Alloy Steels
Effecten van legeringselementen op de eigenschappen van gereedschapsstaal: (Zeer ruwweg)
- Koolstof: Verhoging van het koolstofgehalte verhoogt de hardheid enigszins en de slijtvastheid aanzienlijk. Dramatische verhoging van de hardheid & sterkte bij warmtebehandeling.
- Mangaan: Kleine hoeveelheden Manganense verminderen brosheid en verbeteren smeedbaarheid. Grotere hoeveelheden mangaan verbeteren de hardbaarheid, staan olie quenching toe (minder streng quenching vereist – wat quenching vervorming vermindert).
- Silicium: Verbetert sterkte, taaiheid, en schokbestendigheid.
- Wolfraam: Verbetert de “warme hardheid” – gebruikt in gereedschapsstaal met hoge snelheid. Zeer dicht (zwaar)
- Vanadium: Verfijnt de carbidestructuur en verbetert de smeedbaarheid, verbetert ook de hardheid en slijtvastheid.
- Molybdeen: Verbetert diepe harding, taaiheid, en in grotere hoeveelheden, “hete hardheid”. Gebruikt in hoge snelheid gereedschapsstaal omdat het goedkoper is dan wolfraam.
- Chroom: Verbetert de hardbaarheid, slijtvastheid en taaiheid.
- Nikkel: Verbetert taaiheid en slijtvastheid in mindere mate.
Het opnemen van deze elementen in wisselende combinaties kan synergetisch werken, waardoor de effecten van het gebruik van hen alleen toenemen. (Bijvoorbeeld, kunnen de cetain legeringselementen meer koolstof toelaten, waar zo veel koolstof in een zuiver koolstofstaal onwerkbaar zou zijn). Een ander voorbeeld is de interessante manier waarop roestvrij staal (chroom en nikkel toegevoegd aan ijzer) behoorlijk corrosiebestendig is.
Steels Identification Codes
AISI-SAE Coding system (American Iraon and Steel Institute – Society of Automotive Engineers). Een 4-cijferige code, de eerste 2 cijfers geven de algemene staalsoort aan, en de laatste 2 cijfers zijn het % koolstof x 100. Bijvoorbeeld, 1010 is gewoon koolstofstaal met 0,10% C, 5120 is een chroomstaal met 0,20% C. Meer details hier

American Steel codes: Van Higgins: Materials for Engineers and Technicians 5th Ed. 2010. p21
De BSA (British Standards Association) gebruikt een code van 6 cijfers. De cijfers zijn verdeeld in 3 groepen, zoals hieronder aangegeven. Bijvoorbeeld, een staal met de code 070M20 zou zijn 070 = koolstof- of koolstofmangaanstaal, M = specificatie van de mechanische eigenschappen, 20 = koolstofgehalte 0,20%.

British Steel codes: Van Higgins: Materials for Engineers and Technicians 5th Ed. 2010. p20
Het UNS-nummer (afkorting van “Unified Numbering System for Metals and Alloys”) is een systematisch schema waarin elk metaal wordt aangeduid door een letter gevolgd door vijf cijfers. Het is een op samenstelling gebaseerd systeem van commerciële materialen en garandeert geen prestatiespecificaties of exacte samenstelling met onzuiverheidsgrenzen. Andere nomenclatuursystemen zijn in het UNS-nummeringssysteem opgenomen om verwarring tot een minimum te beperken. Aluminium 6061 (AA6061) wordt bijvoorbeeld UNS A96061. Hieronder volgt een overzicht van het UNS systeem, met speciale nadruk op veel voorkomende commerciële legeringen. Zoals bij elk systeem zijn er onduidelijkheden, zoals het onderscheid tussen een superlegering op nikkelbasis en een roestvrij staal met een hoog nikkelgehalte.
-Axxxxx – aluminiumlegeringen
-Cxxxxx – koperlegeringen, inclusief messing en brons
-Fxxxxx – ijzer, inclusief nodulair en gietijzer
-Gxxxxx – koolstof- en gelegeerd staal
-Hxxxxx – staal – AISI H-staal
-Jxxxxx – gietstaal
-Kxxxxx – staal, inclusief maraging, roestvrij staal, HSLA, ijzer-base superlegeringen
-L5xxxx – loodlegeringen, waaronder Babbit-legeringen en soldeerlegeringen
-M1xxxx – magnesiumlegeringen
-Nxxxxx – nikkellegeringen
-Rxxxxx – vuurvaste legeringen ◦R03xxx- molybdeenlegeringen ◦R04xxx- niobium (columbium) Niobium (Columbium) legeringen ◦R05xxx- Tantaal legeringen ◦R3xxxx- Kobalt legeringen ◦R5xxxx- Titaan legeringen ◦R6xxxx- Zirkonium legeringen
-Sxxxxx – Roestvaste staalsoorten, inclusief precipitatiehardend roestvast staal en op ijzer gebaseerde superlegeringen
-Txxxxx – gereedschapsstaal
-Zxxxxx – zinklegeringen
Gereedschapsstaal
Gereedschapsstaal valt onder de Australische norm AS1239 en komt vrijwel overeen met de Amerikaanse AISI gereedschapsstaalclassificatie. (Hetzelfde geldt voor de Britse standaard 4659)
Bijvoorbeeld: AS 1239 grade H13 warmwerk gereedschapsstaal met 0,35% koolstof, 5,0% chroom, 1,5% molybdeen en 1% vanadium zou in DIN (Duits) geschreven worden als X40CrMoV51. Hoge snelheid staal, bijvoorbeeld: AS 1239 grade M2 met 0,85% koolstof, 4,0% chroom, 5,0% molybdeen, 6,0% wolfraam, 2,0% vanadium zou geschreven worden als S 6-5-2 in DIN.
Steels Selector
Groot formaat (400kB): steel_types_large.jpg
Afdrukbaar formaat (1.7MB): staal_soorten_volledig.jpg
Gemeenschappelijke staalsoorten in Australië (Edcon)
Gietijzer
Als er te veel koolstof aan staal wordt toegevoegd, kan de koolstof niet in de oplossing oplossen en ontstaat er een totaal andere structuur. Uit het Fe-C-diagram dat we eerder zagen, blijkt dat gietijzer wordt gevormd in het bereik van 2% tot 7% koolstof (in gewicht).
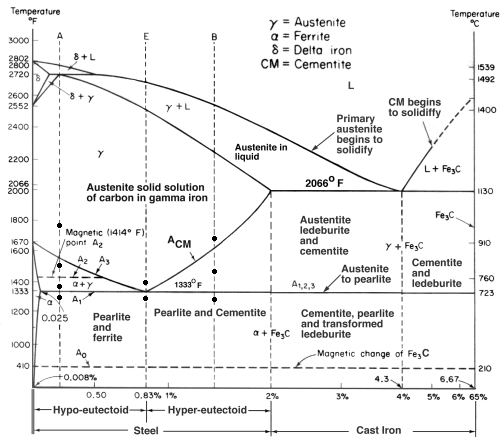
Er zijn vele soorten gietijzer, maar grijs gietijzer is het meest bekend en wordt vaak gebruikt voor onderstellen van gereedschapsmachines. Het is om verschillende redenen nuttig en populair.
Vooreerst is de smelttemperatuur lager, waardoor het gemakkelijker te gieten is. Dit komt doordat het eutectisch bij 4,3% C ligt, wat een smeltpunt geeft van slechts 1147oC. Dit eutecticum produceert een nieuwe korrel, ledeburiet genaamd, die een mengsel is van austeniet en cementiet. (Herinner je je Pearlite? Dat was een eutectoïde en bestond uit lagen ferriet en cementiet). Maar omdat een eutectoïde een laag punt is in de overgang vloeistof/vaste stof, is het smeltpunt.
Tweede, Grijs Gietijzer is geweldig voor machinebases. Normaal gesproken zou zoveel koolstof een nachtmerrie van brosheid zijn door extreme martensiet en cementiet. Maar het blijkt dat met de juiste koeling, overtollige koolstof vlokken grafiet vormt. Dit is iets heel anders dan al die Fe-C korrels waar we het over hebben gehad – zoals Ferriet en Cementiet en Pareliet en Ledeburiet. In plaats daarvan is grafiet als een insluiting in het metaal, en het geeft grijs gietijzer de dempende eigenschappen die geschikt zijn voor machinebases. Het is echter een materiaal met een lage treksterkte, zodat GCI meestal wordt gebruikt waar het wordt samengedrukt. GCI is echter gevoelig voor verharding door oververhitting, zodat het niet gemakkelijk te lassen is. Vaker wordt het gesoldeerd, maar zelfs dat is een beetje onbetrouwbaar vergeleken met het verbinden van staal.

Fotomicrografie van grijs gietijzer waarop grafietvlokken in een ferrietmatrix te zien zijn. Bron
| Naam | Nominale samenstelling | Vorm en toestand | opbrengststerkte | treksterkte | verlenging | hardheid | toepassingen |
|---|---|---|---|---|---|---|---|
| Grijs gietijzer (ASTM A48) | C 3.4, Si 1,8, Mn 0.5 | Gietwerk | – | 50 | 0.5 | 260 | Cilinderblokken van motoren, vliegwielen, tandwielen, onderstellen van gereedschapswerktuigen |
| Wit gietijzer | C 3..4, Si 0.7, Mn 0.6 | Gegoten (zoals gegoten) | – | 25 | 0 | 450 | Lageroppervlakken |
| Smeedbaar ijzer (ASTM A47) | C 2.5, Si 1.0, Mn 0.55 | Gegoten (gegloeid) | 33 | 52 | 12 | 130 | Tussenlagers, spoorwielen, krukassen |
| Trekbaar of nodulair ijzer | C 3.4, P 0,1, Mn 0,4, Ni 1,0, Mg 0.06 | Gegoten | 53 | 70 | 18 | 170 | Gears, nokkenassen, krukassen |
| Ni-hard type 2 | C 2,7, Si 0,6, Mn 0,5, Ni 4.5, Cr 2.0 | Zandgegoten | – | 55 | – | 550 | hogesterkte toepassingen |
Glossary
- Alloy: Een metaalachtige stof die is samengesteld uit twee of meer elementen.
- Austeniet: Face-centered cubic ijzer of een ijzerlegering gebaseerd op deze structuur.
- Bainiet: Het product van de laatste transformatie van de ontleding van austeniet.
- Body-centered: Een structuur waarin elk atoom wordt omgeven door acht aangrenzende atomen, ongeacht of het atoom zich in een hoek of in het midden van een eenheidscel bevindt.
- Cementiet: De tweede fase die wordt gevormd wanneer koolstof de oplosbaarheidsgrens overschrijdt.
- Kritisch punt: Punt waar de dichtheden van vloeistof en damp gelijk worden en het grensvlak tussen beide verdwijnt. Boven dit punt kan slechts één fase bestaan.
- Delta-ijzer: De lichaam-gecentreerde kubische fase die ontstaat wanneer austeniet niet langer de meest stabiele vorm van ijzer is. Bestaat tussen 2802 en 2552 graden F, heeft BCC roosterstructuur en is magnetisch.
- Eutectisch: Een eutectisch systeem ontstaat wanneer een vloeibare fase direct overgaat in een twee-fasen vaste stof.
- Eutectoïde: Een eutectoïde systeem doet zich voor wanneer een éénfasige vaste stof rechtstreeks in een tweefasige vaste stof overgaat.
- Face-centered: Een structuur waarin er een atoom op de hoek van elke eenheidscel en een in het centrum van elk gezicht, maar geen atoom in het centrum van de kubus.
- Ferriet: Lichaamsgecentreerd kubisch ijzer of een ijzerlegering op basis van deze structuur.
- Fijn pareliet: ontstaat uit dunne lamellen wanneer de afkoelsnelheid wordt versneld en de diffusie tot kortere afstanden wordt beperkt.
- Hypereutectoïde: Hypereutectoïde systemen bestaan onder de eutectoïde temperatuur.
- Hypoeutectoïd: Hypoeutectoïd systemen bestaan boven de eutectoïd temperatuur.
- Ledeburiet: Eutectisch materiaal van gietijzer. Het bestaat wanneer het koolstofgehalte groter is dan 2 procent. Het bevat 4,3 procent koolstof in combinatie met ijzer.
- Liquidus Lijn: Op een binair fasediagram, die lijn of grens die vloeibare en vloeibare + vaste fase gebieden scheidt. Voor een legering is de liquidustemperatuur de temperatuur waarbij zich voor het eerst een vaste fase vormt onder condities van evenwichtskoeling.
- Martensiet: Een onstabiele polymorfe fase van ijzer die zich vormt bij temperaturen onder de eutectoïde omdat de face-centered cubic structuur van austeniet onstabiel wordt. Het verandert spontaan in een lichaamsgecentreerde structuur door afschuiving, niet door diffusie.
- Microstructuur: Structuur van de fasen in een materiaal. Kan alleen worden gezien met een optische of elektronen mircoscoop.
- Pearliet: Een lamellair mengsel van ferriet en carbide gevormd door ontleding van austeniet van eutectoïde samenstelling.
- Fase: Een homogeen deel van een systeem dat uniforme fysische en chemische eigenschappen heeft.
- Fasendiagram: Een grafische voorstelling van de relaties tussen milieueisen, samenstelling, en regio’s van fase stabiliteit, gewoonlijk onder voorwaarden van evenwicht.
- Polymorf: De mogelijkheid van een vast materiaal om te bestaan in meer dan één vorm of kristalstructuur.
- Koken: Om snel af te koelen – meestal wanneer te snel om Pearliet te vormen, en Martensiet in plaats daarvan te creëren
- Soliduslijn: Op een fasediagram, de locus van punten waar de solidificatie volledig is bij evenwichtskoeling, of waar het smelten begint bij evenwichtsverhitting.
- Solubiliteit: De hoeveelheid stof die zal oplossen in een gegeven hoeveelheid van een andere stof.
DVD’s:
Opdracht:
Heat Treat

Vragen:
Opdracht: