L’acciaio è il materiale di ingegneria più importante. La tempra dell’acciaio è molto importante.
Video delle lezioni
![]() Acciaio contro acciaio
Acciaio contro acciaio
(filmati inediti)
![]() Acciaio: Parte 1 ,
Acciaio: Parte 1 , ![]() Acciaio: Parte 2 ,
Acciaio: Parte 2 , ![]() Acciaio: Parte 3
Acciaio: Parte 3
![]() Proprietà e struttura del grano: BBC 1973 (Vecchio ma molto buono)
Proprietà e struttura del grano: BBC 1973 (Vecchio ma molto buono)
Il ferro è abbondante nell’universo, si trova nel sole e in molti tipi di stelle in quantità considerevole. Si pensa che il nucleo della terra sia composto da nichel e ferro e che sia più caldo della superficie del sole. Questo calore intenso del nucleo interno fa sì che il materiale del nucleo esterno e del mantello si muova (correnti di convezione).
(Nota: Divertente come non lo sappiamo veramente eh? – Sappiamo che diventa più caldo man mano che si scava in profondità, ma possiamo solo stimare quanto sia caldo al centro della terra. Anche a 12 km sottoterra i calcoli degli scienziati erano fuori di oltre il 100% – era più caldo del previsto. Quando si cerca di trivellare a queste profondità, la roccia diventa così calda che diventa plastica e si schiaccia sul foro e inceppa il trapano. Ratti. Così tanto per scavare al centro della terra).
L’acciaio al carbonio
L’acciaio è una lega di ferro (Fe) e carbonio (C), con lo 0,2-2,04% di carbonio in peso. Il carbonio è il materiale di lega più conveniente per il ferro, ma vengono usati vari altri elementi di lega come manganese, cromo, vanadio e tungsteno.
| Acciaio al carbonio | ANSI def’n | Def’n generale | Applicazioni e proprietà |
| Acciaio a basso tenore di carbonio | 0.05-0,15% | <0,1% | Morbido, duttile. Facile da formare. |
| Acciaio dolce | 0,16-0,29% | 0,1-0,25% | Bassa resistenza alla trazione, ma è economico e malleabile; la durezza superficiale può essere aumentata tramite carburazione. |
| Acciaio al carbonio medio | 0,30-0,59% | 0,25-0,45% | Bilancia la duttilità e la forza e ha una buona resistenza all’usura; usato per parti di grandi dimensioni, forgiatura e componenti automobilistici. |
| Acciaio ad alto tenore di carbonio | 0.6-0,99% | 0,45-1,0% | Molto forte, usato per molle e fili ad alta resistenza. |
| Acciaio ad alto tenore di carbonio | 1,0-2,0% | 1,0-1,50% (>1,5% raro) |
Molto duro – coltelli, punzoni. Di solito qualsiasi cosa oltre l’1,2% richiederebbe altre leghe per evitare un’eccessiva fragilità. Un contenuto di carbonio molto alto può essere ottenuto usando la metallurgia delle polveri. |
| Ghisa | – | 2,5-4,0% | Punto di fusione più basso, fusione facile, minore tenacità e forza dell’acciaio. |
Percentuali di carbonio in varie applicazioni dell’acciaio;


Variare la quantità di elementi di lega e il modo in cui sono incorporati nell’acciaio (elementi soluti, fase precipitata) influenza proprietà come durezza, duttilità e resistenza alla trazione dell’acciaio risultante. Con l’aumento del contenuto di carbonio l’acciaio diventa più duro e più forte del ferro, ma anche più fragile. La solubilità massima del carbonio nel ferro (nella regione dell’austenite) è del 2,14% in peso, che si verifica a 1149 °C; concentrazioni più alte di carbonio o temperature più basse produrranno cementite (molto fragile). Aggiungendo altro carbonio si ottiene la ghisa, che ha un punto di fusione più basso ed è più facile da fondere.
Il ferro battuto contiene solo una quantità molto piccola di altri elementi, ma contiene 1-3% in peso di scorie sotto forma di particelle allungate in una direzione, dando al ferro una grana caratteristica. È più resistente alla ruggine dell’acciaio e si salda più facilmente. Oggi è comune parlare di “industria del ferro e dell’acciaio” come se fosse un’unica entità, ma storicamente erano prodotti separati.
L’acciaio è stato prodotto per migliaia di anni, ma è diventato comune dopo che sono stati ideati metodi di produzione più efficienti nel XVII secolo. Il processo Bessemer a metà del 1800 ha reso l’acciaio relativamente poco costoso per la produzione di massa. Ulteriori perfezionamenti nel processo, come la siderurgia a base di ossigeno, abbassarono ulteriormente il costo di produzione aumentando la qualità del metallo. Oggi l’acciaio è uno dei materiali più comuni al mondo ed è uno dei componenti principali di edifici, strumenti, automobili ed elettrodomestici.

Prendi il pdf: XLER_International_Compare.pdf
VIDEO: Proprietà e struttura del grano. BBC 1973
Non ridere per la data – questo video batte tutti quei patetici video moderni che ti danno una bella introduzione ma niente di più di una testa parlante. Non si avventurano mai fuori dallo studio. Questo vecchio video è favoloso per una chiara introduzione alla struttura del grano d’acciaio.
Parte 1: Cos’è un grano? (Video 11MB)
- Le macchie che si vedono su un oggetto galvanizzato sono cristalli o grani di zinco.
- Tutti i metalli sono fatti di grani, ma di solito sono invisibili (troppo piccoli da vedere o dello stesso colore/brillantezza).
- Processo di incisione: Finitura a specchio, acido potente, lavato e sigillato.
- In un metallo puro, i grani sono di colori diversi a causa del modo in cui riflettono la luce.
- Piccoli cristalli crescono verso l’esterno fino ad incontrarsi. Ogni cristallo completamente cresciuto è chiamato grano.
Parte 2: Ricristallizzazione (Video 13MB)
- Prima della lavorazione a freddo i grani sono di forma e dimensioni simili
- La lavorazione a freddo allunga i grani, aumenta la durezza e la resistenza, riduce la duttilità.
- A 350C, nuovi grani si formano nell’Al per sostituire quelli vecchi. Chiamata ricristallizzazione
- La ricristallizzazione ammorbidisce, abbassa la resistenza, aumenta la duttilità
- Un’eccessiva temperatura di ricristallizzazione dà scarse proprietà meccaniche
Parte 3: Trattamento termico dell’acciaio (Video 23MB)
- I grani dell’acciaio sono troppo piccoli per essere visibili – serve un microscopio con un ingrandimento di circa 250 volte.
- Ferrite: Di colore chiaro. Fatto di ferro. Duttilità all’acciaio
- Perlite: di colore più scuro. Strati di ferro + carburo di ferro. Durezza e resistenza all’acciaio
- 100% Pearlite è circa 0,8%C. Pearlite, temperatura di ricristallizzazione 720C.
- Normalizzazione – raffreddato in aria, granulometria ridotta e forma più uniforme, tenacità aumentata
- Tempra – aumenta la durezza. Non c’è abbastanza tempo per la formazione della perlite, quindi si forma una struttura aghiforme – martensite. Molto duro e fragile.
- Tempra – (dopo la tempra) ripristina la durezza. Modifica gli aghi di martensite con piccole scaglie di carbonio. Questo dà durezza E tenacità.
- Acciaio 0,1%C (acciaio dolce). Ricristallizzazione 900C. Non abbastanza carbonio per produrre martensite.
Diagramma di equilibrio ferro-carbonio
Ottimo link (Cambridge University): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Un diagramma di equilibrio è un grafico delle diverse disposizioni strutturali che si verificano all’interno di un intervallo di un elemento di lega.
Questo diagramma mostra come il ferro e il carbonio si combinano SE viene raffreddato lentamente (in equilibrio). Sotto il 2% è acciaio, oltre il 2% si va verso la gamma di ghisa dove il carbonio tende a coagulare (raggrupparsi). La cementite Fe3C ha il 6,67% di carbonio ed è fondamentalmente una ceramica. L’eutettoide (perlite) a E ha 0,83% C, meno carbonio è un acciaio ipoeutettoide (A), e maggiore è ipereutettoide (B). Ferro alfa (ferrite), ferro gamma (austenite, che esiste solo ad alta temperatura) e ferro delta (un’altra struttura ad alta temperatura).
Due cambiamenti di fase molto importanti avvengono a 0,83%C e a 4,3% C. A 0,83%C e 723ºC, la trasformazione è eutettoide, chiamata perlite. Queste 2 fasi si separano in strati. Da gamma (austenite) –> alfa + Fe3C (cementite)
Al 4,3% C e 1130ºC, la trasformazione è eutettica, chiamata ledeburite. L(liquido) –> gamma (austenite) + Fe3C (cementite). Questa è la ghisa.
BTW. Poiché il carbonio (12) è molto più leggero del Fe (56), la % atomica effettiva di carbonio (contando gli atomi) è in realtà circa 4,6 volte più alta della %C in peso. Quindi non è così sorprendente, vero? Voglio dire, come lo 0,5% di carbonio può trasformare totalmente il ferro dolce… in realtà è circa il 2% se si contano gli atomi – non la massa.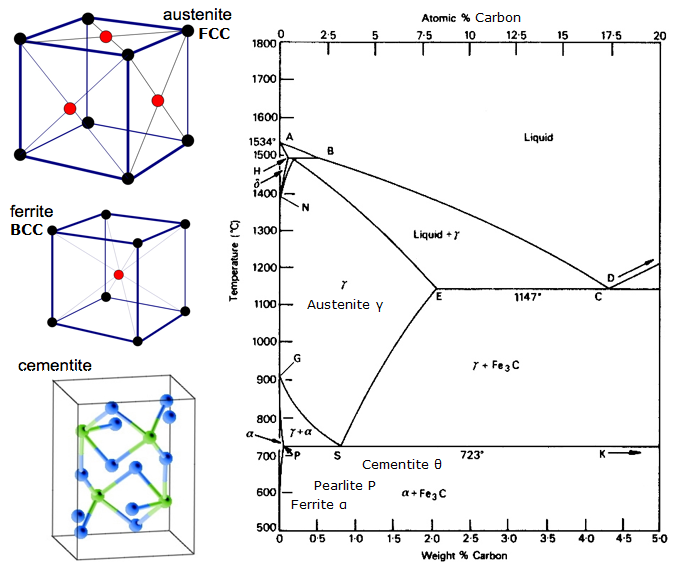
Sommario delle strutture Fe-C (grani)
- Austenite (ferro γ). Esiste solo al di sopra di 723C, che è quando la struttura FCC γ-ferro si verifica. Può dissolversi fino al 2,1%C di massa. Non magnetico, morbido (da qui la lavorazione a caldo). L’austenite può esistere anche a temperatura ambiente se si scambiano alcuni atomi di ferro con qualcos’altro – come il nichel. Questo è ciò che è l’acciaio inossidabile austenitico – come il 316 per esempio. E, come l’austenite ad alta temperatura, questi acciai inossidabili non sono magnetici. Alcuni altri tipi di acciaio inossidabile sono magnetici.
- Cementite (carburo di ferro Fe3C, 6,67%C in massa. Ci sono dodici atomi di ferro e quattro atomi di carbonio per cella unitaria, quindi 33% di atomi di carbonio). Molto duro e fragile perché è una ceramica. Hai mai sentito parlare del carburo di tungsteno? Bene, questo è Carburo di Ferro.
- Ledeburite (L’eutettico Ferrite-Cementite, 4,3% di carbonio.)
- Ferrite (α-ferro, δ-ferro; morbido). Senza carbonio, BCC. Morbido e duttile.
- Perlite (88% ferrite, 12% cementite, che è 0,83%C) Più forte della ferrite
- Martensite. Si verifica quando il raffreddamento è troppo rapido per formare la perlite, quindi blocca picchi di cementite nel grano. Questo si verifica con l’indurimento per tempra dell’acciaio con abbastanza carbonio. Molto duro.
Micrografie (foto da un microscopio).
(A) = 0.1%C ferrite/perlite, (B) = 0.25%C più perlite, (C) = 0.83%C tutta perlite, (D) = 1.4%C perlite/cementite
Vista ravvicinata della perlite che mostra strati di ferrite (bianca) e cementite (scura).
Altro sulla perlite: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Diagramma di equilibrio FC grande

Versione grande di stampa 2000x2658px
Slip
Quando un pezzo di metallo si deforma, sono i grani che si deformano. Un grano è un cristallo, una disposizione ordinata di atomi in una griglia. Se gli atomi vengono allungati, si tratta di una deformazione elastica perché gli atomi sono tenuti insieme dall’attrazione degli elettroni – che agisce come una molla. Tuttavia, la deformazione permanente (o plastica) significa che gli atomi scivolano effettivamente l’uno sull’altro in strati o piani.
I cristalli reali non scivolano in un intero piano in una volta sola. Questo richiederebbe una forza molto elevata. Invece, le imperfezioni nel cristallo permettono allo slittamento di viaggiare un atomo alla volta. Più ampia è la gamma di atomi interessati, più duttile (scivola facilmente) è il grano. Ecco un esempio di un’imperfezione chiamata dislocazione che può viaggiare facilmente attraverso il cristallo.
Ecco un esempio reale di slittamento. (non ce lo stiamo inventando!)
Una micrografia elettronica a scansione di un singolo cristallo di cadmio che si deforma per slittamento delle dislocazioni su 100 piani, formando gradini
sulla superficie.
La seguente animazione mostra un reticolo di atomi (come in un metallo). Ci sono solo 2 modi per distorcere gli atomi – assiale (tensione e compressione) e taglio (lateralmente).
Questa animazione mostra solo la parte elastica della curva sforzo/deformazione, dove non si verifica alcuno slittamento atomico.
Il contenuto di questa pagina richiede una versione più recente di Adobe Flash Player.

Altre informazioni qui: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
Cos’è BCC e FCC?
Le strutture cristalline BCC (Body Centred Cubic) e FCC (Face Centred Cubic) sono due modi alternativi di impacchettare gli atomi di ferro.
- BCC è la disposizione a temperatura ambiente chiamata Ferrite
- FCC è la disposizione ad alta temperatura (>723oC) chiamata Austenite.
Scarica i file di Inventor: SC, BCC, FCC, Tutti e tre (SC+BCC+FCC)
![]()
SC è Cubico Semplice e non si verifica con atomi di Ferro. Questo è il reticolo del sale – NaCl.
La disposizione più piccola (unità) è mostrata sotto. Notate come il reticolo cubico (colorato in blu) si sta espandendo mentre gli altri atomi sono inseriti tra di loro nei reticoli BCC e FCC.
![]()
C’è spesso confusione su questi diagrammi qui sotto.

Il problema è che gli atomi rossi sembrano carbonio e quelli neri sembrano ferro. No, no, no!
Ogni atomo è di ferro! Abbiamo solo colorato gli atomi di ferro che non sono sugli angoli per renderli facili da vedere.
L’altro problema con questi diagrammi è che non c’è alcuna indicazione reale che la spaziatura degli atomi d’angolo AUMENTA man mano che si passa da SC a BCC a FCC.
Struttura SC (cubica semplice). NON IRONCon una struttura SC (Simple Cubic) (che il ferro non fa), la distanza tra gli atomi è D. (Dove D è il diametro degli atomi) Quindi il volume di questa unità è D3, e il volume dell’atomo è 4/3Πr3. Quindi la densità è il 52% dell’atomo solido. Non molto compatto. |
 |
Struttura BCC (Body Centred Cubic). FERRITECon una struttura BCC (Body Centred Cubic) (che il ferro fa sotto 723oC), la distanza tra gli atomi di ferro è 1,1547D. (Dove D è il diametro degli atomi) Quindi il volume di questa unità è (1,1547D)3, e questo si adatta a 2 atomi quindi il volume degli atomi è 2×4/3Πr3. Quindi la densità è il 68% dell’atomo solido. Più compatto. Questa struttura è chiamata Ferrite. Il carbonio non si adatta affatto a questa struttura (Beh, dico una bugia. Può sciogliere un patetico 0,025% di C, che è praticamente zero, o lo 0,035% alla temperatura di transizione, che è ancora niente) |
 |
Struttura FCC (Face Centred Cubic). AUSTENITECon una struttura FCC (Face Centred Cubic) (che il ferro fa oltre 723oC), la distanza tra gli atomi di ferro è 1,4214D. (Dove D è il diametro degli atomi) Quindi il volume di questa unità è (1,4214D)3, e questo si adatta a 4 atomi quindi il volume degli atomi è 4×4/3Πr3. Quindi la densità è il 74% dell’atomo solido. Questo è il più compatto, rendendolo il 6% più denso della Ferrite! Questa struttura è chiamata Austenite, e può dissolvere il 2% di carbonio nella sua struttura. Questo è il 2% in peso, non dimenticarlo, e poiché il ferro (56) è 4,7 volte il peso del carbonio (12), può dissolvere circa il 21% di atomi di carbonio (circa 1 carbonio ogni 5 atomi di ferro). |
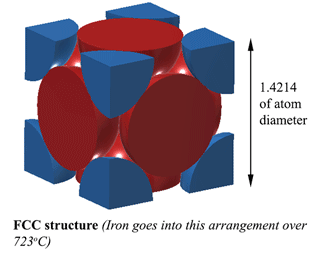 |
Dove si trova il carbonio nell’austenite?Il carbonio può stare proprio in quello spazio al centro di ogni bordo unitario. Tuttavia, questo causa un po’ di distorsione, quindi non è possibile inserire un atomo di carbonio su OGNI bordo. Al meglio, a 1130oC l’austenite può inserire poco più di 2 atomi di carbonio ogni 3 unità. (2C:12Fe o 1:6 per atomi). Ecco da dove viene il 2% in peso. Più qui (abbastanza pesante) https://hal.archives-ouvertes.fr/jpa-00246587/document |
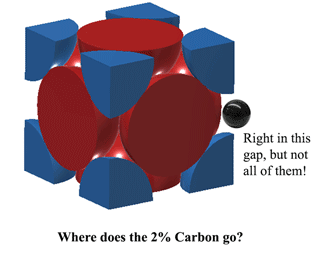 |
Più informazioni su BCC e FCC qui:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Video delle strutture cristalline Simple Cubic, Body-Centred Cubic e Face Centred Cubic. Gli atomi di ferro non formano il cubico semplice.
Cubico semplice, cubico centrato sul corpo e cubico centrato sulla faccia
Indurimento dell’acciaio
L’indurimento consiste nell’impedire lo scorrimento
Ci sono 3 modi per farlo.
- Eliminare tutte le imperfezioni (compito piuttosto impossibile, anche se questo è il motivo per cui le fibre molto sottili possono dare una resistenza pazzesca)
- Utilizzare tutti gli slittamenti in modo che non possano più verificarsi. Questo si chiama indurimento da lavoro.
- Impedire allo slittamento di percorrere tutta la strada attraverso i grani. Il carbonio (e l’azoto) formano composti che agiscono come un agente indurente, impedendo alle dislocazioni nel reticolo cristallino del ferro (Ferrite) di scivolare l’una sull’altra. La martensite fa questo meravigliosamente. Questo è l’indurimento da trattamento termico.
La tempra dell’acciaio non è mostrata sul diagramma di equilibrio Fe-C, perché la tempra non è in equilibrio! (cioè il raffreddamento è troppo veloce perché l’austenite con il carbonio al suo interno si trasformi nella complicata struttura della perlite.

Da https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Il rapido raffreddamento (quenching) produce una diversa struttura del grano chiamata martensite. Questo grano è estremamente duro e forte, e fragile. Le punte di carburo di ferro che penetrano attraverso il grano ora impediscono lo scorrimento, quindi la duttilità è persa.

Martensite: Università di Cambridge
Per ridurre la fragilità dopo la tempra, si usa il rinvenimento per aggiungere tenacità all’acciaio. Questo modifica i dendriti di carburo per dare loro un po’ di duttilità – senza perdere troppa forza e durezza.
Il rinvenimento deve avvenire a una temperatura inferiore alla ricristallizzazione. Un forno è il migliore per la tempra, ma può essere fatta alla fiamma giudicando il colore dell’acciaio. I colori di rinvenimento possono essere usati come guida per la temperatura. Più caldo è il rinvenimento, più morbido è l’acciaio.
Le leghe come l’acciaio inossidabile formano film più sottili degli acciai al carbonio per una data temperatura e quindi producono un colore più basso nella serie. Per esempio, il paglierino pallido corrisponde a 300°C per SS, invece di 230°C per CS. I colori più freddi dei rossi (sotto i 500°C) sono in realtà la decolorazione degli ossidi, non l’effettivo bagliore di radiazione della temperatura stessa. (Che sarebbe infrarosso, e invisibile. Quindi tutto è incandescente, solo che non puoi vedere la luce!)
| Colore di radiazione | Celcius | Farenht | Applicazioni di tempera / Altro |
| Giallo-Bianco | 1539°C | 2800°F | Punto di fusione più alto (ferro puro 0%C) |
| Giallo vivo | 1130°C | 2066°F | Punto di fusione più basso (ghisa 4%C) |
| Giallo | 1093°C | 2000°F | Il rame fonde a 1084°C, Oro 1063°C |
| Giallo scuro | 1038°C | 1900°F | |
| Giallo arancio | 982°C | 1800°F | |
| Arancio | 927°C | 1700°F | L’ottone fonde 930°C |
| Arancio rosso | 871°C | 1600°F | |
| Rosso vivo | 816°C | 1500°F | |
| Rosso | 760°C | 1400°F | Temperatura di ricristallizzazione dell’acciaio 723°C |
| Rosso medio | 704°C | 1300°F | |
| Rosso opaco | 649°C | 1200°F | L’alluminio fonde 600-660°C |
| Rosso chiaro | 593°C | 1100°F | Indurimento per acciai da costruzione. |
| Rosso molto leggero, prevalentemente grigio | 538°C | 1000°F | Indurimento per acciai da costruzione. |
| Grigio scuro | 427°C | 0800°F | Indurimento per acciai da costruzione. Cambio magnetico 410 |
| Colore di ossidazione | Celcius | Farenht | Applicazioni di tempera |
| Blu | 302°C | 0575°F | Seghe per legno, molle |
| viola scuro | 282°C | 0540°F | scalpelli a freddo, setts per acciaio |
| Viola | 271°C | 0520°F | Utensili da stampa, assi |
| marrone/viola | 260°C | 0500°F | Punzoni, tazze, schiocchi, trapani a torsione, alesatori |
| Marrone | 249°C | 0480°F | Tappe, lame per metalli |
| Paglia scura | 241°C | 0465°F | Frese, punte |
| Paglia chiara | 229°C | 0445°F | Utensili per piallare e scanalare |
| Paglia chiara | 199°C | 0390°F |
Tempra:
Velocità di tempra: Gli acciai ad alto tenore di carbonio possono essere temprati più lentamente, ma un acciaio a basso tenore di carbonio dovrà essere temprato rapidamente per avere qualche effetto di indurimento.
Velocità di tempra: (PIÙ VELOCE) Acqua salata > acqua > olio > aria > isolato. (SLOWEST)
Per un lavoro complesso e costoso, è meglio avere una lega a tempra lenta perché è meno sensibile alle variazioni di temperatura. Questo è il motivo per cui la maggior parte degli acciai per utensili come quelli per lo stampaggio a iniezione sono temprati ad OLIO. La tempra ad acqua va bene per forme semplici che possono essere controllate più facilmente, ma può causare cricche su sezioni più spesse perché la superficie si restringe prima dell’interno.
Induzione. Tempra a induzione in cui l’induzione elettrica (rapidi cambiamenti magnetici) riscalda l’acciaio che è rapidamente seguito da una tempra in getto d’acqua. Modo alternativo di riscaldamento al posto della fiamma o del forno.

Tempra a induzione. http://www.thermobondflame.com/Services.page?i=4
Come indurire la superficie: Indurimento CASE.
Trattare con il calore = estinguere > Martensite (arresta lo slittamento).
Riscaldare la superficie esterna > estinguere. Fiamma locale o induzione temprata con acqua (ingranaggi).
Carbonio che penetra nella superficie esterna > tempra. Carburazione (riscaldamento in impacco di carbonio o gas di carbonio o soluzioni riscaldate). La nitrurazione usa l’azoto al posto del carbonio per avere un effetto simile, ed è più facile farlo penetrare nella superficie.

Indurimento alla fiamma del rotolo di acciaio.: http://www.thermobondflame.com/Services.page?i=2
Acciai legati
Effetti degli elementi di lega sulle proprietà dell’acciaio per utensili: (Molto approssimativamente)
- Carbonio: L’aumento del contenuto di carbonio aumenta leggermente la durezza e la resistenza all’usura in modo considerevole. Aumenti drammatici della durezza & della resistenza al trattamento termico.
- Manganese: Piccole quantità di manganese riducono la fragilità e migliorano la forgiatura. Quantità più grandi di manganese migliorano la temprabilità, permettono la tempra ad olio (queching meno severo richiesto – che riduce la deformazione da tempra).
- Silicio: Migliora la forza, la tenacità e la resistenza agli urti.
- Tungsteno: Migliora la “durezza a caldo” – usato nell’acciaio per utensili ad alta velocità. Molto denso (pesante)
- Vanadio: Raffina la struttura del carburo e migliora la forgiatura, migliorando anche la durezza e la resistenza all’usura.
- Molibdeno: Migliora la tempra profonda, la tenacità e, in quantità maggiori, la “durezza a caldo”. Usato nell’acciaio per utensili ad alta velocità perché è più economico del tungsteno.
- Cromo: migliora la temprabilità, la resistenza all’usura e la tenacità.
- Nichel: Migliora la tenacità e la resistenza all’usura in misura minore.
Includere questi elementi in varie combinazioni può agire sinergicamente, aumentando gli effetti del loro utilizzo da soli. (Per esempio, gli elementi di lega cetain possono permettere più carbonio, dove così tanto carbonio sarebbe impraticabile in un acciaio al carbonio semplice). Un altro esempio è l’interessante modo in cui l’acciaio inossidabile (cromo e nichel aggiunti al ferro) è abbastanza resistente alla corrosione.
Codici di identificazione degli acciai
Sistema di codifica AISI-SAE (American Iraon and Steel Institute – Society of Automotive Engineers). Un codice a 4 cifre, le prime 2 cifre danno il tipo di acciaio generale, e le ultime 2 cifre sono la % di carbonio x 100. Per esempio, 1010 è un acciaio al carbonio semplice con 0,10% C, 5120 è un acciaio al cromo con 0,20% C. Maggiori dettagli qui

Codici americani dell’acciaio: Da Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p21
La BSA (British Standards Association) usa un codice a 6 cifre. Le cifre sono separate in 3 gruppi come mostrato sotto. Per esempio, un acciaio con il codice 070M20 sarebbe 070 = acciaio al carbonio o al carbonio-manganese, M = specifica delle proprietà meccaniche, 20 = contenuto di carbonio 0,20%.

Codici British Steel: Da Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p20
Il numero UNS (abbreviazione di “Unified Numbering System for Metals and Alloys”) è uno schema sistematico in cui ogni metallo è designato da una lettera seguita da cinque numeri. È un sistema basato sulla composizione dei materiali commerciali e non garantisce alcuna specifica di prestazione o composizione esatta con limiti di impurità. Altri sistemi di nomenclatura sono stati incorporati nel sistema di numerazione UNS per minimizzare la confusione. Per esempio, l’alluminio 6061 (AA6061) diventa UNS A96061. Di seguito è riportata una panoramica del sistema UNS, con particolare attenzione alle leghe commerciali comuni. Come con qualsiasi sistema, ci sono ambiguità come la distinzione tra una superlega a base di nichel e un acciaio inossidabile ad alto contenuto di nichel.
-Axxxxx – Leghe di alluminio
-Cxxxxx – Leghe di rame, inclusi ottone e bronzo
-Fxxxxx – Ferro, compresi i ferri duttili e le ghise
-Gxxxxx – Acciai al carbonio e legati
-Hxxxxx – Acciai – Acciai AISI H
-Jxxxxx – Acciai – Fusi
-Kxxxxx – Acciai, compresi Maraging, Acciaio inossidabile, HSLA, Superleghe a base di ferro
-L5xxxx – Leghe di piombo, comprese leghe Babbit e leghe per saldatura
-M1xxxx – Leghe di magnesio
-Nxxxxx – Leghe di nichel
-Rxxxxx – Leghe refrattarie ◦R03xxx- Leghe di molibdeno ◦R04xxx- Leghe di niobio (colombio) ◦R05xxx- Leghe di tantalio ◦R3xxxx- Leghe di cobalto ◦R5xxxx- Leghe di titanio ◦R6xxxx- Leghe di zirconio
-Sxxxxx – Acciai inox, compresi gli acciai inossidabili indurenti per precipitazione e le superleghe a base di ferro
-Txxxxx – Acciai per utensili
-Zxxxxx – Leghe di zinco
Acciai per utensili
Gli acciai per utensili sono coperti dallo standard australiano AS1239 ed è praticamente lo stesso della classificazione americana degli acciai per utensili AISI. (Analogamente al British Standard 4659)
Per esempio: L’acciaio per utensili a caldo AS 1239 grado H13 contenente 0,35% di carbonio, 5,0% di cromo, 1,5% di molibdeno e 1% di vanadio sarebbe scritto come X40CrMoV51 in DIN (tedesco). Acciai ad alta velocità, per esempio: AS 1239 grado M2 contenente 0,85% di carbonio, 4,0% di cromo, 5,0% di molibdeno, 6,0% di tungsteno, 2,0% di vanadio sarebbe scritto come S 6-5-2 in DIN.
Selettore di acciai
Dimensione grande (400kB): steel_types_large.jpg
Dimensione stampabile (1.7MB): steel_types_fullsize.jpg
Gradi di acciaio comuni in Australia (Edcon)
Fusione di ghisa
Quando si aggiunge troppo carbonio all’acciaio, il carbonio non può dissolversi nella soluzione e crea una struttura completamente diversa. Dal diagramma Fe-C che abbiamo visto prima, la ghisa si forma tra il 2% e il 7% di carbonio (in peso).
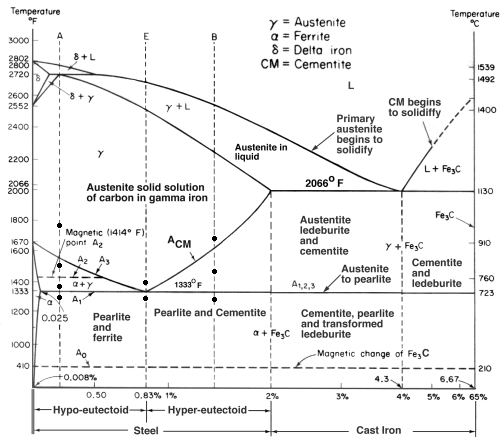
Ci sono molti tipi di ghisa, ma la ghisa grigia è la più familiare, spesso usata per le basi delle macchine utensili. È utile e popolare per diverse ragioni.
In primo luogo, la temperatura di fusione è più bassa, il che rende più facile la fusione. Questo perché l’eutettico è al 4,3% C, dando un punto di fusione di soli 1147oC. Questa eutettica produce un nuovo grano chiamato ledeburite, che è una miscela di austenite e cementite. (Ricordate la perlite? Era un eutettoide ed era composto da strati di ferrite e cementite). Ma poiché un eutettoide è un punto basso nella transizione liquido-solido, è il punto di fusione.
In secondo luogo, la ghisa grigia è ottima per le basi delle macchine. Normalmente, così tanto carbonio sarebbe un incubo di fragilità dovuto all’estrema martensite e cementite. Ma si scopre che con il giusto raffreddamento, il carbonio in eccesso forma scaglie di grafite. Questo è completamente diverso da tutti questi grani di Fe-C di cui abbiamo parlato – come Ferrite e Cementite e Pearlite e Ledeburite. Invece, la grafite è come un’inclusione nel metallo, e dà alla ghisa grigia le proprietà di smorzamento adatte alle basi delle macchine. Si tratta comunque di un materiale con una bassa resistenza alla trazione, quindi la GCI è di solito usata dove è in compressione. La ghisa grigia è incline a indurirsi a causa del calore in eccesso, quindi non è facile da saldare. Più spesso verrebbe brasato, ma anche questo è un po’ difficile rispetto alla giunzione dell’acciaio.

Foto micrografia della ghisa grigia che mostra fiocchi di grafite in una matrice di ferrite. Fonte
| Nome | Composizione nominale | Forma e condizione | Resistenza allo snervamento | Resistenza alla trazione | Allungamento | Durezza | Usi |
|---|---|---|---|---|---|---|---|
| Grigio ghisa (ASTM A48) | C 3.4, Si 1.8, Mn 0.5 | Fusione | – | 50 | 0,5 | 260 | Basamenti di cilindri di motori, volani, ingranaggi, basi di macchine utensili |
| Ghisa bianca | C 3.4, Si 0,7, Mn 0,6 | Fusione (come colata) | – | 25 | 0 | 450 | Superfici cuscinetto |
| Ferro malleabile (ASTM A47) | C 2.5, Si 1.0, Mn 0.55 | Fusione (ricotto) | 33 | 52 | 12 | 130 | Cuscinetti dell’asse, ruote motrici, alberi a gomito automobilistici |
| Giro duttile o nodulare | C 3.4, P 0.1, Mn 0.4, Ni 1.0, Mg 0.06 | Fusione | 53 | 70 | 18 | 170 | Cambio, albero a camme, albero motore |
| Ni-hard tipo 2 | C 2.7, Si 0.6, Mn 0.5, Ni 4.5, Cr 2.0 | Sand-cast | – | 55 | – | 550 | Applicazioni ad alta resistenza |
Glossario
- Lega: Una sostanza metallica composta da due o più elementi.
- Austenite: Ferro cubico a facce centrate o una lega di ferro basata su questa struttura.
- Bainite: Il prodotto della trasformazione finale della decomposizione dell’austenite.
- Corpo centrato: Una struttura in cui ogni atomo è circondato da otto atomi adiacenti, sia che l’atomo si trovi in un angolo o al centro di una cella unitaria.
- Cementite: La seconda fase che si forma quando il carbonio supera il limite di solubilità.
- Punto critico: Punto in cui le densità del liquido e del vapore diventano uguali e l’interfaccia tra i due scompare. Al di sopra di questo punto, può esistere solo una fase.
- Delta ferro: La fase cubica a corpo centrato che risulta quando l’austenite non è più la forma più stabile del ferro. Esiste tra 2802 e 2552 gradi F, ha una struttura reticolare BCC ed è magnetica.
- Eutettico: Un sistema eutettico si verifica quando una fase liquida si trasforma direttamente in un solido bifase.
- Eutettoide: Un sistema eutettoide si verifica quando un solido monofase si trasforma direttamente in un solido bifase.
- Face-centered: Una struttura in cui c’è un atomo all’angolo di ogni cella unitaria e uno al centro di ogni faccia, ma nessun atomo al centro del cubo.
- Ferrite: Ferro cubico a corpo centrato o una lega di ferro basata su questa struttura.
- Perlite fine: Risultati di lamelle sottili quando la velocità di raffreddamento è accelerata e la diffusione è limitata a distanze più brevi.
- Ipereutettoide: I sistemi ipereutettoidi esistono al di sotto della temperatura eutettoide.
- Hypoeutectoid: I sistemi Hypoeutectoid esistono al di sopra della temperatura eutectoide.
- Ledeburite: Eutettico della ghisa. Esiste quando il contenuto di carbonio è superiore al 2%. Contiene il 4,3% di carbonio in combinazione con il ferro.
- Linea di Liquido: Su un diagramma di fase binaria, quella linea o confine che separa le regioni di fase liquida e liquida + solida. Per una lega, la temperatura liquidus è quella temperatura alla quale si forma per la prima volta una fase solida in condizioni di raffreddamento di equilibrio.
- Martensite: Una fase polimorfica instabile del ferro che si forma a temperature inferiori all’eutettoide perché la struttura cubica a facce centrate dell’austenite diventa instabile. Cambia spontaneamente in una struttura centrata sul corpo per azione di taglio, non per diffusione.
- Microstruttura: Struttura delle fasi in un materiale. Può essere vista solo con un mircoscopio ottico o elettronico.
- Pearlite: Una miscela lamellare di ferrite e carburo formata dalla decomposizione dell’austenite di composizione eutettoide.
- Fase: Una porzione omogenea di un sistema che ha caratteristiche fisiche e chimiche uniformi.
- Diagramma di fase: Una rappresentazione grafica delle relazioni tra i vincoli ambientali, la composizione e le regioni di stabilità di fase, normalmente in condizioni di equilibrio.
- Polimorfo: La capacità di un materiale solido di esistere in più di una forma o struttura cristallina.
- Quench: Raffreddare rapidamente – di solito quando è troppo veloce per formare la perlite, creando invece la martensite
- Linea di consolidamento: Su un diagramma di fase, il luogo dei punti in cui la solidificazione è completa dopo un raffreddamento di equilibrio, o in cui inizia la fusione dopo un riscaldamento di equilibrio.
- Solubilità: La quantità di sostanza che si dissolve in una data quantità di un’altra sostanza.
DVD:
Assegnazione:
Trattamento del calore

Domande:
Assegnazione: