Stahl ist der wichtigste technische Werkstoff. Die Härtung von Stahl ist sehr wichtig.
Vorlesungsvideos
![]() Stahl gegen Stahl
Stahl gegen Stahl
(Ungekürztes Filmmaterial)
![]() Stahl: Teil 1 ,
Stahl: Teil 1 , ![]() Stahl: Teil 2 ,
Stahl: Teil 2 , ![]() Steel: Teil 3
Steel: Teil 3
![]() Eigenschaften und Kornstruktur: BBC 1973 (alt, aber sehr gut)
Eigenschaften und Kornstruktur: BBC 1973 (alt, aber sehr gut)
Eisen ist im Universum reichlich vorhanden und kommt in der Sonne und vielen Arten von Sternen in beträchtlicher Menge vor. Man nimmt an, dass der Kern der Erde aus Nickel und Eisen besteht und heißer ist als die Oberfläche der Sonne. Diese intensive Hitze des inneren Kerns bewirkt, dass sich Material im äußeren Kern und im Erdmantel bewegt (Konvektionsströme).
(Anmerkung: Komisch, dass wir das nicht wirklich wissen, oder? – Wir wissen, dass es heißer wird, je tiefer man gräbt, aber wir können nur schätzen, wie heiß es im Zentrum der Erde ist. Selbst in 12 km Tiefe lagen die Berechnungen der Wissenschaftler um mehr als 100 % daneben – es war heißer als erwartet. Wenn man versucht, in diese Tiefen zu bohren, wird das Gestein so heiß, dass es plastisch wird und sich auf das Loch zurückdrückt und den Bohrer blockiert. Ratten. So viel zum Graben bis zum Mittelpunkt der Erde).
Kohlenstoffstahl
Stahl ist eine Legierung aus Eisen (Fe) und Kohlenstoff (C) mit 0,2 bis 2,04 Gewichtsprozent Kohlenstoff. Kohlenstoff ist der kostengünstigste Legierungsstoff für Eisen, aber es werden auch verschiedene andere Legierungselemente wie Mangan, Chrom, Vanadium und Wolfram verwendet.
| Kohlenstoffstahl | ANSI def’n | Allgemeine Def’n | Anwendungen und Eigenschaften |
| Stahl mit niedrigem Kohlenstoffgehalt | 0.05-0,15% | <0,1% | Weich, dehnbar. Leicht zu formen. |
| Mildstahl | 0,16-0,29% | 0,1-0,25% | Geringe Zugfestigkeit, aber billig und verformbar; Oberflächenhärte kann durch Aufkohlen erhöht werden. |
| Stahl mit mittlerem Kohlenstoffgehalt | 0,30-0,59% | 0,25-0,45% | Gleichgewicht zwischen Duktilität und Festigkeit und gute Verschleißfestigkeit; wird für große Teile, Schmiedestücke und Automobilkomponenten verwendet. |
| Stahl mit hohem Kohlenstoffgehalt | 0.6-0,99% | 0,45-1,0% | Sehr stark, wird für Federn und hochfeste Drähte verwendet. |
| Ultrahochgekohlter Stahl | 1,0-2,0% | 1,0-1,50% (>1,5% selten) |
Sehr hart – Messer, Stanzen. Bei mehr als 1,2 % sind normalerweise andere Legierungen erforderlich, um eine übermäßige Sprödigkeit zu verhindern. Ein sehr hoher Kohlenstoffgehalt kann durch Pulvermetallurgie erreicht werden. |
| Gusseisen | – | 2,5-4,0% | Niedrigerer Schmelzpunkt, leicht zu gießen, geringere Zähigkeit und Festigkeit als Stahl. |
Kohlenstoffanteile in verschiedenen Stahlanwendungen;


Die Menge der Legierungselemente und die Art und Weise, wie sie in den Stahl eingebaut werden (gelöste Elemente, ausgeschiedene Phase), beeinflusst Eigenschaften wie Härte, Duktilität und Zugfestigkeit des resultierenden Stahls. Mit steigendem Kohlenstoffgehalt wird der Stahl härter und fester als Eisen, aber auch spröder. Die maximale Löslichkeit von Kohlenstoff in Eisen (im Austenitbereich) liegt bei 2,14 Gewichtsprozent und tritt bei 1149 °C auf; bei höheren Kohlenstoffkonzentrationen oder niedrigeren Temperaturen entsteht Zementit (sehr spröde). Wenn man mehr Kohlenstoff hinzufügt, erhält man Gusseisen, das einen niedrigeren Schmelzpunkt hat und leichter zu gießen ist.
Schmiedeeisen enthält nur eine sehr geringe Menge anderer Elemente, dafür aber 1 bis 3 Gewichtsprozent Schlacke in Form von in einer Richtung verlängerten Partikeln, die dem Eisen ein charakteristisches Korn verleihen. Es ist rostbeständiger als Stahl und lässt sich leichter schweißen. Es ist heute üblich, von „Eisen- und Stahlindustrie“ zu sprechen, als ob es sich um eine einzige Einheit handelte, aber historisch gesehen waren es getrennte Produkte.
Stahl wird seit Tausenden von Jahren hergestellt, wurde aber erst nach der Entwicklung effizienterer Produktionsmethoden im 17. Jahrhundert üblich. Durch das Bessemer-Verfahren Mitte des 19. Jahrhunderts wurde Stahl für die Massenproduktion relativ preiswert. Weitere Verfeinerungen des Verfahrens, wie z. B. die Herstellung von Stahl mit Sauerstoff, führten zu einer weiteren Senkung der Produktionskosten bei gleichzeitiger Verbesserung der Qualität des Metalls. Heute ist Stahl einer der meistverwendeten Werkstoffe der Welt und ein wichtiger Bestandteil von Gebäuden, Werkzeugen, Automobilen und Geräten.

Get pdf: XLER_International_Compare.pdf
VIDEO: Eigenschaften und Kornstruktur. BBC 1973
Lachen Sie nicht über das Datum – dieses Video übertrifft all diese erbärmlichen modernen Videos, die Ihnen ein schickes Intro, aber nicht mehr als einen sprechenden Kopf bieten. Sie wagen sich nie aus dem Studio heraus. Dieses alte Video ist fabelhaft für eine klare Einführung in die Stahlkornstruktur.
Teil 1: Was ist ein Korn? (Video 11MB)
- Die Flecken, die man auf einem verzinkten Gegenstand sieht, sind Kristalle oder Körner aus Zink.
- Alle Metalle bestehen aus Körnern, aber sie sind normalerweise unsichtbar (zu klein, um sie zu sehen, oder der gleiche Glanz/Farbe).
- Ätzverfahren: Spiegelglanz, starke Säure, gewaschen und versiegelt.
- In einem reinen Metall haben die Körner verschiedene Farben, weil sie das Licht reflektieren.
- Winzige Kristalle wachsen nach außen, bis sie sich treffen. Jeder ausgewachsene Kristall wird als Korn bezeichnet.
Teil 2: Rekristallisation (Video 13MB)
- Vor der Kaltverformung haben die Körner eine ähnliche Größe und Form
- Durch die Kaltverformung werden die Körner gestreckt, die Härte und Festigkeit nimmt zu, die Duktilität ab.
- Bei 350C bilden sich neue Körner im Al, die alte Körner ersetzen. Das nennt man Rekristallisation
- Rekristallisation macht weich, senkt die Festigkeit, erhöht die Duktilität
- Eine zu hohe Rekristallisationszeit führt zu schlechten mechanischen Eigenschaften
Teil 3: Wärmebehandlung von Stahl (Video 23MB)
- Stahlkörner sind zu klein, um sichtbar zu sein – man braucht ein Mikroskop mit ca. 250-facher Vergrößerung.
- Ferrit: Hell gefärbt. Hergestellt aus Eisen. Duktilität zum Stahl
- Perlit: dunkler gefärbt. Schichten aus Eisen + Eisenkarbid. Härte und Festigkeit gegenüber dem Stahl
- 100% Perlit beträgt etwa 0,8%C. Perlit, Rekristallisationstemperatur 720C.
- Normalisieren – Abkühlung an der Luft, reduzierte Korngröße und gleichmäßigere Form, erhöhte Zähigkeit
- Abschrecken – erhöht die Härte. Nicht genug Zeit für die Bildung von Perlit, daher bildet sich ein nadelförmiges Gefüge – Martensit. Sehr hart und spröde.
- Anlassen – (nach dem Abschrecken) stellt die Zähigkeit wieder her. Modifiziert die Martensitnadeln mit kleinen Kohlenstoffflocken. Dies verleiht Härte UND Zähigkeit.
- 0,1%C Stahl (Baustahl). Rekristallisation 900C. Nicht genug Kohlenstoff, um Martensit zu erzeugen.
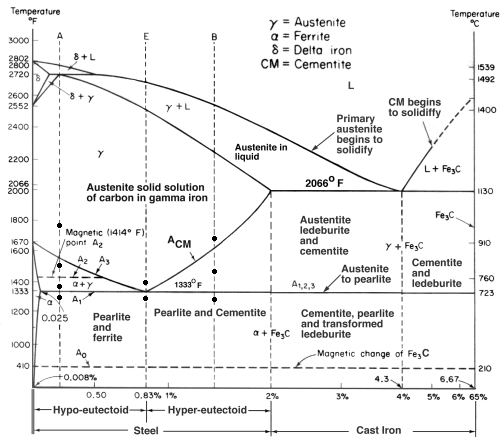
Eisen-Kohlenstoff-Gleichgewichtsdiagramm
Ausgezeichneter Link (Cambridge University): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Ein Gleichgewichtsdiagramm ist eine grafische Darstellung der verschiedenen Strukturanordnungen, die innerhalb eines Bereichs eines Legierungselements auftreten.
Dieses Diagramm zeigt, wie sich Eisen und Kohlenstoff verbinden, WENN es langsam abgekühlt wird (im Gleichgewicht). Unter 2 % ist es Stahl, über 2 % geht es in den Bereich des Gusseisens, wo der Kohlenstoff dazu neigt, zu koagulieren (zu verklumpen). Zementit Fe3C hat 6,67 % C und ist im Grunde eine Keramik. Das Eutektoid (Perlit) bei E hat 0,83 % C, weniger Kohlenstoff ist ein untereutektoider Stahl (A) und mehr ist übereutektoider Stahl (B). Alpha-Eisen (Ferrit), Gamma-Eisen (Austenit, der nur bei hohen Temperaturen existiert) und Delta-Eisen (eine andere Hochtemperaturstruktur).
Zwei sehr wichtige Phasenumwandlungen finden bei 0,83 % C und bei 4,3 % C statt. Bei 0,83 % C und 723 ºC ist die Umwandlung eutektoid und wird Perlit genannt. Diese 2 Phasen trennen sich in Schichten. Von Gamma (Austenit) –> alpha + Fe3C (Zementit)
Bei 4,3% C und 1130ºC ist die Umwandlung eutektisch und wird Ledeburit genannt. L(flüssig) –> gamma (Austenit) + Fe3C (Zementit). Dies ist Gusseisen.
BTW. Da Kohlenstoff (12) viel leichter ist als Fe (56), ist der tatsächliche Atom-% Kohlenstoff (durch Zählen der Atome) etwa 4,6 mal höher als der %C nach Gewicht. Es ist also nicht mehr ganz so erstaunlich, oder? Ich meine, wie 0,5 % Kohlenstoff Weicheisen völlig umwandeln kann … es sind in Wirklichkeit etwa 2 %, wenn man die Atome zählt – nicht die Masse.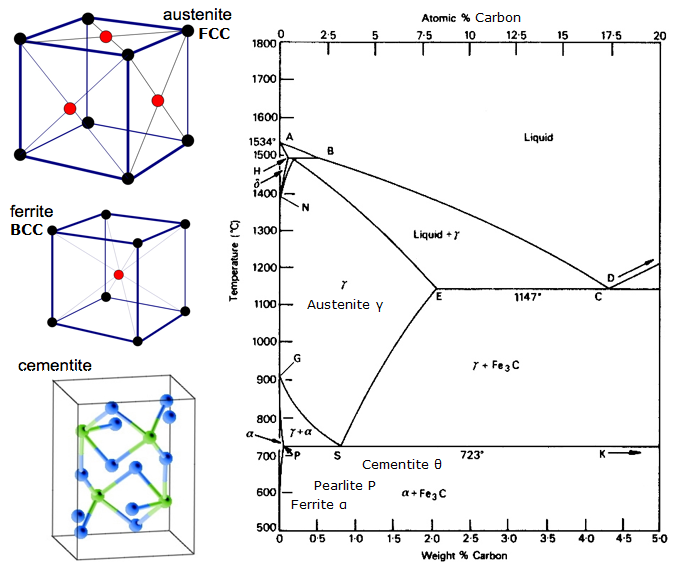
Zusammenfassung der Fe-C Strukturen (Körner)
- Austenit (γ-Eisen). Existiert nur oberhalb von 723C, wenn die FCC-γ-Eisenstruktur auftritt. Kann sich bis zu 2,1 % C nach Masse auflösen. Nicht magnetisch, weich (daher auch die Warmumformung). Austenit kann auch bei Raumtemperatur entstehen, wenn man einige Eisenatome gegen etwas anderes austauscht – wie Nickel. Dies ist der Fall bei austenitischem rostfreiem Stahl, wie z. B. 316. Wie der Hochtemperatur-Austenit ist auch dieser nichtrostende Stahl nicht magnetisch. Einige andere Arten von rostfreiem Stahl sind magnetisch.
- Zementit (Eisenkarbid Fe3C, 6,67 % C nach Masse. Es gibt zwölf Eisenatome und vier Kohlenstoffatome pro Einheitszelle, also 33 % Kohlenstoffatome). Sehr hart und spröde, da es sich um eine Keramik handelt. Haben Sie schon einmal von Wolframkarbid gehört?
- Ledeburit (das Ferrit-Zementit-Eutektikum, 4,3 % Kohlenstoff)
- Ferrit (α-Eisen, δ-Eisen; weich). Kein Kohlenstoff, BCC. Weich und dehnbar.
- Perlit (88% Ferrit, 12% Zementit, d.h. 0,83% C) Stärker als Ferrit
- Martensit. Tritt auf, wenn die Abkühlung zu schnell ist, um Perlit zu bilden, so dass Zementitspitzen im Korn eingeschlossen werden. Dies tritt bei der Abschreckhärtung von Stahl mit einem hohen Kohlenstoffgehalt auf. Sehr hart.
Mikrografien (Fotos von einem Mikroskop).
(A) = 0,1%C Ferrit/Perlit, (B) = 0,25%C mehr Perlit, (C) = 0,83%C alles Perlit, (D) = 1,4%C Perlit/Zementit
Nahaufnahme von Perlit mit Schichten von Ferrit (weiß) und Zementit (dunkel).
Mehr über Perlit: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Großes FZ-Gleichgewichtsdiagramm

Große Druckversion 2000x2658px
Schlupf
Wenn ein Stück Metall verformt wird, sind es die Körner, die verformt werden. Ein Korn ist ein Kristall, eine geordnete Anordnung von Atomen in einem Gitter. Wenn Atome auseinandergezogen werden, handelt es sich um eine elastische Verformung, weil die Atome durch die Anziehungskraft der Elektronen zusammengehalten werden, was wie eine Feder wirkt. Dauerhafte (oder plastische) Verformung bedeutet jedoch, dass die Atome tatsächlich in Schichten oder Ebenen aneinander vorbeigleiten.
Echte Kristalle gleiten nicht in einer ganzen Ebene auf einmal. Dies würde eine sehr hohe Kraft erfordern. Stattdessen erlauben die Unvollkommenheiten des Kristalls das Gleiten von Atom zu Atom. Je breiter der Bereich der betroffenen Atome ist, desto duktiler (gleitfähiger) ist das Korn. Hier ist ein Beispiel für eine Unvollkommenheit, die Versetzung, die sich leicht durch den Kristall bewegen kann.
Hier ist ein tatsächliches Beispiel für Gleiten. (
Eine rasterelektronenmikroskopische Aufnahme eines Einkristalls aus Cadmium, der sich durch Versetzungsgleiten auf 100 Ebenen verformt und dabei Stufen
auf der Oberfläche bildet.
Die folgende Animation zeigt ein Gitter aus Atomen (wie in einem Metall). Es gibt nur 2 Möglichkeiten, die Atome zu verformen – axial (Zug und Druck) und scherend (seitlich).
Diese Animation zeigt nur den elastischen Teil der Spannungs-/Dehnungskurve, wo kein atomarer Schlupf auftritt.
Der Inhalt dieser Seite erfordert eine neuere Version des Adobe Flash Players.

Weitere Informationen hier: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
Was ist eigentlich BCC und FCC?
Die BCC- (Body Centred Cubic) und FCC- (Face Centred Cubic) Kristallstrukturen sind zwei alternative Möglichkeiten, Eisenatome zu packen.
- BCC ist die Anordnung bei Raumtemperatur, die als Ferrit bezeichnet wird
- FCC ist die Anordnung bei hoher Temperatur (>723oC), die als Austenit bezeichnet wird.
Download Inventor Dateien: SC, BCC, FCC, Alle drei (SC+BCC+FCC)
![]()
SC ist Simple Cubic und kommt nicht mit Eisenatomen vor. Dies ist das Gitter von Salz – NaCl.
Die kleinste Anordnung (Einheit) ist unten dargestellt. Beachte, wie sich das kubische Gitter (blau gefärbt) ausdehnt, wenn die anderen Atome in BCC- und FCC-Gittern dazwischen eingepasst werden.
![]()
Die folgenden Diagramme stiften oft Verwirrung.

Das Problem ist, dass die roten Atome wie Kohlenstoff und die schwarzen Atome wie Eisen aussehen. Nein, nein, nein!
Jedes Atom ist Eisen! Wir färben nur die Eisenatome ein, die nicht an den Ecken sind, damit man sie besser sehen kann.
Das andere Problem mit diesen Diagrammen ist, dass es keinen wirklichen Hinweis darauf gibt, dass der Abstand der Eckatome WÄCHST, wenn man von SC zu BCC zu FCC geht.
SC (Simple Cubic) Struktur. NICHT EISENBei einer SC (Simple Cubic) Struktur (die Eisen nicht hat) ist der Abstand zwischen den Atomen D. (Wobei D der Durchmesser der Atome ist) Das Volumen dieser Einheit ist also D3, und das Volumen des Atoms ist 4/3Πr3. Die Dichte ist also 52% des festen Atoms. Nicht sehr kompakt. |
 |
BCC (Body Centred Cubic) Struktur. FERRITEBei einer BCC-Struktur (Body Centred Cubic) (die Eisen bei 723oC aufweist) beträgt der Abstand zwischen den Eisenatomen 1,1547D. (Wobei D der Durchmesser der Atome ist) Das Volumen dieser Einheit ist also (1,1547D)3, und das passt zu 2 Atomen, also ist das Volumen der Atome 2×4/3Πr3. Die Dichte beträgt also 68% eines festen Atoms. Kompakter. Diese Struktur wird Ferrit genannt. Kohlenstoff passt überhaupt nicht in diese Struktur (Nun, ich lüge. Er kann erbärmliche 0,025% C lösen, was praktisch Null ist, oder 0,035% bei der Übergangstemperatur, was immer noch nichts ist) |
 |
FCC (Face Centred Cubic) Struktur. AUSTENITBei einer FCC (Face Centred Cubic)-Struktur (die Eisen über 723oC aufweist) beträgt der Abstand zwischen den Eisenatomen 1,4214D. (Wobei D der Durchmesser der Atome ist) Das Volumen dieser Einheit ist also (1,4214D)3, und das passt zu 4 Atomen, also ist das Volumen der Atome 4×4/3Πr3. Die Dichte beträgt also 74% eines festen Atoms. Dies ist die kompakteste Struktur und damit 6 % dichter als Ferrit! Diese Struktur wird Austenit genannt und kann 2 % Kohlenstoff in seiner Struktur lösen. Das sind 2 % nach Gewicht, nicht vergessen, und da Eisen (56) das 4,7-fache des Gewichts von Kohlenstoff (12) hat, kann es etwa 21 % Kohlenstoffatome lösen (etwa 1 Kohlenstoff auf 5 Eisenatome). |
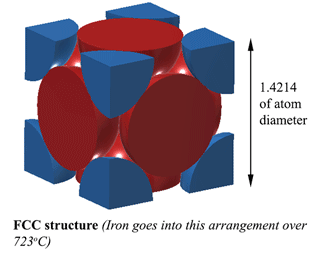 |
Wo passt also der Kohlenstoff in den Austenit?Kohlenstoff kann genau in den Raum in der Mitte jeder Einheitskante passen. Dies verursacht jedoch eine gewisse Verzerrung, so dass nicht an JEDER Kante ein Kohlenstoffatom Platz findet. Im besten Fall kann Austenit bei 1130oC etwas mehr als 2 Kohlenstoffatome alle 3 Einheiten unterbringen. (2C:12Fe oder 1:6 nach Atomen). Daraus ergeben sich die 2 % nach Gewicht. Mehr hier (ziemlich schwer) https://hal.archives-ouvertes.fr/jpa-00246587/document |
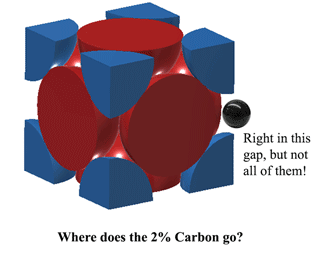 |
Weitere Informationen zu BCC und FCC hier:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Video von einfachen kubischen, kubisch-körperzentrierten und kubisch-flächenzentrierten Kristallstrukturen. Eisenatome bilden keine einfache kubische Struktur.
Einfache kubische, körperzentrierte kubische und flächenzentrierte kubische Struktur
Härtung von Stahl
Beim Härten geht es darum, den Schlupf zu verhindern.
Es gibt 3 Möglichkeiten, dies zu tun.
- Alle Unvollkommenheiten beseitigen (eine ziemlich unmögliche Aufgabe, obwohl gerade deshalb sehr feine Fasern verrückte Festigkeiten ergeben können)
- Alle Schlupfstellen aufbrauchen, so dass kein Schlupf mehr auftreten kann. Dies wird als Kaltverfestigung bezeichnet.
- Blockieren Sie den Schlupf, damit er nicht den ganzen Weg durch die Körner zurücklegt. Kohlenstoff (und Stickstoff) bilden Verbindungen, die als Härtungsmittel wirken und verhindern, dass Versetzungen im Eisen-Kristallgitter (Ferrit) aneinander vorbeigleiten. Martensit tut dies auf wunderbare Weise. Dies ist die Wärmebehandlungshärtung.
Das Abschrecken von Stahl ist im Fe-C-Gleichgewichtsdiagramm nicht dargestellt, weil das Abschrecken nicht im Gleichgewicht ist! (d.h. die Abkühlung ist zu schnell, als dass der Austenit mit Kohlenstoff darin sich in die komplizierte Perlitstruktur einfügen könnte.

Von https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Die schnelle Abkühlung (Abschrecken) erzeugt eine andere Kornstruktur, die Martensit genannt wird. Dieses Korn ist extrem hart und fest, aber auch spröde. Die Eisenkarbidspitzen, die das Korn durchdringen, verhindern nun das Gleiten, so dass die Duktilität verloren geht.

Martensit: University of Cambridge
Um die Sprödigkeit nach dem Abschrecken zu verringern, wird dem Stahl durch Anlassen Zähigkeit verliehen. Dabei werden die Karbiddendriten so verändert, dass sie etwas duktiler werden – ohne zu viel Festigkeit und Härte zu verlieren.
Das Anlassen muss bei einer Temperatur erfolgen, die unterhalb der Rekristallisation liegt. Das Anlassen erfolgt am besten in einem Ofen, kann aber auch mit der Flamme durchgeführt werden, indem man die Farbe des Stahls beurteilt. Die Anlassfarben können als Anhaltspunkt für die Temperatur dienen. Je heißer der Stahl angelassen wird, desto weicher ist er.
Legierungen wie rostfreier Stahl bilden bei einer bestimmten Temperatur dünnere Schichten als Kohlenstoffstähle und haben daher eine niedrigere Farbe in der Reihe. So entspricht z.B. blasses Stroh bei SS 300°C, bei CS dagegen 230°C. Die Farben, die kälter als die Rottöne sind (unter 500 °C), sind eigentlich Verfärbungen von Oxiden und nicht das eigentliche Strahlungsglühen der Temperatur selbst. (Diese wäre infrarot und unsichtbar. Es leuchtet also alles, man kann das Licht nur nicht sehen!)
| Strahlungsfarbe | Celcius | Farben | Temperierungsanwendungen / Sonstiges |
| Gelb-Weiß | 1539°C | 2800°F | Höchster Schmelzpunkt (0%C reines Eisen) |
| Hellgelb | 1130°C | 2066°F | Tiefster Schmelzpunkt (4%C Gusseisen) |
| Gelb | 1093°C | 2000°F | Kupfer schmilzt bei 1084°C, Gold 1063°C |
| Dunkelgelb | 1038°C | 1900°F | |
| Orangegelb | 982°C | 1800°F | |
| Orange | 927°C | 1700°F | Messing schmilzt 930°C |
| Orange rot | 871°C | 1600°F | |
| Hellrot | 816°C | 1500°F | |
| Rot | 760°C | 1400°F | Stahlrekristallisationstemperatur 723°C |
| Mittelrot | 704°C | 1300°F | |
| Mattrot | 649°C | 1200°F | Aluminium schmilzt 600-660°C |
| Hellrot | 593°C | 1100°F | Aufhärtung für Konstruktionsstähle. |
| Sehr schwach rot, meist grau | 538°C | 1000°F | Aufhärtung für Konstruktionsstähle. |
| Dunkelgrau | 427°C | 0800°F | Aufhärtung für Konstruktionsstähle. Magnetische Veränderung 410 |
| Oxidationsfarbe | Celcius | Farben | Vergüten von Anwendungen |
| Blau | 302°C | 0575°F | Sägen für Holz, Federn |
| Dunkellila | 282°C | 0540°F | Kaltmeißel, Einsätze für Stahl |
| Violett | 271°C | 0520°F | Presswerkzeuge, Äxte |
| Braun/Violett | 260°C | 0500°F | Stanzen, Näpfe, Schnapper, Spiralbohrer, Reibahlen |
| Braun | 249°C | 0480°F | Gewindebohrer, Scherenmesser für Metalle |
| Dunkelstroh | 241°C | 0465°F | Fräswerkzeuge, Bohrer |
| Helles Stroh | 229°C | 0445°F | Hobel- und Nutenfräser |
| Schwaches Stroh | 199°C | 0390°F |
Abschrecken:
Abschreckgeschwindigkeit: Stähle mit höherem Kohlenstoffgehalt können langsamer abgeschreckt werden, aber ein Stahl mit niedrigerem Kohlenstoffgehalt muss schnell abgeschreckt werden, um eine Härtungswirkung zu erzielen.
Abschreckgeschwindigkeit: (SCHNELLST)> Salzwasser > Wasser > Öl > Luft > isoliert. (LANGSAMST)
Für eine komplexe und teure Arbeit ist es besser, eine langsam abschreckende Legierung zu verwenden, da sie weniger empfindlich auf Temperaturschwankungen reagiert. Aus diesem Grund werden die meisten Werkzeugstähle, z. B. für Spritzgusswerkzeuge, ÖL-abgeschreckt. Wasserabschrecken ist gut für einfache Formen, die leichter kontrolliert werden können, aber es kann bei dickeren Abschnitten zu Rissen führen, weil die Oberfläche schrumpft, bevor das Innere schrumpft.
Induktionshärtung. Beim Induktionshärten wird der Stahl durch elektrische Induktion (schnelle magnetische Veränderungen) erwärmt und anschließend schnell durch einen Wasserstrahl abgeschreckt. Alternative Art der Erwärmung anstelle von Flamme oder Ofen.

Induktionshärtung. http://www.thermobondflame.com/Services.page?i=4
Wie man die Oberfläche härtet: CASE Hardening.
Wärmebehandlung = Abschrecken > Martensit (verhindert Schlupf).
Wärmebehandlung außerhalb der Oberfläche > Abschrecken. Lokale Flamme oder Induktion mit Wasser abgeschreckt (Zahnräder).
Kohlenstoff durchdringt die Außenfläche > Abschrecken. Aufkohlen (Erhitzen in Kohlenstoffpackungen oder Kohlenstoffgas oder erhitzten Lösungen). Beim Nitrieren wird Stickstoff anstelle von Kohlenstoff verwendet, um eine ähnliche Wirkung zu erzielen, und es ist einfacher, ihn dazu zu bringen, in die Oberfläche einzudringen.

Flammhärten von Walzstahl:http://www.thermobondflame.com/Services.page?i=2
Legierte Stähle
Auswirkungen von Legierungselementen auf die Eigenschaften von Werkzeugstahl: (sehr grob)
- Kohlenstoff: Eine Erhöhung des Kohlenstoffgehalts erhöht die Härte leicht und die Verschleißfestigkeit erheblich. Dramatische Erhöhung der Härte & Festigkeit bei Wärmebehandlung.
- Mangan: Geringe Mengen an Mangan verringern die Sprödigkeit und verbessern die Schmiedbarkeit. Größere Mengen an Mangan verbessern die Härtbarkeit und ermöglichen eine Ölabschreckung (weniger starkes Abschrecken erforderlich – was die Abschreckverformung verringert).
- Silizium: Verbessert die Festigkeit, Zähigkeit und Stoßfestigkeit.
- Wolfram: Verbessert die „Warmhärte“ – wird in Hochgeschwindigkeitswerkzeugstahl verwendet. Sehr dichtes (schweres)
- Vanadium: Verfeinert das Karbidgefüge und verbessert die Schmiedbarkeit, verbessert auch die Härte und Verschleißfestigkeit.
- Molybdän: Verbessert die Tiefenhärtung, die Zähigkeit und in größeren Mengen auch die „Warmhärte“. Wird in Schnellarbeitsstahl verwendet, weil es billiger ist als Wolfram.
- Chrom: Verbessert die Härtbarkeit, Verschleißfestigkeit und Zähigkeit.
- Nickel: Verbessert die Zähigkeit und Verschleißfestigkeit in geringerem Maße.
Die Zugabe dieser Elemente in unterschiedlichen Kombinationen kann synergetisch wirken und die Wirkung der einzelnen Elemente verstärken. (So können z. B. bestimmte Legierungselemente mehr Kohlenstoff zulassen, während so viel Kohlenstoff in einem reinen Kohlenstoffstahl nicht verarbeitbar wäre). Ein weiteres Beispiel ist die interessante Art und Weise, in der rostfreier Stahl (Chrom und Nickel in Verbindung mit Eisen) ziemlich korrosionsbeständig ist.
Stahl-Identifizierungscodes
AISI-SAE Codierungssystem (American Iraon and Steel Institute – Society of Automotive Engineers). Ein 4-stelliger Code, wobei die ersten 2 Ziffern die allgemeine Stahlsorte angeben und die letzten 2 Ziffern den % Kohlenstoff x 100. Zum Beispiel ist 1010 ein reiner Kohlenstoffstahl mit 0,10 % C, 5120 ist ein Chromstahl mit 0,20 % C. Weitere Einzelheiten finden Sie hier

Amerikanische Stahlcodes: Aus Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p21
Die BSA (British Standards Association) verwendet einen 6-stelligen Code. Die Ziffern sind in 3 Gruppen unterteilt (siehe unten). Ein Stahl mit dem Code 070M20 wäre zum Beispiel 070 = Kohlenstoff- oder Kohlenstoff-Mangan-Stahl, M = Spezifikation der mechanischen Eigenschaften, 20 = Kohlenstoffgehalt 0,20%.

British Steel codes: Aus Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p20
Die UNS-Nummer (kurz für „Unified Numbering System for Metals and Alloys“) ist ein systematisches Schema, in dem jedes Metall durch einen Buchstaben, gefolgt von fünf Zahlen, bezeichnet wird. Es ist ein auf der Zusammensetzung basierendes System für handelsübliche Werkstoffe und garantiert keine Leistungsspezifikationen oder genaue Zusammensetzung mit Verunreinigungsgrenzen. Andere Nomenklatursysteme wurden in das UNS-Nummernsystem integriert, um Verwechslungen zu vermeiden. Zum Beispiel wird Aluminium 6061 (AA6061) zu UNS A96061. Nachfolgend finden Sie einen Überblick über das UNS-System mit besonderem Schwerpunkt auf den handelsüblichen Legierungen. Wie bei jedem System gibt es auch hier Unklarheiten, z. B. bei der Unterscheidung zwischen einer Superlegierung auf Nickelbasis und einem rostfreien Stahl mit hohem Nickelgehalt.
-Axxxxx – Aluminiumlegierungen
-Cxxxxx – Kupferlegierungen, einschließlich Messing und Bronze
-Fxxxxx – Eisen, einschließlich Sphäroguss und Gusseisen
-Gxxxxx – Kohlenstoff- und legierte Stähle
-Hxxxxx – Stähle – AISI H-Stähle
-Jxxxxx – Stähle – Guss
-Kxxxxx – Stähle, einschließlich Martensitaushärtung, Edelstahl, HSLA, Eisenbasis-Superlegierungen
-L5xxxx – Bleilegierungen, einschließlich Babbit-Legierungen und Lötlegierungen
-M1xxxx – Magnesiumlegierungen
-Nxxxxx – Nickellegierungen
-Rxxxxx – Feuerfeste Legierungen ◦R03xxx- Molybdänlegierungen ◦R04xxx- Niob (Kolumbium)-Legierungen ◦R05xxx- Tantal-Legierungen ◦R3xxxx- Kobalt-Legierungen ◦R5xxxx- Titan-Legierungen ◦R6xxxx- Zirkonium-Legierungen
-Sxxxxx – Rostfreie Stähle, einschließlich ausscheidungshärtender rostfreier Stähle und eisenbasierter Superlegierungen
-Txxxxx – Werkzeugstähle
-Zxxxxx – Zinklegierungen
Werkzeugstähle
Werkzeugstähle werden in der australischen Norm AS1239 behandelt und sind praktisch identisch mit der amerikanischen AISI-Werkzeugstahlklassifizierung. (Ähnlich wie die britische Norm 4659)
Zum Beispiel: AS 1239 Sorte H13 Warmarbeitsstahl mit 0,35% Kohlenstoff, 5,0% Chrom, 1,5% Molybdän und 1% Vanadium würde im DIN als X40CrMoV51 geschrieben. Schnellarbeitsstähle, zum Beispiel: AS 1239 Güteklasse M2 mit 0,85 % Kohlenstoff, 4,0 % Chrom, 5,0 % Molybdän, 6,0 % Wolfram und 2,0 % Vanadium würde in der DIN als S 6-5-2 geschrieben werden.
Stahlauswahl
Großformat (400kB): steel_types_large.jpg
Druckbares Format (1.7MB): steel_types_fullsize.jpg
Gebräuchliche Stahlsorten in Australien (Edcon)
Eisenguss
Wenn dem Stahl zu viel Kohlenstoff zugesetzt wird, kann sich der Kohlenstoff nicht in der Lösung auflösen und bildet eine völlig andere Struktur. Aus dem Fe-C-Diagramm, das wir vorhin gesehen haben, geht hervor, dass sich Gusseisen im Bereich von 2 % bis 7 % Kohlenstoff (nach Gewicht) bildet.
Es gibt viele Arten von Gusseisen, aber Grauguss ist das bekannteste und wird oft für Werkzeugmaschinensockel verwendet. Es ist aus mehreren Gründen nützlich und beliebt.
Erstens ist die Schmelztemperatur niedriger, wodurch es sich leichter gießen lässt. Dies liegt daran, dass das Eutektikum bei 4,3 % C liegt, was einen Schmelzpunkt von nur 1147oC ergibt. Dieses Eutektikum erzeugt ein neues Korn namens Ledeburit, das eine Mischung aus Austenit und Zementit ist. (Erinnern Sie sich an Perlit? Es war ein Eutektoid und bestand aus Schichten von Ferrit und Zementit). Aber da ein Eutektoid ein Tiefpunkt im Flüssig-Fest-Übergang ist, ist es der Schmelzpunkt.
Zweitens ist Grauguss großartig für Maschinengestelle. Normalerweise wäre so viel Kohlenstoff ein Alptraum an Sprödigkeit aufgrund von extremen Martensit und Zementit. Es hat sich jedoch herausgestellt, dass überschüssiger Kohlenstoff bei der richtigen Abkühlung Graphitflocken bildet. Das ist etwas völlig anderes als all die Fe-C-Körner, von denen wir gesprochen haben – wie Ferrit, Zementit, Perlit und Ledeburit. Stattdessen ist der Graphit wie ein Einschluss im Metall und verleiht Grauguss die für Maschinengestelle geeigneten Dämpfungseigenschaften. Es handelt sich jedoch um ein Material mit geringer Zugfestigkeit, so dass GCI in der Regel dort verwendet wird, wo es unter Druck steht. GCI neigt jedoch zur Härtung durch überschüssige Wärme und ist daher nicht leicht zu schweißen. Häufiger wird es gelötet, aber selbst das ist im Vergleich zum Verbinden von Stahl etwas heikel.

Fotomikroskopische Aufnahme von Grauguss, die Graphitflocken in einer Ferritmatrix zeigt. Quelle
| Name | Nennzusammensetzung | Form und Zustand | Dehngrenze | Zugfestigkeit | Dehnung | Härte | Verwendungen |
|---|---|---|---|---|---|---|---|
| Grauguss (ASTM A48) | C 3.4, Si 1,8, Mn 0.5 | Guss | – | 50 | 0,5 | 260 | Motorzylinderblöcke, Schwungräder, Zahnräder, Werkzeugmaschinensockel |
| weißes Gusseisen | C 3.4, Si 0,7, Mn 0,6 | Guss (als Guss) | – | 25 | 0 | 450 | Lagerflächen |
| Gusseisen mit Temperguss (ASTM A47) | C 2.5, Si 1,0, Mn 0,55 | Guss (geglüht) | 33 | 52 | 12 | 130 | Achslager, Laufräder, Automobilkurbelwellen |
| Duktiles oder Sphäroguss | C 3.4, P 0,1, Mn 0,4, Ni 1,0, Mg 0.06 | Guss | 53 | 70 | 18 | 170 | Getriebe, Nockenwellen, Kurbelwellen |
| Ni-Hartguss Typ 2 | C 2.7, Si 0.6, Mn 0.5, Ni 4.5, Cr 2,0 | Sandguss | – | 55 | – | 550 | Hochfeste Anwendungen |
Glossar
- Legierung: Eine metallische Substanz, die aus zwei oder mehr Elementen besteht.
- Austenit: Flächenzentriertes kubisches Eisen oder eine Eisenlegierung, die auf dieser Struktur basiert.
- Bainit: Das Produkt der letzten Umwandlung der Austenitzersetzung.
- Körperzentriert: Eine Struktur, bei der jedes Atom von acht benachbarten Atomen umgeben ist, unabhängig davon, ob sich das Atom in einer Ecke oder in der Mitte einer Einheitszelle befindet.
- Zementit: Die zweite Phase, die sich bildet, wenn der Kohlenstoff die Löslichkeitsgrenze überschreitet.
- Kritischer Punkt: Punkt, an dem die Dichten von Flüssigkeit und Dampf gleich werden und die Grenzfläche zwischen beiden verschwindet. Oberhalb dieses Punktes kann nur eine Phase existieren.
- Delta-Eisen: Die kubisch-raumzentrierte Phase, die entsteht, wenn Austenit nicht mehr die stabilste Form des Eisens ist. Existiert zwischen 2802 und 2552 Grad F, hat eine BCC-Gitterstruktur und ist magnetisch.
- Eutektikum: Ein eutektisches System entsteht, wenn sich eine flüssige Phase direkt in einen zweiphasigen Feststoff umwandelt.
- Eutektoid: Ein eutektoides System liegt vor, wenn sich ein einphasiger Feststoff direkt in einen zweiphasigen Feststoff umwandelt.
- Flächenzentriert: Eine Struktur, bei der sich ein Atom in der Ecke jeder Einheitszelle und eines in der Mitte jeder Fläche befindet, aber kein Atom in der Mitte des Würfels.
- Ferrit: Körperzentriertes kubisches Eisen oder eine Eisenlegierung, die auf dieser Struktur basiert.
- Feinperlit: Entsteht aus dünnen Lamellen, wenn die Abkühlung beschleunigt wird und die Diffusion auf kürzere Distanzen beschränkt ist.
- Hypereutektoid: Übereutektoide Systeme existieren unterhalb der Eutektoidtemperatur.
- Hypoeutektoid: Hypoeutektoide Systeme liegen oberhalb der Eutektoidtemperatur vor.
- Ledeburit: Eutektikum von Gusseisen. Es liegt vor, wenn der Kohlenstoffgehalt größer als 2 % ist. Es enthält 4,3 Prozent Kohlenstoff in Verbindung mit Eisen.
- Liquidus-Linie: In einem binären Phasendiagramm die Linie oder die Grenze, die die flüssigen und die flüssigen + festen Phasenbereiche trennt. Für eine Legierung ist die Liquidustemperatur diejenige Temperatur, bei der sich unter Gleichgewichtskühlung zuerst eine feste Phase bildet.
- Martensit: Eine instabile polymorphe Phase des Eisens, die sich bei Temperaturen unterhalb des Eutektoids bildet, weil die kubisch-flächenzentrierte Struktur des Austenits instabil wird. Sie verwandelt sich spontan in eine kubisch zentrierte Struktur durch Scherung, nicht durch Diffusion.
- Mikrogefüge: Struktur der Phasen in einem Material. Kann nur mit einem optischen oder Elektronenspiegel gesehen werden.
- Perlit: Ein lamellenförmiges Gemisch aus Ferrit und Karbid, das durch Zersetzung von Austenit eutektoider Zusammensetzung entsteht.
- Phase: Ein homogener Teil eines Systems, der einheitliche physikalische und chemische Eigenschaften aufweist.
- Phasendiagramm: Eine grafische Darstellung der Beziehungen zwischen Umgebungsbedingungen, Zusammensetzung und Regionen der Phasenstabilität, in der Regel unter Gleichgewichtsbedingungen.
- Polymorphie: Die Fähigkeit eines festen Materials, in mehr als einer Form oder Kristallstruktur zu existieren.
- Abkühlen: Schnelles Abkühlen – normalerweise, wenn es zu schnell geht, um Perlit zu bilden, und stattdessen Martensit entsteht
- Soliduslinie: In einem Phasendiagramm der Punkt, an dem die Erstarrung bei einer Gleichgewichtsabkühlung abgeschlossen ist oder an dem das Schmelzen bei einer Gleichgewichtsaufheizung beginnt.
- Löslichkeit: Die Menge eines Stoffes, die sich in einer bestimmten Menge eines anderen Stoffes auflöst.
DVDs:
Aufgabe:
Wärmebehandlung

Fragen:
Aufgabe: