Stål er det vigtigste tekniske materiale. Hærdningen af stål er meget vigtig.
Foredragsvideoer
![]() Stål vs. stål
Stål vs. stål
(Uredigerede optagelser)
![]() Stål: Del 1 ,
Stål: Del 1 , ![]() Stål: Del 2 ,
Stål: Del 2 , ![]() Steel: Del 3
Steel: Del 3
![]() Egenskaber og kornstruktur: BBC 1973 (Gammel, men meget god)
Egenskaber og kornstruktur: BBC 1973 (Gammel, men meget god)
Iron er rigeligt forekommende i universet og findes i solen og mange typer stjerner i betydelige mængder. Jordens kerne menes at bestå af nikkel og jern og at være varmere end Solens overflade. Denne intense varme fra den indre kerne får materiale i den ydre kerne og kappe til at bevæge sig rundt (konvektionsstrømme).
(Note: Sjovt, at vi ikke rigtig ved det, ikke? – Vi ved, at det bliver varmere, når man graver dybere ned, men vi kan kun gætte os til, hvor varmt det er i jordens centrum. Selv ved 12 km under jorden var forskernes beregninger mere end 100 % forkerte – det var var varmere end forventet. Når man forsøger at bore i disse dybder, bliver klippen så varm, at den bliver plastisk og presser sig tilbage i hullet og blokerer boret. Rotter. Så meget for at grave til jordens centrum).
Kulstofstål
Stål er en legering af jern (Fe) og kulstof (C), med 0,2 til 2,04 vægtprocent kulstof. Kulstof er det mest omkostningseffektive legeringsmateriale til jern, men der anvendes forskellige andre legeringselementer som f.eks. mangan, krom, vanadium og wolfram.
| Kulstofstål | ANSI def’n | Generel def’n | Anvendelser og egenskaber |
| Lavt kulstofstål | 0.05-0,15% | <0,1% | Blødt, duktilt. Let at forme. |
| Mildt stål | 0,16-0,29% | 0,1-0,25% | Lav trækstyrke, men det er billigt og formbart; overfladens hårdhed kan øges ved opkullende behandling. |
| Medium kulstofstål | 0,30-0,59% | 0,25-0,45% | Balancerer duktilitet og styrke og har god slidstyrke; anvendes til store dele, smedning og bilkomponenter. |
| Højt kulstofstål | 0.6-0,99% | 0,45-1,0% | Meget stærkt, anvendes til fjedre og højstyrkegarn. |
| Ultrahøjt kulstofstål | 1,0-2,0% | 1,0-1,50% (>1,5% sjældent) |
Meget hårdt – knive, stempler. Normalt vil alt over 1,2% kræve andre legeringer for at forhindre overdreven sprødhed. Meget højt kulstofindhold kan opnås ved hjælp af pulvermetallurgi. |
| Gusjern | – | 2,5-4,0 % | Lavere smeltepunkt, let støbning, lavere sejhed og styrke end stål. |
Kulstofprocenter i forskellige stålanvendelser;

Variation af mængden af legeringselementer og den måde, hvorpå de indarbejdes i stålet (opløste elementer, udfældet fase), påvirker egenskaber som hårdhed, duktilitet og trækstyrke i det resulterende stål. Med et øget kulstofindhold bliver stål hårdere og stærkere end jern, men også mere skørt. Den maksimale opløselighed af kulstof i jern (i austenitområdet) er 2,14 vægtprocent og forekommer ved 1149 °C; højere koncentrationer af kulstof eller lavere temperaturer vil give cementit (meget skørt). Hvis man tilføjer mere kulstof, får man støbejern, som har et lavere smeltepunkt og er lettere at støbe.
Smedet jern, der kun indeholder en meget lille mængde af andre grundstoffer, men indeholder 1-3 vægtprocent slagge i form af partikler, der er aflangt i én retning, hvilket giver jernet et karakteristisk korn. Det er mere rustbestandigt end stål og svejser lettere. I dag er det almindeligt at tale om “jern- og stålindustrien”, som om der var tale om en enkelt enhed, men historisk set var de to industrier adskilte produkter.
Stål er blevet produceret i tusindvis af år, men det blev almindeligt, efter at der blev udviklet mere effektive produktionsmetoder i det 17. århundrede. Bessemer-processen i midten af 1800-tallet gjorde stål relativt billigt til masseproducerede varer. Yderligere forfinelser af processen, som f.eks. den basiske oxygenstålfremstilling, sænkede produktionsomkostningerne yderligere, samtidig med at kvaliteten af metallet blev forbedret. I dag er stål et af de mest almindelige materialer i verden og er en vigtig komponent i bygninger, værktøj, biler og apparater.

Få pdf: XLER_International_Compare.pdf
VIDEO: Egenskaber og kornstruktur. BBC 1973
Grin ikke af datoen – denne video slår alle de patetiske moderne videoer, der giver dig en fin intro, men ikke andet end et talende hoved. De vover sig aldrig ud af studiet. Denne gamle video er fantastisk til en klar introduktion til ståls kornstruktur.
Del 1: Hvad er et korn? (Video 11MB)
- De pletter, der ses på en galvaniseret genstand, er krystaller eller korn af zink.
- Alle metaller består af korn, men de er normalt usynlige (for små til at se eller samme glans/farve).
- Ætsningsproces: Spejlfinish, kraftig syre, vaskes og forsegles.
- I et rent metal har kornene forskellige farver på grund af den måde, de reflekterer lyset på.
- Bittesmå krystaller vokser udad, indtil de mødes. Hver fuldt udvokset krystal kaldes et korn.
Del 2: Omkrystallisering (Video 13MB)
- Før koldbearbejdning har kornene samme størrelse og form
- Koldbearbejdning forlænger kornene, øger hårdheden og styrken stiger, reducerer duktiliteten.
- Ved 350C dannes der nye korn i Al til erstatning for gamle korn. Kaldes rekrystallisering
- Rekrystallisering blødgør, sænker styrken, duktilitet øges
- Overdreven rekrystalliseringstemp giver dårlige mekaniske egenskaber
Del 3: Varmebehandling af stål (Video 23MB)
- Stålkorn er for små til at være synlige – kræver et mikroskop med ca. 250 gange forstørrelse.
- Ferrit: Lysfarvet. Fremstillet af jern. Duktilitet til stål
- Pearlit: Mørkere farvet. Lag af jern + jernkarbid. Hårdhed og styrke i forhold til stålet
- 100% Pearlit er ca. 0,8 % C. Pearlit, rekrystalliseringstemperatur 720C.
- Normalisering – afkøles i luft, reduceret kornstørrelse og mere ensartet form, sejhed øges
- Afkøling – øger hårdheden. Ikke nok tid til, at perlit dannes, så der dannes en nåleformet struktur – martensit. Meget hård og skør.
- Hærdning – (efter nedkøling) genopretter sejheden. Ændrer martensitnålene med små flager af kulstof. Dette giver hårdhed OG sejhed.
- 0,1 % C-stål (blødt stål). Omkrystalisering 900C. Ikke nok kulstof til at producere martensit.
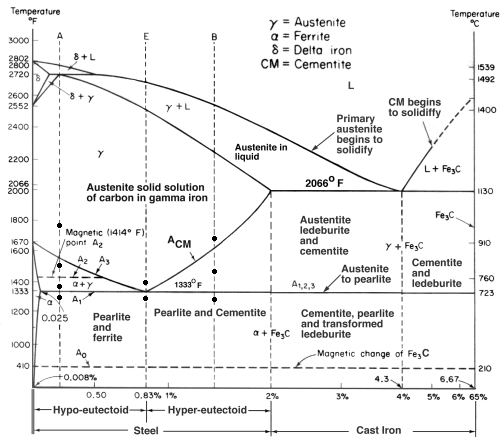
Iron-Carbon Equilibrium Diagram
Fremragende link (Cambridge University): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Et ligevægtsdiagram er et diagram over de forskellige strukturelle arrangementer, der forekommer inden for et område af et legeringselement.
Dette diagram viser, hvordan jern og kulstof kombinerer sig, HVIS det afkøles langsomt (i ligevægt). Under 2 % er stål, over 2 % er på vej ind i støbejernsområdet, hvor kulstof har en tendens til at koagulere (klumpe sammen). Cementit Fe3C har 6,67%C og er grundlæggende en keramik. Den eutektoide (perlit) ved E har 0,83 % C, mindre kulstof er hypoeutektoid stål (A), og mere er hypereutektoid (B). Alfajern (ferrit), gammajern (austenit, som kun findes ved høj temperatur) og deltajern (en anden struktur ved høj temperatur).
To meget vigtige faseændringer finder sted ved 0,83%C og ved 4,3% C. Ved 0,83%C og 723ºC er omdannelsen eutektoid, kaldet perlit. Disse 2 faser skiller sig ud i lag. Fra gamma (austenit) –> alpha + Fe3C (cementit)
Ved 4,3 % C og 1130ºC er omdannelsen eutektisk, kaldet ledeburit. L(flydende) –> gamma (austenit) + Fe3C (cementit). Dette er støbejern.
BTW. Da kulstof (12) er meget lettere end Fe (56), er den faktiske atomare % kulstof (ved at tælle atomer) faktisk ca. 4,6 gange højere end %C efter vægt. Så det er ikke helt så fantastisk nu, er det? Jeg mener ligesom hvordan 0,5% kulstof helt kan omdanne blødt jern … det er i virkeligheden omkring 2% hvis man tæller atomer – ikke masse.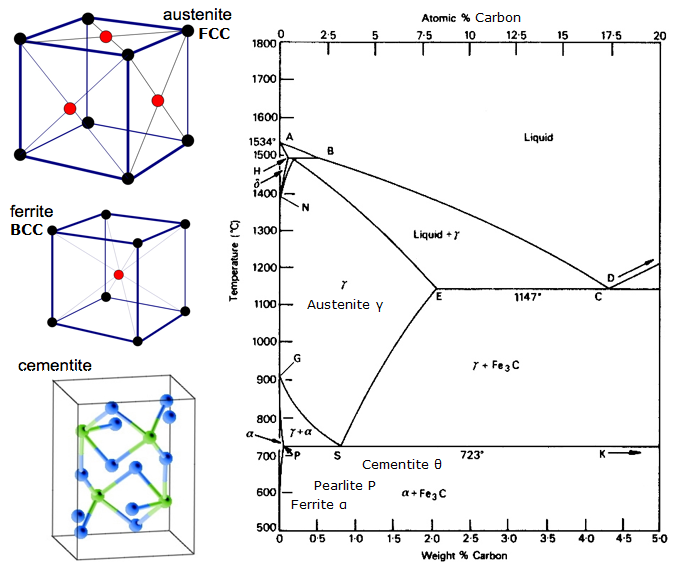
Summary of Fe-C structures (grains)
- Austenit (γ-jern). Findes kun over 723C, hvor FCC γ-jernstrukturen opstår. Kan opløses op til 2,1 %C i masse. Ikke-magnetisk, blødt (derfor har vi varmbearbejdning). Austenit kan også eksistere ved stuetemperatur, hvis man udskifter nogle jernatomer med noget andet – f.eks. nikkel. Det er dette, hvad austenitisk rustfrit stål er – som f.eks. 316. Og ligesom Austenit ved høje temperaturer er disse rustfrie ståltyper ikke magnetiske. Nogle andre typer rustfrit stål er magnetiske.
- Cementit (jerncarbid Fe3C, 6,67 %C i masse. Der er tolv jernatomer og fire kulstofatomer pr. celleenhed, altså 33% kulstofatomer). Meget hårdt og skørt, fordi det er en keramik. Har du nogensinde hørt om wolframcarbid? Tja, det er jerncarbid.
- Ledeburit (det eutektiske ferrit-cementit-eutektikum, 4,3 % kulstof.)
- Ferrit (α-jern, δ-jern; blødt). Uden kulstof, BCC. Blød og duktil.
- Pearlite (88% ferrit, 12% cementit, som er 0,83%C) Stærkere end ferrit
- Martensite. Opstår, når afkølingen er for hurtig til at danne perlit, så det låser spidser af cementit fast i kornet. Dette sker ved hærdning af stål med tilstrækkelig meget kulstof i stålet. Meget hård.
Mikrografer (billeder fra et mikroskop).
(A) = 0,1%C ferrit/perlit, (B) = 0,25%C mere perlit, (C) = 0,83%C udelukkende perlit, (D) = 1,4%C perlit/cementit
Nærbillede af perlit, der viser lag af ferrit (hvidt) og cementit (mørkt).
Mere om perlit: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Stort FC-ligevægtsdiagram

Large Print Version 2000x2658px
Slip
Når et stykke metal bliver deformeret, er det kornene, der bliver deformeret. Et korn er en krystal, en ordentlig anordning af atomer i et gitter. Hvis atomerne strækkes fra hinanden er der tale om elastisk deformation, fordi atomerne holdes sammen af elektronernes tiltrækninger – hvilket virker som en fjeder. Men permanent (eller plastisk) deformation betyder, at atomerne faktisk glider forbi hinanden i lag eller planer.
Egte krystaller glider ikke i et helt plan på en gang. Det ville kræve en meget stor kraft. I stedet tillader ufuldkommenhederne i krystallen, at glidet kan bevæge sig ét atom ad gangen. Jo bredere rækkevidde af de påvirkede atomer, jo mere duktilt (let glidende) er kornet. Her er et eksempel på en ufuldkommenhed kaldet en dislokation, som let kan bevæge sig gennem krystallet.
Her er et konkret eksempel på glidning. (vi finder ikke bare på det her!)
Et scanningelektronmikroskopisk billede af en enkelt krystal af cadmium, der deformeres ved dislokationsglidning på 100 planer og danner trin
på overfladen.
Den følgende animation viser et gitter af atomer (som f.eks. i et metal). Der er kun 2 måder at forvrænge atomerne på – aksialt (spænding og kompression) og forskydning (sidelæns).
Denne animation viser kun den elastiske del af spændings-/forspændingskurven, hvor der ikke forekommer atomisk glid.
Indholdet på denne side kræver en nyere version af Adobe Flash Player.

Videre oplysninger her: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
Så hvad er BCC og FCC egentlig?
BCC- (Body Centred Cubic) og FCC-krystalstrukturerne (Face Centred Cubic) er to alternative måder at pakke jernatomer på.
- BCC er den rumtemperatur-opstilling, der kaldes ferrit
- FCC er den højtemperatur-opstilling (>723oC), der kaldes austenit.
Download Inventor-filer: SC, BCC, FCC, Alle tre (SC+BCC+FCC)
![]()
SC er Simple Cubic og forekommer ikke med jernatomer. Dette er gitteret i salt – NaCl.
Det mindste arrangement (enhed) er vist nedenfor. Læg mærke til, hvordan det kubiske gitter (farvet blåt) udvider sig, efterhånden som de andre atomer er indpasset mellem dem i BCC- og FCC-gitter.
![]()
Der er ofte en vis forvirring omkring disse diagrammer nedenfor.

Problemet er, at de røde atomer ligner kulstof, og de sorte atomer ligner jern. Nej, nej, nej, nej!
Alle atomer er jern! Vi farvelægger bare de jernatomer, der ikke er på hjørnerne, for at gøre dem lette at se.
Det andet problem med disse diagrammer er, at der ikke er nogen reel indikation af, at afstanden mellem hjørneatomerne ØGES, når man går fra SC til BCC til FCC.
SC (Simple Cubic) struktur. IKKE JERNMed en SC (Simple Cubic) struktur (hvilket jern ikke gør) er afstanden mellem atomerne D. (Hvor D er atomernes diameter) Så volumen af denne enhed er D3, og volumen af atom er 4/3Πr3. Så densiteten er 52% af det faste atom. Ikke særlig kompakt. |
 |
BCC-struktur (Body Centred Cubic). FERRITMed en BCC-struktur (Body Centred Cubic) (som jern gør under 723oC) er afstanden mellem jernatomerne 1,1547D. (Hvor D er atomernes diameter) Så volumen af denne enhed er (1,1547D)3, og dette passer til 2 atomer, så volumen af atomer er 2×4/3Πr3. Så densiteten er 68% af et fast atom. Mere kompakt. Denne struktur kaldes ferrit. Kulstof passer slet ikke ind i denne struktur (Nå, men jeg lyver. Det kan opløse sølle 0,025% C, hvilket er stort set nul, eller 0,035% ved overgangstemperaturen, hvilket stadig er ingenting) |
 |
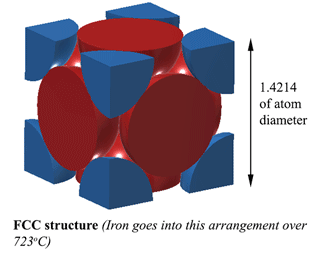
FCC-struktur (Face Centred Cubic). AUSTENITMed en FCC-struktur (Face Centred Cubic) (hvilket jern gør over 723oC) er afstanden mellem jernatomerne 1,4214D. (Hvor D er atomernes diameter) Så volumen af denne enhed er (1,4214D)3, og dette passer til 4 atomer, så volumen af atomer er 4×4/3Πr3. Så densiteten er 74% af et fast atom. Dette er den mest kompakte, hvilket gør den 6 % mere tæt end ferrit! Denne struktur kaldes Austenit, og den kan opløse 2 % kulstof i sin struktur. Det er 2% i vægt ikke at glemme, og da jern (56) er 4,7 gange vægten af kulstof (12), kan det opløse ca. 21% kulstofatomer (ca. 1 kulstof for hver 5 jernatomer). |
 |
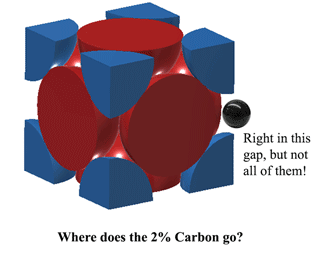
Så hvor passer kulstoffet ind i Austenit?Kulstof kan passe lige i det rum i midten af hver enhedskant. Dette medfører dog en smule forvrængning, så man kan ikke få plads til et kulstofatom på HVER kant. I bedste fald kan Austenit ved 1130oC få plads til lidt over 2 kulstofatomer hver 3. enhed. (2C:12Fe eller 1:6 ved atomer). Det er derfra 2% efter vægt kommer. Mere her (ret tungt) https://hal.archives-ouvertes.fr/jpa-00246587/document |
 |
Videre oplysninger om BCC og FCC her:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Video om Simple Cubic, Body-Centred Cubic og Face Centred Cubic krystalstrukturer. Jernatomer danner ikke Simple Cubic.
Simple Cubic, Body-Centred Cubic og Face Centred Cubic
Hærdning af stål
Hærdning handler om at forhindre slip i at ske.
Der er 3 måder at gøre dette på.
- Få fjernet alle ufuldkommenheder (temmelig umulig opgave, selv om det er derfor, at meget fine fibre kan give vanvittige styrker)
- Opbruge alle glidninger, så der ikke længere kan opstå glidning. Dette kaldes arbejdshærdning.
- Blokér glid fra at bevæge sig hele vejen gennem kornene. Kulstof (og kvælstof) danner forbindelser, der virker som hærdningsmiddel og forhindrer dislokationer i jernkrystalgitteret (ferrit) i at glide forbi hinanden. Martensit gør dette på glimrende vis. Dette er varmebehandlingshærdning.
Skøling af stål er ikke vist på Fe-C-ligevægtsdiagrammet, fordi afkøling ikke er i ligevægt! (dvs. afkøling er for hurtig til at Austenit med kulstof i sig selv kan komme ind i den komplicerede Pearlit-struktur.

Fra https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Den hurtige afkøling (nedkøling) producerer en anden kornstruktur kaldet Martensite. Dette korn er ekstremt hårdt og stærkt og skørt. Jerncarbidspidserne, der trænger igennem kornet, forhindrer nu glidning, så duktiliteten går tabt.

Martensite: University of Cambridge
For at reducere skørheden efter nedkøling anvendes hærdning for at tilføre stålet sejhed. Herved modificeres dendriterne af karbid for at give dem en smule duktilitet – uden at miste for meget styrke og hårdhed.
Temperering skal foregå ved en temperatur under rekrystallisering. En ovn er bedst til hærdning, men det kan også gøres med flamme ved at bedømme stålets farve. Tempereringsfarver kan bruges som en rettesnor for temperaturen. Jo varmere anløbning, jo blødere stålet.
Legeringer som rustfrit stål danner tyndere film end kulstofstål ved en given temperatur og giver derfor en farve lavere i serien. F.eks. svarer bleg stråfarve til 300 °C for SS i stedet for 230 °C for CS. De koldere farver end de røde farver (under 500°C) er faktisk misfarvning af oxider og ikke selve temperaturens strålingsglød. (Hvilket ville være infrarødt, og usynligt. Så alting gløder, man kan bare ikke se lyset!)
| Strålefarve | Celcius | Farenht | Tempereringsanvendelser / Andet |
| Gul-Hvid | 1539°C | 2800°F | Højeste smeltepunkt (0%C rent jern) |
| Bright Yellow | 1130°C | 2066°F | Laveste smeltepunkt (4%C støbejern) |
| Gul | 1093°C | 2000°F | Kobber smelter ved 1084°C, Guld 1063°C |
| Mørkegul | 1038°C | 1900°F | |
| Orangegul | 982°C | 1800°F | |
| Orange | 927°C | 1700°F | Bras smelter 930°C |
| Orange rød | 871°C | 1600°F | |
| Højrød | 816°C | 1500°F | |
| Rød | 760°C | 1400°F | Staal omkrystaliseringstemperatur 723°C |
| Mellemrød | 704°C | 1300°F | |
| Dull rød | 649°C | 1200°F | Aluminium smelter 600-660°C |
| Lyst rødt | 593°C | 1100°F | Hærdning til konstruktionsstål. |
| Meget svagt rød, mest grå | 538°C | 1000°F | Afhærdning til konstruktionsstål. |
| Mørk grå | 427°C | 0800°F | Afhærdning til konstruktionsstål. Magnetisk ændring 410 |
| Oxidationsfarve | Celcius | Farnethed | Tempereringsanvendelser |
| Blå | 302°C | 0575°F | Savning til træ, fjedre |
| Mørklilla | 282°C | 0540°F | Koldmejsler, sætninger til stål |
| lilla | 271°C | 0520°F | Presseværktøj, økser |
| brunt/lilla | 260°C | 0500°F | Stempler, kopper, snaps, skrueboremaskiner, remmere |
| Brun | 249°C | 0480°F | Gennemboringer, skæreklinger til metaller |
| Dark Straw | 241°C | 0465°F | Fræssere, boremaskiner |
| Light Straw | 229°C | 0445°F | Høvle- og slidstiksværktøj |
| Faint Straw | 199°C | 0390°F |
Skærende:
Hastighed af nedkøling: Stål med højere kulstofindhold kan nedkøles langsommere, men et stål med lavere kulstofindhold skal nedkøles hurtigt for at have nogen hærdende effekt.
Skydningshastighed: (HURTIGST) Saltvand > vand > vand > olie > luft > isoleret. (LANGSOMMESTE)
Til et komplekst og dyrt arbejde er det bedre at have en langsomt nedkølende legering, fordi den er mindre følsom over for temperaturudsving. Dette er grunden til, at de fleste værktøjsstål til f.eks. sprøjtestøbeværktøjer er OIL-sænket. Vandafkøling er fint til enkle former, der lettere kan kontrolleres, men det kan forårsage revner på tykkere sektioner, fordi overfladen krymper, før det indvendige gør det.
Induktionshærdning. Induktionshærdning, hvor elektrisk induktion (hurtige magnetiske ændringer) opvarmer stålet, som hurtigt efterfølges af nedkøling i vandstråle. Alternativ opvarmningsmetode i stedet for flamme eller ovn.

Induktionshærdning. http://www.thermobondflame.com/Services.page?i=4
Sådan hærder man overfladen: CASE Hardening.
Varmebehandling = quench > Martensite (stopper glidning).
Varm udenfor overfladen > quench. Lokal flamme- eller induktionsafkøling med vand (tandhjul).
Kulstof, der trænger ind i den udvendige overflade > afkøling. Opkulning (Opvarmning i kulstofpakning eller kulstofgas eller opvarmede opløsninger). Nitridering bruger kvælstof i stedet for kulstof for at opnå en lignende effekt, og det er lettere at få det til at trænge ind i overfladen.

Flammehærdning af stålrulle: http://www.thermobondflame.com/Services.page?i=2
Legerede ståltyper
Effekter af legeringselementer på værktøjsståls egenskaber: (Meget groft)
- Kulstof: Forhøjelse af kulstofindholdet øger hårdheden en smule og slidstyrken betydeligt. Dramatiske stigninger i hårdhed & styrke ved varmebehandling.
- Mangan: Små mængder af manganense reducerer sprødhed og forbedrer smedbarhed. Større mængder mangan forbedrer hærdbarheden og muliggør olieafkøling (mindre hård afkøling nødvendig – hvilket reducerer afkølingsdeformationen).
- Silicium: Forbedrer styrke, sejhed og stødmodstand.
- Wolfram: Forbedrer “varm hårdhed” – anvendes i højhastighedsværktøjsstål. Meget tæt (tung)
- Vanadium: Forfiner karbidstrukturen og forbedrer smedbarhed, forbedrer også hårdhed og slidstyrke.
- Molybdæn: Forbedrer dybdehærdning, sejhed og i større mængder “varmehårdhed”. Anvendes i værktøjsstål med høj hastighed, fordi det er billigere end wolfram.
- Chrom: Forbedrer hærdbarheden, slidstyrken og sejheden.
- Nikkel: Forbedrer sejhed og slidstyrke i mindre grad.
Indtagelse af disse elementer i varierende kombinationer kan virke synergistisk og øge virkningerne af at bruge dem alene. (For eksempel kan cetain legeringselementer tillade mere kulstof, hvor så meget kulstof ville være ubearbejdeligt i et almindeligt kulstofstål). Et andet eksempel er den interessante måde, hvorpå rustfrit stål (krom og nikkel tilsat jern) er ret korrosionsbestandigt.
Steels Identification Codes
AISI-SAE Coding system (American Iraon and Steel Institute – Society of Automotive Engineers). En 4-cifret kode, hvor de første 2 cifre angiver den generelle ståltype, og de sidste 2 cifre er % kulstof x 100. F.eks. er 1010 et almindeligt kulstofstål med 0,10 % C, 5120 er et kromstål med 0,20 % C. Flere detaljer her

Amerikanske stålkoder: Fra Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p21
BSA (British Standards Association) bruger en 6-cifret kode. Cifrene er opdelt i 3 grupper som vist nedenfor. For eksempel vil et stål med koden 070M20 være 070 = kulstof- eller kulstof-manganstål, M = specifikation af mekaniske egenskaber, 20 = kulstofindhold 0,20 %.

British Steel-koder: Fra Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p20
UNS-nummeret (forkortelse for “Unified Numbering System for Metals and Alloys”) er et systematisk skema, hvor hvert metal betegnes med et bogstav efterfulgt af fem tal. Det er et sammensætningsbaseret system for kommercielle materialer og garanterer ikke nogen præstationsspecifikationer eller nøjagtig sammensætning med grænseværdier for urenheder. Andre nomenklatursystemer er blevet indarbejdet i UNS-nummereringssystemet for at minimere forvirring. F.eks. bliver aluminium 6061 (AA6061) til UNS A96061. Nedenfor følger en oversigt over UNS-systemet med særlig vægt på almindelige kommercielle legeringer. Som med ethvert system er der tvetydigheder, som f.eks. forskellen mellem en nikkelbaseret superlegering og et rustfrit stål med højt nikkelindhold.
-Axxxxx – Aluminiumslegeringer
-Cxxxxx – Kobberlegeringer, herunder messing og bronze
-Fxxxxx – Jern, herunder duktilt jern og støbejern
-Gxxxxx – Kulstofstål og legeret stål
-Hxxxxx – Stål – AISI H-stål
-Jxxxxx – Stål – støbt
-Kxxxxx – Stål, herunder martensitisk stål, rustfrit stål, HSLA, superlegeringer på jernbasis
-L5xxxxx – Blylegeringer, herunder Babbit-legeringer og loddelegeringer
-M1xxxx – Magnesiumlegeringer
-Nxxxxx – Nikkellegeringer
-Rxxxxx – Ildfaste legeringer ◦R03xxx- Molybdænlegeringer ◦R04xxx- – Lodlegeringer
-Rxxxxx – Lodlegeringer Niobiumlegeringer (columbium) ◦R05xxx- Tantallegeringer ◦R3xxxx- Koboltlegeringer ◦R5xxxx- Titanlegeringer ◦R6xxxx- Zirconiumlegeringer
-Sxxxxx – Rustfrit stål, herunder udfældningshærdende rustfrit stål og jernbaserede superlegeringer
-Txxxxx – Værktøjsstål
-Zxxxxx – Zinklegeringer
Værktøjsstål
Værktøjsstål er omfattet af den australske standard AS1239 og er stort set den samme som den amerikanske AISI-værktøjsstålklassifikation. (Tilsvarende med British Standard 4659)
For eksempel: AS 1239 klasse H13 værktøjsstål til varmt arbejde, der indeholder 0,35 % kulstof, 5,0 % krom, 1,5 % molybdæn og 1 % vanadium, ville blive skrevet som X40CrMoV51 i DIN (tysk). Højhastighedsstål, f.eks: AS 1239 grade M2 Indeholder 0,85 % kulstof, 4,0 % krom, 5,0 % molybdæn, 6,0 % wolfram og 2,0 % vanadium, vil blive skrevet som S 6-5-2 i DIN.
Steels Selector
Stor størrelse (400kB): steel_types_large.jpg
Udskrivbar størrelse (1.7MB): steel_types_fullsize.jpg
Common steel grades in Australia (Edcon)
Cast Iron
Når der tilsættes for meget kulstof til stål, kan kulstoffet ikke opløses i opløsningen og skaber en helt anden struktur. Ud fra Fe-C-diagrammet, som vi så tidligere, dannes støbejern i intervallet 2-7 % kulstof (efter vægt).
Der findes mange typer støbejern, men gråt støbejern er det mest kendte, der ofte bruges til værktøjsmaskiners underlag. Det er nyttigt og populært af flere grunde.
For det første er smeltetemperaturen lavere, hvilket gør det lettere at støbe. Dette skyldes, at det eutektiske område ligger ved 4,3 % C, hvilket giver et smeltepunkt på kun 1147oC. Dette eutektikum producerer et nyt korn kaldet ledeburit, som er en blanding af austenit og cementit. (Kan du huske Pearlite? Det var en eutektoid og bestod af lag af ferrit og cementit). Men da en eutektoid er et lavt punkt i overgangen mellem flydende og fast stof, er det smeltepunktet.
For det andet er gråt støbejern fantastisk til maskinbaser. Normalt ville så meget kulstof være et mareridt af sprødhed på grund af ekstrem martensite og cementit. Men det viser sig, at med den rette afkøling danner overskydende kulstof flager af grafit. Dette er helt anderledes end alle disse Fe-C-korn, som vi har talt om – som ferrit og cementit og perlebit og ledeburit. I stedet er grafit som en inklusion i metallet, og det giver grå støbejern de dæmpningsegenskaber, der er velegnede til maskinbaser. Det er dog et materiale med lav trækstyrke, så GCI anvendes normalt, hvor det er i kompression. GCI er dog tilbøjelig til at hærde på grund af overdreven varme, så det er ikke let at svejse. Oftere vil det blive loddet, men selv det er lidt tvivlsomt sammenlignet med sammenføjning af stål.

Fotomikrograf af gråt støbejern, der viser grafitflager i en ferritmatrix. Kilde
| Navn | Nominel sammensætning | Form og tilstand | Begrænsning | Styrke | Trækstyrke | Længde | Hårdhed | Anvendelser |
|---|---|---|---|---|---|---|---|---|
| Gråt støbejern (ASTM A48) | C 3.4, Si 1.8, Mn 0.5 | Gods | – | 50 | 0,5 | 260 | Motorcylinderblokke, svinghjul, tandhjul, værktøjsmaskinebunde | |
| Hvidt støbejern | C 3.4, Si 0,7, Mn 0,6 | Gegast (som støbt) | – | 25 | 0 | 450 | Lagreflader | |
| Malbart jern (ASTM A47) | C 2.5, Si 1,0, Mn 0,55 | Gegast (udglødet) | 33 | 52 | 12 | 130 | Aksellagre, sporhjul, krumtapaksler til biler | |
| Duktilt eller nodulært jern | C 3.4, P 0,1, Mn 0,4, Ni 1,0, Mg 0.06 | Gods | 53 | 53 | 70 | 18 | 170 | Gear, knastaksler, krumtapaksler |
| Nihårdt type 2 | C 2.7, Si 0.6, Mn 0.5, Ni 4.5, Cr 2,0 | Sandstøbt | – | 55 | – | – | 550 | Højstyrkeanvendelser |
Glossar
- Legering: Et metallisk stof, der er sammensat af to eller flere grundstoffer.
- Austenit: Overfladecentreret kubisk jern eller en jernlegering baseret på denne struktur.
- Bainit: Produktet af den sidste omdannelse af austenitnedbrydningen.
- Body-centreret: En struktur, hvor hvert atom er omgivet af otte tilstødende atomer, uanset om atomet er placeret i et hjørne eller i midten af en enhedscelle.
- Cementit: Den anden fase, der dannes, når kulstof overskrider opløselighedsgrænsen.
- Kritisk punkt: Punkt, hvor væskens og dampens massefylde bliver lige stor, og grænsefladen mellem de to forsvinder. Over dette punkt kan der kun eksistere én fase.
- Delta jern: Den kropscentrerede kubiske fase, der opstår, når austenit ikke længere er den mest stabile form af jern. Eksisterer mellem 2802 og 2552 grader F, har BCC-gitterstruktur og er magnetisk.
- Eutektisk: Et eutektisk system opstår, når en flydende fase tramsformeres direkte til et tofaset fast stof.
- Eutektoid: Et eutektoidt system opstår, når et enfaset fast stof omdanner sig direkte til et tofaset fast stof.
- Face-centreret: En struktur, hvor der er et atom i hjørnet af hver enhedscelle og et atom i midten af hver flade, men intet atom i terningens centrum.
- Ferrit: Kropscentreret kubisk jern eller en jernlegering baseret på denne struktur.
- Fin perlit: Fremkommer af tynde lameller, når afkølingshastigheden accelereres, og diffusionen er begrænset til kortere afstande.
- Hypereutektoid: Hypereutektoide systemer findes under den eutektoide temperatur.
- Hypoeutektoid: Hypoeutektoide systemer findes over den eutektoide temperatur.
- Ledeburit: Eutektikum af støbejern. Det eksisterer, når kulstofindholdet er større end 2 procent. Det indeholder 4,3 procent kulstof i kombination med jern.
- Liquidus Line: På et binært fasediagram den linje eller grænse, der adskiller flydende og flydende + fast faseområder. For en legering er liquidustemperaturen den temperatur, ved hvilken der først dannes en fast fase under betingelser for ligevægtskøling.
- Martentsit: En ustabil polymorf fase af jern, der dannes ved temperaturer under den eutektoide fase, fordi austenitens kubisk fladcentrerede kubiske struktur bliver ustabil. Den ændrer sig spontant til en kropscentreret struktur ved forskydning, ikke ved diffusion.
- Mikrostruktur: Struktur af faserne i et materiale. Kan kun ses med et optisk eller elektronmikroskop.
- Pearlit: En lamelformet blanding af ferrit og karbid, der dannes ved nedbrydning af austenit af eutektoid sammensætning.
- Phase: En homogen del af et system, der har ensartede fysiske og kemiske egenskaber.
- Fasediagram: En grafisk fremstilling af forholdet mellem miljømæssige begrænsninger, sammensætning og områder med fasestabilitet, sædvanligvis under ligevægtsforhold.
- Polymorft: Et fast stofs evne til at eksistere i mere end én form eller krystalstruktur.
- Quench: At afkøle hurtigt – normalt når det sker for hurtigt til at danne perlelit og i stedet skaber martensit
- Soliduslinje: På et fasediagram er det punkt, hvor størkning er fuldført ved ligevægtskøling, eller hvor smeltning begynder ved ligevægtsopvarmning.
- Løselighed: Den mængde stof, der vil opløses i en given mængde af et andet stof.
DVD’er:
Opgave:
Heat Treat

Spørgsmål:
Opgave: