Steel é o material de engenharia mais importante. O endurecimento do aço é muito importante.
Vídeos de Palestra
![]() Aço vs aço
Aço vs aço
(Filme não editado)
![]() Aço: Parte 1 ,
Aço: Parte 1 , ![]() Aço: Parte 2 ,
Aço: Parte 2 , ![]() Aço: Parte 3
Aço: Parte 3
![]() Propriedades e Estrutura do Grão: BBC 1973 (Antigo mas muito bom)
Propriedades e Estrutura do Grão: BBC 1973 (Antigo mas muito bom)
Iron é abundante no universo, encontrado no sol e muitos tipos de estrelas em quantidade considerável. Pensa-se que o núcleo da terra é constituído por níquel e ferro, e que é mais quente que a superfície do Sol. Este calor intenso do núcleo interior faz com que o material do núcleo e manto exterior se movimente (correntes de convecção).
(Nota: Engraçado como nós não sabemos realmente, eh? – Sabemos que fica mais quente à medida que você escava mais fundo, mas só podemos adivinhar quão quente está no centro da terra. Mesmo a 12km de profundidade, os cálculos dos cientistas foram mais de 100% – estava mais quente do que o esperado. Ao tentar perfurar até estas profundidades, a rocha fica tão quente que se torna plástica e aperta de volta no buraco e encrava a broca. Ratos. Lá se vai a escavação até ao centro da terra).
Aço carbono
Aço é uma liga de ferro (Fe) e carbono (C), com 0,2 a 2,04% de carbono por peso. O carbono é o material de liga mais econômico para o ferro, mas vários outros elementos de liga são utilizados, como manganês, cromo, vanádio e tungstênio.
| Aço carbono | ANSI def’n | Def’n | Aplicações e propriedades |
| Aço carbono baixo | 0.05-0,15% | <0,1% | Soft, dúctil. Fácil de formar. |
| Aço suave | 0,16-0,29% | 0,1-0,25% | Baixa resistência à tração, mas é barato e maleável; a dureza superficial pode ser aumentada através da cementação. |
| Aço carbono médio | 0,30-0,59% | 0,25-0,45% | Balança a ductilidade e resistência e tem boa resistência ao desgaste; usado para peças grandes, forjadas e componentes automotivos. |
| Aço carbono alto | 0.6-0,99% | 0,45-1,0% | Muito forte, usado para molas e fios de alta resistência. |
| Aço carbono de alta resistência | 1,0-2,0% | 1,0-1,50% (>1,5% raro) |
Aço carbono de alta resistência – facas, punções. Normalmente qualquer coisa acima de 1,2% exigiria outras ligas para evitar a fragilidade excessiva. Teor muito alto de carbono pode ser alcançado usando a metalurgia do pó. |
| Ferro fundido | – | 2,5-4,0% | Ponto de fusão mais baixo, fundição fácil, menor tenacidade e resistência do que o aço. |
Percentagens de carbono em várias aplicações do aço;

Variando a quantidade de elementos de liga e a forma como são incorporados ao aço (elementos solutos, fase precipitada) influencia propriedades como dureza, ductilidade e resistência à tração do aço resultante. Com o aumento do teor de carbono, o aço torna-se mais duro e mais forte do que o ferro, mas também mais frágil. A solubilidade máxima de carbono no ferro (na região austenítica) é de 2,14% em peso, ocorrendo a 1149 °C; concentrações mais elevadas de carbono ou temperaturas mais baixas produzirão cimentos (muito frágeis). Adicione mais carbono e obtém-se ferro fundido, que tem um ponto de fusão mais baixo e é mais fácil de fundir.
Ferro forjado contendo apenas uma quantidade muito pequena de outros elementos, mas contém 1-3% em peso de escória na forma de partículas alongadas em uma direção, dando ao ferro um grão característico. É mais resistente à ferrugem do que o aço e solda mais facilmente. É comum hoje em dia falar da “indústria do ferro e do aço” como se fosse uma entidade única, mas historicamente eram produtos separados.
O aço é produzido há milhares de anos, mas tornou-se comum após a concepção de métodos de produção mais eficientes, no século XVII. O processo de Bessemer, em meados do século XIX, tornou o aço relativamente barato para bens produzidos em massa. Aperfeiçoamentos adicionais no processo, como a fabricação de aço oxigenado básico, reduziram ainda mais o custo de produção, ao mesmo tempo em que aumentaram a qualidade do metal. Atualmente, o aço é um dos materiais mais comuns no mundo e é um componente importante em edifícios, ferramentas, automóveis e eletrodomésticos.

Encerrar pdf: XLER_International_Compare.pdf
VIDEO: Propriedades e Estrutura do Grão. BBC 1973
Não ria da data – este vídeo bate todos aqueles patéticos modernos que lhe dão uma introdução extravagante mas nada mais do que uma cabeça que fala. Eles nunca se aventuram fora do estúdio. Este vídeo antigo é fabuloso para uma introdução clara à estrutura do grão de aço.
Parte 1: O que é um grão? (Vídeo 11MB)
- As manchas vistas num objecto galvanizado são cristais ou grãos de zinco.
- Todos os metais são feitos de grãos, mas normalmente são invisíveis (demasiado pequenos para ver ou mesmo brilho/cor).
- Processo de Gravura: Acabamento espelhado, ácido poderoso, lavado e selado.
- Num metal puro, os grãos são de cores diferentes devido à forma como reflectem a luz.
- Pequenos cristais crescem para fora até se encontrarem. Cada cristal totalmente cultivado é chamado de grão.
Parte 2: Recristalização (Vídeo 13MB)
- Antes do trabalho a frio, os grãos têm tamanho e forma semelhantes
- O trabalho a frio prolonga os grãos, aumenta a dureza e a força aumenta, reduz a ductilidade.
- A 350C, formam-se novos grãos no Al para substituir os grãos velhos. Chamada recristalização
- A recristalização suaviza, diminui a resistência, aumenta a ductilidade
- A temperatura de recristalização excessiva dá propriedades mecânicas pobres
Parte 3: Tratamento térmico do aço (Vídeo 23MB)
- Os grãos de aço são demasiado pequenos para serem visíveis – precisam de um microscópio aproximadamente 250 vezes maior.
- Ferrite: De cor clara. Feito de ferro. Ductilidade para o aço
- Pearlite: de cor mais escura. Camadas de Ferro + Carboneto de Ferro. Dureza e resistência ao aço
- 100% Pearlite é cerca de 0,8%C. Pearlite, temperatura de recristalização 720C.
- Normalização – resfriado ao ar, granulometria reduzida e forma mais uniforme, dureza aumentada
- Têmpera – aumenta a dureza. Não há tempo suficiente para a formação de perolita, pelo que se forma uma estructura semelhante a uma agulha – martensita. Muito dura e quebradiça.
- Têmpera – (após têmpera) restaura a dureza. Modifica as agulhas de martensita com pequenos flocos de carbono. Isto dá dureza E tenacidade.
- Aço 0,1%C (Aço Suave). Recrystalisation 900C. Não há carbono suficiente para produzir martensite.
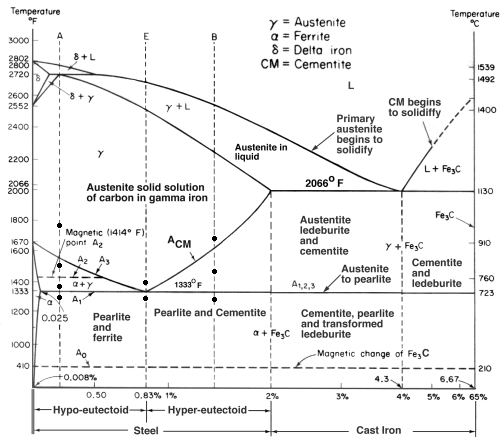
Diagrama de Equilíbrio de Ferro-Carbono
Excelente link (Universidade de Cambridge): http://www.msm.cam.ac.uk/phase-trans/2008/Steel_Microstructure/SM.html
Um diagrama de Equilíbrio é um gráfico dos diferentes arranjos estruturais que ocorrem dentro de uma gama de um elemento de liga.
Este diagrama mostra como o ferro e o carbono se combinam se for resfriado lentamente (em equilíbrio). Abaixo de 2% é o aço, mais de 2% está indo para a faixa de ferro fundido onde o carbono tende a coagular (tufos juntos). Cementite Fe3C tem 6,67%C e é basicamente uma cerâmica. O eutectóide (perolita) em E tem 0,83% C, menos carbono é um aço hipoeutectóide (A), e maior é o hipereutectóide (B). Ferro alfa (ferrite), ferro gama (austenita, que só existe a alta temperatura) e ferro delta (outra estrutura de alta temperatura).
Duas mudanças de fase muito importantes ocorrem a 0,83%C e a 4,3% C. A 0,83%C e 723ºC, a transformação é o eutectóide, chamado perolita. Estas 2 fases se separam em camadas. Da gama (austenita) –> alfa + Fe3C (cimento)
A 4,3% C e 1130ºC, a transformação é eutética, chamada ledeburite. L(líquido) –> gama (austenita) + Fe3C (cementito). Este é ferro fundido.
BTW. Como o carbono (12) é muito mais leve que o Fe (56), a % atômica real de carbono (pela contagem de átomos) é na verdade cerca de 4,6 vezes maior que a %C pelo peso. Então não é assim tão surpreendente agora, pois não? Quero dizer, como 0,5% de carbono pode transformar totalmente o ferro macio… é realmente cerca de 2% se você contar os átomos – não a massa.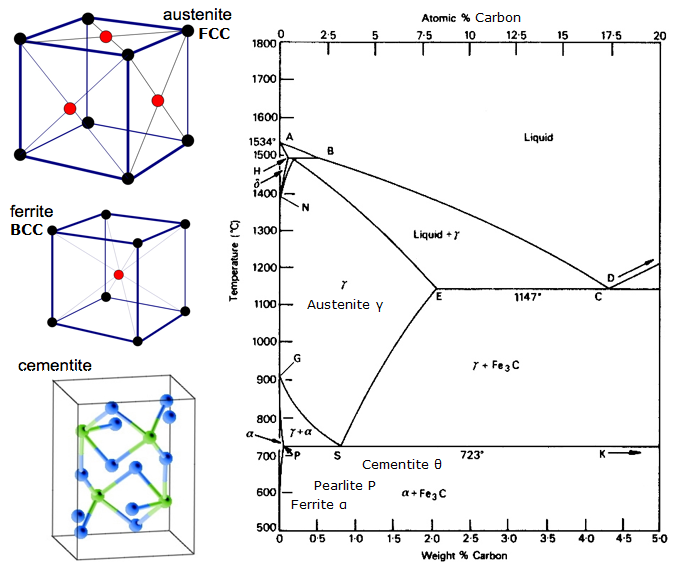
Sumário de estruturas Fe-C (grãos)
- Austenite (γ- ferro). Só existe acima de 723C, que é quando a estrutura de Fe-C γ- ferro ocorre. Pode dissolver-se até 2,1%C em massa. Não magnética, macia (por isso temos trabalho a quente). A austenita também pode existir à temperatura ambiente se você trocar alguns átomos de ferro por algo mais – como o níquel. Isto é o que é o aço inoxidável Austenítico – como o 316 por exemplo. E, como a Austenita a alta temperatura, estes aços inoxidáveis são não-magnéticos. Alguns outros tipos de aço inoxidável são magnéticos.
- Cementite (Fe3C metal duro, 6,67%C por massa. Existem doze átomos de ferro e quatro átomos de carbono por unidade de célula, portanto 33% de átomos de carbono). Muito duro e quebradiço porque é uma cerâmica. Já ouviu falar em Carboneto de Tungsténio? Bem, isto é carboneto de ferro.
- Ledeburite (The Ferrite-Cementite eutectic, 4,3% carbon.)
- Ferrite (α-iron, α-iron; soft). Sem carbono, BCC. Macio e dúctil.
- Perlite (88% ferrite, 12% cimento, que é 0,83%C) Mais forte que Ferrite
- Martensite. Ocorre quando o arrefecimento é demasiado rápido para formar Pearlite, pelo que bloqueia os espigões de Cementite no grão. Isto ocorre com o têmpera do aço com carbono suficiente. Muito duro.
Micrográficos (fotos de um microscópio).
(A) = 0,1%C ferrite/pearlite, (B) = 0,25%C mais perlite, (C) = 0,83%C toda perlite, (D) = 1,4%C perlite/cementite>
Vista de Pearlite mostrando camadas de ferrite (branco) e cementite (escuro).
>
Mais sobre Pearlite: https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
Diagrama de Equilíbrio FC grande
 >
>
Versão de impressão grande 2000x2658px
Deslize
Quando um pedaço de metal está deformado, são os grãos que estão deformados. Um grão é um cristal, um arranjo ordenado de átomos em uma grade. Se os átomos são esticados, isto é uma deformação elástica porque os átomos são mantidos juntos por atracções de electrões – que actuam como uma mola. No entanto, deformação permanente (ou plástica) significa que os átomos realmente deslizam uns sobre os outros em camadas ou planos.
Cristais reais não deslizam num plano inteiro de uma só vez. Isto exigiria uma força muito elevada. Em vez disso, as imperfeições no cristal permitem o deslizamento de um átomo de cada vez. Quanto maior a gama de átomos afetados, mais dúctil (escorregar facilmente) o grão é. Aqui está um exemplo de uma imperfeição chamada deslocamento que pode viajar facilmente através do cristal.
Aqui está um exemplo real de escorregamento. (não estamos apenas inventando isto!)
Uma micrografia eletrônica de varredura de um único cristal de cádmio deformando por deslocamento deslizamento em 100 planos, formando degraus
sobre a superfície.
A animação seguinte mostra uma malha de átomos (como em um metal). Existem apenas 2 formas de deformar os átomos – axial (tensão e compressão) e cisalhamento (lateral).
Esta animação mostra apenas a parte elástica da curva tensão/formação, onde não ocorre deslizamento atómico.
Conteúdo nesta página requer uma versão mais recente do Adobe Flash Player.

Outras informações aqui: http://www3.nd.edu/~manufact/MPEM_pdf_files/Ch03.pdf
Então o que é BCC e FCC de qualquer maneira?
As estruturas de cristal BCC (Body Centred Cubic) e FCC (Face Centred Cubic) são duas formas alternativas de embalar átomos de ferro.
- BCC é a disposição de temperatura ambiente chamada Ferrite
- FCC é a disposição de alta temperatura (>723oC) chamada Austenite.
Download Inventor files: SC, BCC, FCC, Todos os três (SC+BCC+FCC)
![]()
SC é o Cubo Simples e não ocorre com átomos de Ferro. Esta é a malha de sal – NaCl.
O menor arranjo (unidade) é mostrado abaixo. Observe como a grelha cúbica (azul colorido) está a expandir-se à medida que os outros átomos são colocados entre eles nas grelhas BCC e FCC.
![]()
Existe frequentemente alguma confusão sobre estes diagramas abaixo.

O problema é que os átomos vermelhos parecem-se com átomos de carbono e os pretos parecem-se com átomos de ferro. Não, não, não!
Todos os átomos são de ferro! Nós apenas colorimos os átomos de Ferro que não estão nas esquinas para os tornar fáceis de ver.
O outro problema com estes diagramas é que não há nenhuma indicação real de que o espaçamento dos átomos de canto AUMENTA à medida que se vai do SC para o BCC e para o FCC.
Estrutura de SC (Simple Cubic). NOT IRONCom uma estrutura SC (Simple Cubic) (que o ferro não faz), a distância entre os átomos é D. (Onde D é o diâmetro dos átomos) Então o volume desta unidade é D3, e o volume do átomo é 4/3Πr3. Então a densidade é de 52% do átomo sólido. Não muito compacto. |
 |
BCC (Body Centred Cubic) estrutura. FERRITECom uma estrutura BCC (Body Centred Cubic) (que o ferro faz abaixo de 723oC), a distância entre os átomos de ferro é de 1,1547D. (Onde D é o diâmetro dos átomos) Então o volume desta unidade é (1,1547D)3, e isto encaixa em 2 átomos de modo que o volume de átomos é 2×4/3Πr3. Portanto, a densidade é de 68% de átomo sólido. Mais compacto. Esta estrutura é chamada Ferrite. O carbono não cabe de todo nesta estrutura (Bem, eu digo uma mentira. Ele pode dissolver um patético 0,025% C, que é praticamente zero, ou 0,035% à temperatura de transição, que ainda não é nada) |
 |
FCC (Face Centred Cubic) estrutura. AUSTENITECom uma estrutura FCC (Face Centred Cubic) (que o Ferro faz mais de 723oC), a distância entre os átomos de Ferro é de 1,4214D. (Onde D é o diâmetro dos átomos) Então o volume desta unidade é (1,4214D)3, e isto encaixa 4 átomos, de modo que o volume de átomos é 4×4/3Πr3. Portanto, a densidade é de 74% de átomo sólido. Esta é a mais compacta, tornando-a 6% mais densa que a Ferrite! Esta estrutura é chamada Austenite, e pode dissolver 2% de Carbono na sua estrutura. Isso é 2% em peso não se esqueça, e como o Ferro (56) é 4,7 vezes o peso do Carbono (12), ele pode dissolver cerca de 21% de átomos de Carbono (Cerca de 1 Carbono para cada 5 átomos de Ferro). |
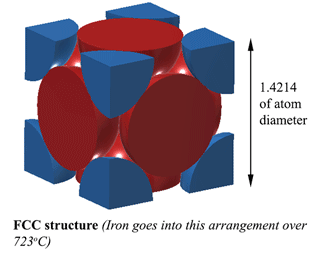 |
Então onde é que o Carbono cabe na Austenita?O Carbono pode caber mesmo nesse espaço, no meio de cada borda da unidade. No entanto, isto causa um pouco de distorção, portanto você não pode caber um átomo de Carbono em TODAS as bordas. Na melhor das hipóteses, a 1130oC a Austenite pode caber pouco mais de 2 átomos de Carbono a cada 3 unidades. (2C:12Fe ou 1:6 por átomos). É de onde vem 2% em peso. Mais aqui (bastante pesado) |
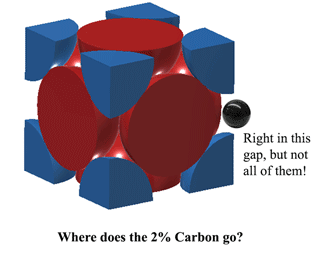 |
Outras informações sobre o BCC e a FCC aqui:
https://www.nde-ed.org/EducationResources/CommunityCollege/Materials/Structure/metallic_structures.htm
http://lessons.chemistnate.com/simple-cubic-fcc-and-bcc.html
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/…
Vídeo das estruturas de cristal Cúbico Simples, Cúbico Centrado no Corpo e Cúbico Centrado na Face. Os átomos de ferro não formam o Cúbico Simples.
Cúbico Simples, Cúbico Centrado no Corpo e Cúbico Facial
>
Têmpera do Aço
Têmpera é parar o escorregamento de acontecer.
Existem 3 maneiras de fazer isto.
- Limitar todas as imperfeições (tarefa bastante impossível, embora seja por isso que fibras muito finas podem dar forças loucas)
- Utilizar todos os deslizamentos para que não ocorra mais deslizamentos. Isto é chamado de endurecimento do trabalho.
- Bloqueio de escorregamento de todo o caminho através dos grãos. O carbono (e o nitrogênio) formam compostos que atuam como um agente endurecedor, impedindo que os deslocamentos na malha de cristal de ferro (Ferrite) deslizem uns sobre os outros. Martensite faz isto lindamente. Isto é endurecimento por tratamento térmico.
Têmpera do aço não é mostrado no diagrama de equilíbrio Fe-C, porque a têmpera não está em equilíbrio! (ou seja, o arrefecimento é demasiado rápido para que a Austenite com carbono nela contida possa entrar na complicada estrutura de Pearlite.

De https://www.tf.uni-kiel.de/matwis/amat/iss/kap_7/backbone/r7_1_2.html
O arrefecimento rápido (têmpera) produz uma estrutura de grão diferente chamada Martensite. Este grão é extremamente duro e forte, e quebradiço. Os picos de carboneto de ferro que penetram através do grão impedem agora o deslizamento, pelo que a ductilidade se perde.

Martensite: Universidade de Cambridge
Para reduzir a fragilidade após o têmpera, a têmpera é usada para adicionar tenacidade ao aço. Isto modifica os dendritos de carboneto para lhes dar um pouco de ductilidade – sem perder demasiada força e dureza.
Tempering deve estar a uma temperatura abaixo da recristalização. Um forno é melhor para a têmpera, mas pode ser feito por chama, julgando a cor do aço. As cores temperadas podem ser usadas como um guia para a temperatura. Quanto mais quente for a têmpera, mais suave será o aço.
Ligas como o aço inoxidável formam filmes mais finos do que os aços de carbono para uma determinada temperatura e, portanto, produzem uma cor mais baixa na série. Por exemplo, a palha pálida corresponde a 300°C para SS, ao invés de 230°C para CS. As cores mais frias do que as vermelhas (abaixo de 500°C) são na verdade a descoloração dos óxidos, não o brilho real da radiação da temperatura em si. (Que seria infravermelho, e invisível. Portanto, tudo está a brilhar, não se consegue ver a luz!)
| Cor da radiação | Celcius | Farenht | Aplicações de têmpera / Outros |
| Amarelo…Branco | 1539°C | 2800°F | Ponto de fusão mais alto (0%C ferro puro) |
| Amarelo claro | 1130°C | 2066°F | Ponto de fusão mais baixo (4%C ferro fundido) |
| Amarelo | 1093°C | 2000°F | Cobre funde a 1084°C, Ouro 1063°C |
| Amarelo escuro | 1038°C | 1900°F | |
| Amarelo laranja | 982°C | 1800°F | |
| Amarca | 927°C | 1700°F | Baixo derrete 930°C |
| Amarca vermelha | 871°C | 1600°F | |
| Bright red | 816°C | 1500°F | |
| Vermelho | 760°C | 1400°F | Temperatura de recristalização do aço 723°C |
| Vermelho médio | 704°C | 1300°F | |
| Vermelho baço | 649°C | 1200°F | Derretimento de alumínio 600-660°C |
| Slight red | 593°C | 1100°F | Tenso para aços de construção. |
| Muito vermelho, principalmente cinzento | 538°C | 1000°F | Têmpera para aços para construção. |
| Cinzento escuro | 427°C | 0800°F | Têmpera para aços para construção. Mudança magnética 410 |
| Cor de oxidação | Celcius | Farenht | Aplicações de têmpera |
| Azul | 302°C | 0575°F | Serras para madeira, molas |
| Púrpura Escura | 282°C | 0540°F | Cinzéis frios, setts para aço |
| Púrpura | 271°C | 0520°F | Prensa ferramentas, eixos |
| Castanho/Púrpura | 260°C | 0500°F | Punções, xícaras, brocas, alargadores, alargadores |
| Castanho | 249°C | 0480°F | Torneiras, lâminas de corte para metais |
| Palha escura | 241°C | 0465°F | Cortantes de fresa, brocas |
| Palha clara | 229°C | 0445°F | Ferramentas de planificação e ranhuras |
| Palha de Palha | 199°C | 0390°F |
Termo:
velocidade de têmpera: Aços de carbono mais altos podem ser têmpera mais lentamente, mas um aço C mais baixo precisará ser têmpera rapidamente para ter qualquer efeito de têmpera.
Ritmo de têmpera: (FASTEST) Água salgada > água > óleo > ar > isolado. (FLORESTE)
Para um trabalho complexo e caro, é melhor ter uma liga de têmpera lenta porque é menos sensível a variações de temperatura. É por isso que a maioria dos aços para ferramentas para coisas como ferramentas de moldagem por injeção são revenidos com OIL. A têmpera com água é fina para formas simples que podem ser controladas mais facilmente, mas pode causar rachaduras em seções mais grossas porque a superfície encolhe antes do interior.
Têmpera por indução. Têmpera por indução onde a indução eléctrica (mudanças magnéticas rápidas) aquece o aço que é rapidamente seguido por têmpera em jacto de água. Forma alternativa de aquecimento em vez de chama ou forno.

Têmpera por indução. http://www.thermobondflame.com/Services.page?i=4
Como endurecer a superfície: Têmpera CASA.
>
Impermeabilização = têmpera > Martensite (escorregamento de detenções).
Têmpera superfície exterior > têmpera. Chama local ou indução extinguida com água (engrenagens).
Carbono penetrando na superfície externa > extinguir. Carburização (Aquecimento em embalagem de carbono ou gás carbônico ou soluções aquecidas). A nitruração usa nitrogênio em vez de carbono para ter um efeito semelhante, e é mais fácil conseguir que penetre na superfície.

Têmpera por chama do rolo de aço: http://www.thermobondflame.com/Services.page?i=2
Aços-liga
Efeitos dos elementos de liga nas propriedades do aço ferramenta: (Muito grosseiramente)
- Carbono: O aumento do teor de carbono aumenta ligeiramente a dureza e a resistência ao desgaste de forma considerável. Aumentos dramáticos da dureza & resistência ao tratamento térmico.
- Manganês: Pequenas quantidades de Manganense reduzem a fragilidade e melhoram a forjabilidade. Quantidades maiores de manganês melhoram a temperabilidade, permitem a têmpera do óleo (têmpera menos severa necessária – o que reduz a deformação de têmpera).
- Silicone: Melhora a resistência, a tenacidade e a resistência ao choque.
- Tungsténio: Melhora a “dureza a quente” – usado em aço para ferramentas de alta velocidade. Muito denso (pesado)
- Vanádio: Refina a estrutura de carboneto e melhora a forjabilidade, melhorando também a dureza e a resistência ao desgaste.
- Molibdénio: Melhora o endurecimento profundo, a dureza, e em maiores quantidades, a “dureza quente”. Usado em aço para ferramentas de alta velocidade porque é mais barato que o tungstênio.
- Crómio: Melhora a temperabilidade, resistência ao desgaste e tenacidade.
- Níquel: Melhora a dureza e a resistência ao desgaste em menor grau.
A inclusão destes elementos em combinações variáveis pode agir sinergicamente, aumentando os efeitos da utilização isolada. (Por exemplo, elementos de liga de cetain podem permitir mais carbono, onde tanto carbono seria impraticável em um aço carbono simples). Outro exemplo é a forma interessante como o aço inoxidável (cromo e níquel adicionados ao ferro) é bastante resistente à corrosão.
Códigos de Identificação de Aços
Sistema de Codificação AISI-SAE (American Iraon and Steel Institute – Society of Automotive Engineers). Um código de 4 dígitos, os primeiros 2 dígitos dão o tipo geral de aço, e os últimos 2 dígitos são a % Carbono x 100. Por exemplo, 1010 é aço carbono simples com 0,10% C, 5120 é um aço cromo com 0,20% C. Mais detalhes aqui

Códigos do Aço Americano: De Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p21
A BSA (British Standards Association) usa um código de 6 dígitos. Os dígitos são separados em 3 grupos, como mostrado abaixo. Por exemplo, um aço com o código 070M20 seria 070 = aço carbono ou aço carbono-manganês, M = especificação de propriedade mecânica, 20 = teor de carbono 0,20%.

Códigos de aço britânico: De Higgins: Materials for Engineers aand Technicians 5th Ed. 2010. p20
O número UNS (abreviatura para “Unified Numbering System for Metals and Alloys”) é um esquema sistemático no qual cada metal é designado por uma letra seguida por cinco números. É um sistema baseado na composição de materiais comerciais e não garante nenhuma especificação de desempenho ou composição exata com limites de impureza. Outros sistemas de nomenclatura foram incorporados ao sistema de numeração UNS para minimizar a confusão. Por exemplo, o Alumínio 6061 (AA6061) torna-se UNS A96061. Abaixo está uma visão geral do sistema UNS, com ênfase especial nas ligas comerciais comuns. Como em qualquer sistema, existem ambiguidades como a distinção entre uma superliga baseada em níquel e um aço inoxidável com alto teor de níquel.
-Axxxxx – Ligas de Alumínio
-Cxxxxx – Ligas de Cobre, incluindo Latão e Bronze
-Fxxxxx – Ferro, incluindo Ferros Dúcteis e Ferros Fundidos
-Gxxxxx – Aços Carbono e Ligas
-Hxxxxx – Aços – Aços AISI H
-Jxxxxx – Aços – Fundidos
-Kxxxxxxx – Aços, incluindo Maraging, Aço Inoxidável, HSLA, Superligas à Base de Ferro
-L5xxxx – Ligas de Chumbo, incluindo ligas Babbit e ligas de solda
-M1xxxx – Ligas de magnésio
-Nxxxxx – Ligas de níquel
-Rxxxxx – Ligas refractárias ◦R03xxx- Ligas de molibdénio ◦R04xxx- Ligas de Nióbio ◦R05xxx- Ligas de Tântalo ◦R5xxxx- Ligas de Cobalto ◦R5xxxx- Ligas de Titânio ◦R6xxxx- Ligas de Zircônio
-Sxxxxx – Aços Inoxidáveis, incluindo o Têmpera por Precipitação Aço Inoxidável e Superligas à Base de Ferro
-Txxxxx – Aços para Ferramentas
-Zxxxxx – Ligas de Zinco
Aços para Ferramentas
Aços para Ferramentas são cobertos pela norma australiana AS1239 e é virtualmente a mesma classificação dos Aços para Ferramentas AISI americanos. (Similarmente com a norma britânica 4659)
Por exemplo: O aço para ferramentas da classe AS 1239 H13 para trabalho a quente contendo 0,35% de carbono, 5,0% de cromo, 1,5% de molibdênio e 1% de vanádio seria escrito como X40CrMoV51 em DIN (Alemão). Aços de alta velocidade, por exemplo: AS 1239 grau M2 Contendo 0,85% de carbono, 4,0% de cromo, 5,0% de molibdênio, 6,0% de tungstênio, 2,0% de vanádio seria escrito como S 6-5-2 em DIN.
Seletor de Aços
Tamanho Grande (400kB): steel_types_large.jpg
Tamanho Imprimível (1.7MB): steel_types_fullsize.jpg
Aço comum na Austrália (Edcon)
Ferro fundido
Quando muito carbono é adicionado ao aço, o carbono não pode dissolver-se na solução e cria uma estrutura totalmente diferente. Do diagrama Fe-C que vimos anteriormente, o Ferro Fundido forma na faixa de 2% a 7% de carbono (por peso).
Há muitos tipos de ferro fundido, mas o Ferro Fundido Cinzento é o mais familiar, muitas vezes utilizado para bases de máquinas-ferramentas. É útil e popular por várias razões.
Em primeiro lugar, a temperatura de fundição é mais baixa, o que facilita a fundição. Isto porque o eutectic está a 4,3% C, dando um ponto de fusão de apenas 1147oC. Este eutectic produz um novo grão chamado ledeburite, que é uma mistura de austenita e cimentício. (Lembra-se de Pearlite? Era um eutectoide e feito de camadas de ferrite e cimentício). Mas como um eutectoide é um ponto baixo na transição líquido-sólido, é o ponto de fusão.
Segundo, o Ferro Fundido Cinzento é ótimo para bases de máquinas. Normalmente, tanto carbono seria um pesadelo de fragilidade devido à martensita extrema e ao cimento. Mas acontece que com o arrefecimento certo, o excesso de carbono forma flocos de grafite. Isto é completamente diferente de todos estes grãos Fe-C de que temos falado – como Ferrite e Cementite e Pearlite e Ledeburite. Em vez disso, a grafite é como uma inclusão no metal, e dá ao ferro fundido cinzento as propriedades de amortecimento adequadas para bases de máquinas. É um material com baixa resistência à tração, porém, por isso o GCI é normalmente usado onde está em compressão. A GCI é propensa a endurecimento devido ao excesso de calor, por isso não é fácil de soldar. Mais frequentemente seria soldado, mas mesmo isso é um pouco duvidoso comparado com a união de aço.

Micrografia de ferro fundido cinzento mostrando flocos de grafite em uma matriz de ferrite. Fonte
| Nome | Composição nominal | Forma e estado | Força de rendimento | Força de tracção | Elongamento | Dureza | Usos |
|---|---|---|---|---|---|---|---|
| Ferro fundido cinzento (ASTM A48) | C 3.4, Si 1.8, Mn 0.5 | Cast | – | 50 | 0.5 | 260 | C blocos de cilindros de motores, volantes, engrenagens, bases de máquinas-ferramentas |
| Ferro fundido branco | C 3.4, Si 0,7, Mn 0,6 | C fundido (como fundido) | – | 25 | 0 | 450 | Superfícies de suporte |
| Ferro maleável (ASTM A47) | C 2.5, Si 1.0, Mn 0.55 | C Fundido (recozido) | 33 | 52 | 12 | 130 | Rolamentos de eixo, rodas de esteira, virabrequins automotivos |
| Ferro dúctil ou nodular | C 3.4, P 0.1, Mn 0.4, Ni 1.0, Mg 0.06 | Cast | 53 | 70 | 18 | 170 | >Atras, eixos de comando de válvulas, cambotas |
| Ni-hard tipo 2 | C 2.7, Si 0.6, Mn 0.5, Ni 4.5, Cr 2.0 | Sand-cast | – | 55 | – | 550 | Aplicações de alta resistência |
Glossário
- Alloy: Uma substância metálica que é composta por dois ou mais elementos.
- Austenita: Ferro cúbico centrado na face ou uma liga de ferro com base nesta estrutura.
- Bainite: O produto da transformação final da decomposição da austenite.
- Centrado no corpo: Uma estrutura em que cada átomo é rodeado por oito átomos adjacentes, quer o átomo esteja localizado num canto ou no centro de uma célula unitária.
- Cementite: A segunda fase formada quando o carbono está acima do limite de solubilidade.
- Ponto crítico: Ponto onde as densidades de líquido e vapor se tornam iguais e a interface entre os dois desaparece. Acima deste ponto, só pode existir uma fase.
- Ferro delta: A fase cúbica centrada no corpo que resulta quando a austenite já não é a forma mais estável de ferro. Existe entre 2802 e 2552 graus F, tem estrutura de malha BCC e é magnética.
- Eutética: Um sistema eutético ocorre quando uma fase líquida se forma diretamente em um sólido bifásico.
- Eutectóide: Um sistema eutectóide ocorre quando um sólido monofásico se transforma diretamente em um sólido bifásico.
- Centrado na face: Uma estrutura na qual há um átomo no canto de cada célula e um no centro de cada face, mas nenhum átomo no centro do cubo.
- Ferrite: Ferro cúbico centrado no corpo ou uma liga de ferro com base nesta estrutura.
- Pearlite fina:Resultados de lamelas finas quando as taxas de arrefecimento são aceleradas e a difusão é limitada a distâncias mais curtas.
- Hipereutectoid: Os sistemas hipereutectóides existem abaixo da temperatura do eutectoid.
- Hipoeutectoid: Existem sistemas hipoeutectóides acima da temperatura do eu-tectoide.
- Ledeburite: Eutéctico de ferro fundido. Existe quando o teor de carbono é superior a 2%. Contém 4,3 por cento de carbono em combinação com ferro.
- Liquidus Line: Num diagrama de fases binárias, essa linha ou limite separa as regiões de fase líquida e líquida + fase sólida. Para uma liga, a temperatura do líquido é aquela temperatura na qual uma fase sólida se forma pela primeira vez sob condições de resfriamento de equilíbrio.
- Martensite: Uma fase polimórfica instável do ferro que se forma a temperaturas abaixo do etectoide porque a estrutura cúbica centrada na face da austenite se torna instável. Ela muda espontaneamente para uma estrutura centrada no corpo por ação de tosquia, não por difusão.
- Estrutura microscópica: Estrutura das fases de um material. Só pode ser visto com um mircoscópio óptico ou electrónico.
- Pearlite: Uma mistura lamelar de ferrite e carboneto formada por austenite em decomposição de composição etectóide.
- Fase: Uma porção homogénea de um sistema que tem características físicas e químicas uniformes.
- Digrama de fases: Uma representação gráfica das relações entre restrições ambientais, composição, e regiões de estabilidade de fase, normalmente em condições de equilíbrio.
- Polimórfico: A capacidade de um material sólido existir em mais do que uma forma ou estrutura cristalina.
- Quench: Para esfriar rapidamente – geralmente quando muito rápido para formar Pearlite, e criar Martensite em vez disso
- Linha de Sólido: Num diagrama de fases, o locus dos pontos em que a solidificação está completa no arrefecimento de equilíbrio, ou em que o derretimento começa no aquecimento de equilíbrio.
- Solubilidade: A quantidade de substância que se dissolve numa dada quantidade de outra substância.
DVDs:
Atribuição:
Tratamento térmico

Perguntas:
Afectação: