Klíčová slova
Endosonografie; neuroendokrinní nádory; pankreatektomie
Zkratky
HDRBC: tepelně poškozená červená krvinka; IPAS: intrapankreatická akcesorní slezina; ITP: idiopatická trombocytopenická purpura; SPECT: SPIO: superparamagnetický oxid železitý
ÚVOD
Ektopická akcesorní slezinná tkáň se může nacházet kdekoli podél slezinných cév, ve stěně jejuna, v mezenteriu, ve velkém omentu, v pánvi nebo v levém skrotu. Ačkoli je radiologicky zaznamenána zřídka, je poměrně častá, podle pitevních studií se vyskytuje přibližně u 10 % populace. V 80 % případů se akcesorní slezina nachází v hilu sleziny nebo v jeho blízkosti. Ve zbývajících případech se vyskytuje buď v pankreatickém ocasu, nebo v jeho blízkosti . Přídatné sleziny obvykle nepředstavují žádnou klinickou hrozbu a radiologické nálezy současných pokročilých zobrazovacích technik jsou užitečnými diagnostickými nástroji, které umožňují vyhnout se chirurgickému zákroku . Jedinou bezpečnou diagnostickou metodou je přímý odběr vzorků, pokud při něm nejsou falešně získány buňky pankreatických ostrůvků, jako v našem případě . V tomto sdělení rozebíráme případ chirurgicky léčené intrapankreatické akcesorní sleziny (IPAS), která radiologicky a cytologicky napodobovala neuroendokrinní nádor pankreatu.
POPIS PŘÍPADU
Šedesátiletý muž kavkazské rasy byl odeslán na naši kliniku k dalšímu vyšetření a léčbě náhodného solitárního útvaru, v těle pankreatu, napodobujícího endokrinní nádor. Při rutinním vyšetření byla u pacienta zjištěna mírná elevace karbohydrátového antigenu (CA) 19-9 na 40 U/ml (referenční rozmezí: 0-37 U/ml). Kontrastní spirální počítačová tomografie (CT) prokázala kulatou homogenní lézi o průměru 1,2 cm, která se nacházela v horní části těla pankreatu (obr. 1).
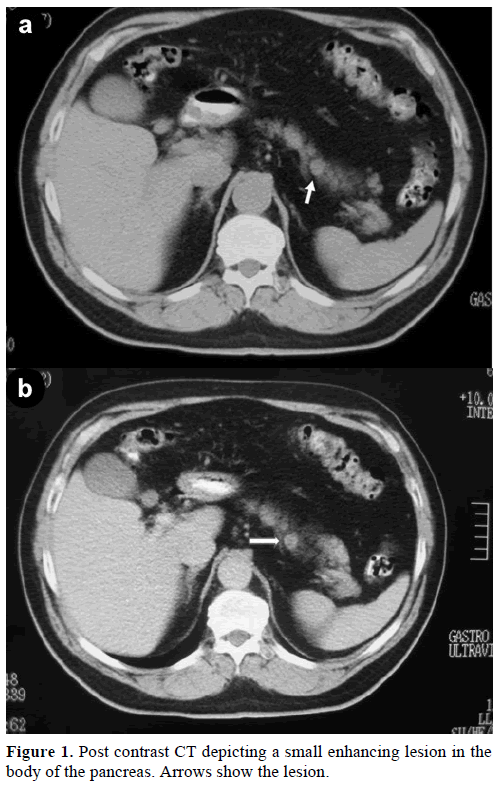
Obr. 1. Léze v horní části těla pankreatu. Postkontrastní CT zobrazující malou enhancující lézi v těle pankreatu. Šipky ukazují lézi.
Kontrastní zobrazení magnetickou rezonancí (MRI) odhalilo kulatou, dobře ohraničenou masu o průměru 1 cm s nízkou intenzitou signálu na T1 vážených snímcích, heterogenním zesílením léze během arteriální fáze na gadoliniem zesílených T1 vážených snímcích a hyperintenzitou na tukem nasycených T2 vážených snímcích (obr. 2).
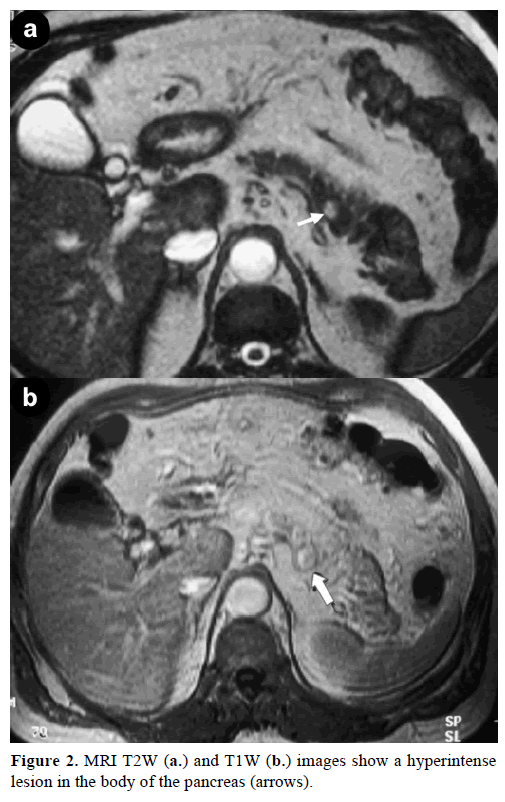
Obrázek 2. Obrazy MRI T2W (a.) a T1W (b.) ukazují hyperintenzitu v těle pankreatu (šipky).
Endoskopická ultrasonografie (EUS) ukázala dobře ohraničený uzel o velikosti asi 1,2 cm, relativně homogenní s dobře ohraničenými a hladkými okraji, zvýšeným krevním zásobením a smíšenou echogenitou. Tyto atributy byly slučitelné s neuroendokrinním nádorem. Útvar se nacházel v těle pankreatu, přímo periferně k celiakálnímu kmeni a mezi pankreatickým vývodem a žaludeční stěnou. Nebyly zaznamenány žádné regionální lymfatické uzliny ani jiné patologické nálezy.
Při aspirační biopsii tenkou jehlou (FNA) pod kontrolou EUS byly nalezeny shluky buněk různé velikosti, imunopozitivní na chromogranin, glukagon, gastrin a somatostatin a s proliferačním indexem Ki-67 nižším než 2 %; tyto nálezy byly morfologicky a imunohistochemicky charakteristické pro neuroendokrinní novotvar (obr. 3).
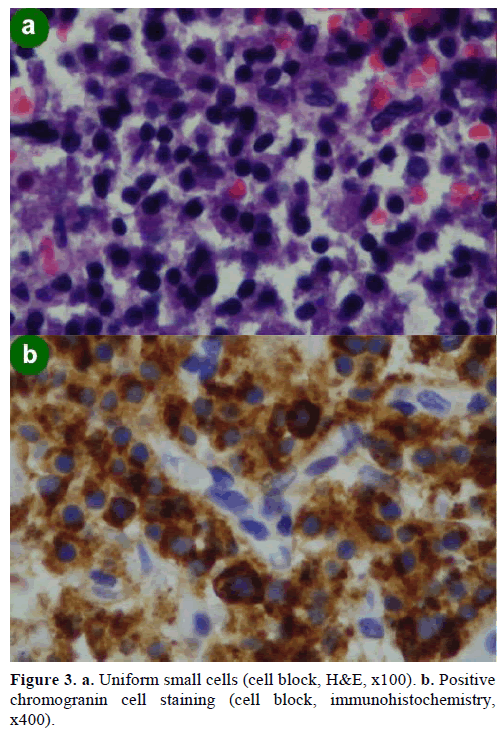
Obrázek 3. a. Uniformní malé buňky (buněčný blok, H&E, x100). b. Pozitivní barvení chromograninových buněk (buněčný blok, imunohistochemie,x400).
Celotělová 111indium-oktreotidová scintigrafie byla negativní na somatostatinové receptory.
Laboratorní vyšetření neodhalila žádné abnormální nálezy ani nádorové markery jako karcinoembryonální antigen (CEA), alfa-fetoprotein (AFP) a CA 19-9 (15 U/ml). Sérové hladiny glukagonu, gastrinu a somatostatinu byly zaznamenány jako 77,2 pg/ml (referenční rozmezí: 30-210 pg/ml), 20 pg/ml (referenční rozmezí: 0-110 pg/ml) a 19,3 pg/ml (referenční rozmezí: 5-27 pg/ml). K vyloučení syndromu mnohočetné endokrinní neoplazie typu 1 (MEN-1) byly měřeny následující sérové hladiny hormonů: parathormon (PTH) intaktní (82,4 pg/ml; referenční rozmezí: 15-65 pg/ml), trijodtyronin (T3: 0,9 ng/ml; referenční rozmezí: 0.7-1,5 ng/ml), tyroxin (T4: 7,4 μg/dl; referenční rozmezí: 4,5- 12 μg/dl), tyreoidální stimulační hormon (TSH: 1,8 μIU/ml; referenční rozmezí: 0,4-4,5 μIU/ml), volný tyroxinový index, (FTI: 9,7 μg/dl; referenční rozmezí: 6,3- 12,4 μg/dl). MRI hypofýzy byla bez pozoruhodností.
Na základě výše uvedených výsledků bylo vysloveno podezření na nefunkční endokrinní tumor a byla provedena distální pankreatektomie se splenektomií. Operační vzorek obsahoval kulatý, dobře ohraničený, hladký, tmavě červený uzel o průměru 1 cm obklopený pankreatickou tkání. Po pečlivém rozřezání nebyly hrubě identifikovány žádné další léze. Mikroskopicky měl uzlík strukturu sleziny. Proto byl útvar diagnostikován jako IPAS (obrázky 4 a 5). Osm lymfatických uzlin, identifikovaných v hilu sleziny, bylo benigních.
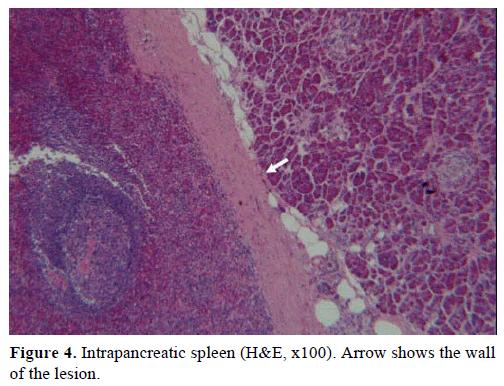
Obrázek č. 4. Intrapankreatická slezina (H&E, x100). Šipka ukazuje stěnu léze.
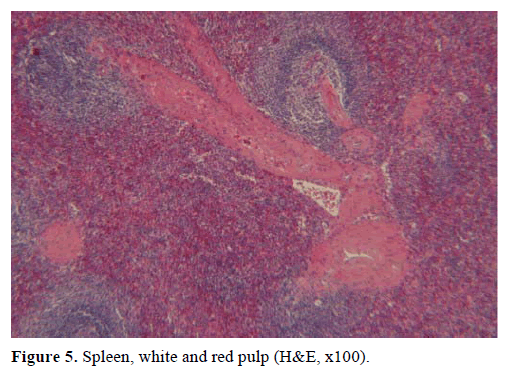
Obrázek 5. Slezina, bílá a červená pulpa (H&E, x100).
DISKUSE
Ektopickou slezinnou tkáň lze rozdělit do dvou kategorií: splenóza v důsledku autotransplantace slezinné tkáně (obvykle po splenektomii) a akcesorní sleziny, které představují vrozená ložiska zdravé slezinné tkáně oddělené od hlavního těla sleziny . Embryologicky je slezina odvozena z mezenchymální tkáně, která leží mezi vrstvami dorzálního mezogastria. Během 6. až 8. týdne života se slezina nachází v těsné blízkosti nejhlavnějšího prodloužení mezonefros . Po splenorenálním splynutí se může akcesorní slezina nacházet pararenálně a retroperitoneálně nebo může sestoupit do pánve či šourku . Při hrubém vyšetření je IPAS obvykle obklopena fibrotickým pouzdrem, které ji odděluje od přilehlého pankreatického parenchymu. Její histologie je podobná ortotopické slezině . Léze nebo procesy týkající se sleziny, jako je hemosideróza, leukémie, lymfom a hypersplenismus, mohou postihnout akcesorní slezinnou tkáň. V diferenciální diagnostice uzlovitých denzit prokázaných radiologickým vyšetřením slinivky břišní je tedy třeba pečlivě pátrat po akcesorní slezině .
O existenci IPAS je třeba uvažovat, pokud má útvar slinivky břišní podobnou denzitu CT a/nebo intenzitu signálu MRI jako slezina, a to na předkontrastních a kontrastem zesílených snímcích všech zobrazovacích modalit. Diagnostickým vodítkem může být zejména nehomogenní zesílení IPAS v jeho časných fázích. Angiografický průkaz krevního zásobení sleziny by mohl být užitečný při vyloučení pankreatického nebo adrenálního tumoru .
Diferenciální diagnóza intra- a peri-pankreatických akcesorních slezin může zahrnovat pankreatické neuroendokrinní tumory, lymfoepiteliální cysty, lymfomy, hypervaskulární metastázy, solidní pseudopapilární tumory a adenokarcinomy pankreatu . V současné době neexistují žádná klinická ani radiografická kritéria pro diagnózu nebo odlišení IPAS od malignity .
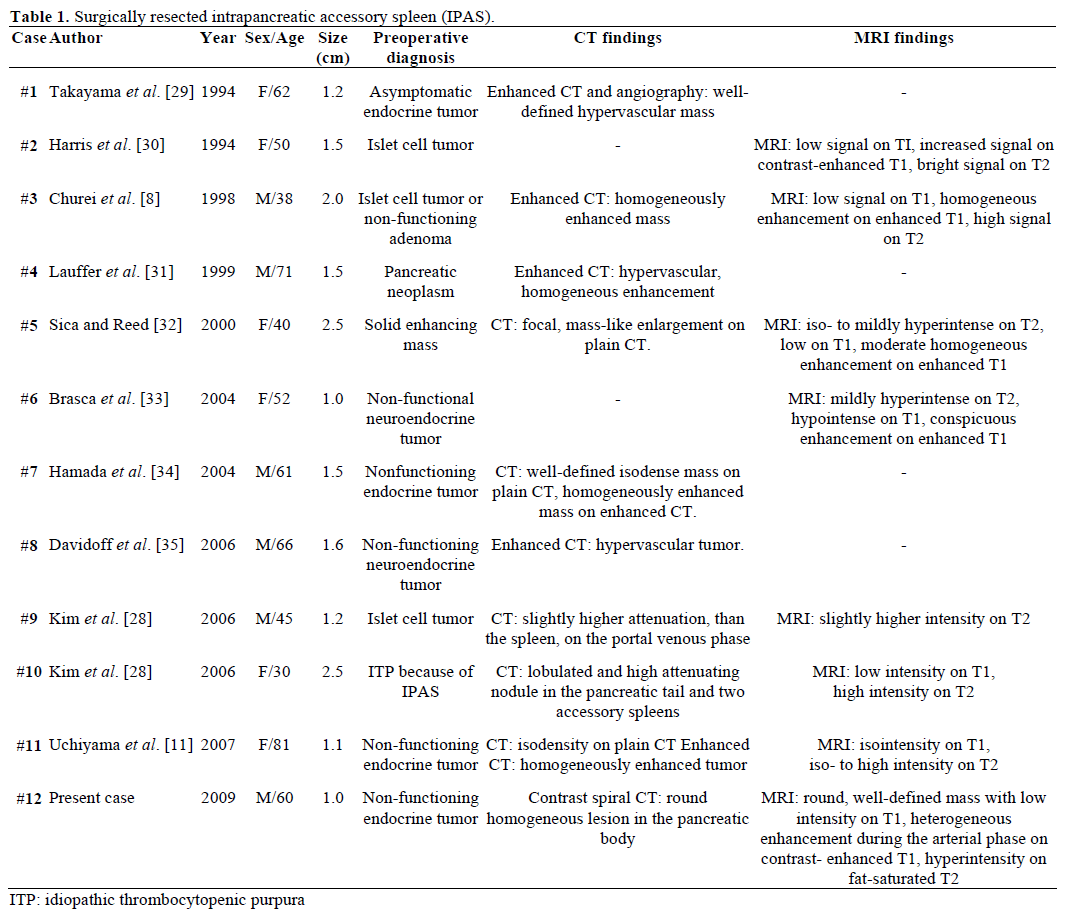
Radiologické nálezy a předoperační diagnóza referovaných, chirurgicky resekovaných a patologicky potvrzených IPAS jsou shrnuty v tabulce 1 . Většina případů byla původně považována za nefunkční endokrinní nádory nebo nádory z ostrůvkových buněk a pouze jeden z dvanácti případů byl předoperačně definitivně diagnostikován jako IPAS po neúspěšné opakované chirurgické léčbě idiopatické trombocytopenické purpury (ITP). Velikost se pohybovala od 1,0 do 2,5 cm, s průměrnou hodnotou 1,55 cm . Nefunkční endokrinní nádory tvoří 15-41 % endokrinních nádorů pankreatu a míra jejich maligní transformace je 62-92 % v závislosti na typu nádoru . Celková resekce nádoru je konečným prediktorem dlouhodobého přežití nezávisle na velikosti, lokalizaci, histologické diferenciaci, postižení lymfatických uzlin a dalších parametrech .
Protože nebyla stanovena žádná hraniční velikost, která by rozlišovala mezi maligními a benigními nefunkčními neuroendokrinními nádory slinivky břišní, navrhuje se, aby všechny tyto nádory větší než 1 cm byly vyříznuty, pokud je pacient vhodným kandidátem pro operaci .
Na základním ultrazvuku ve stupnici šedi je IPAS obvykle vidět jako kulatá nebo oválná masa s mírně echogenní a homogenní strukturou, obklopená rozhraním s vysokou amplitudou a vykazující enhancement za lézí. Při barevném nebo výkonovém dopplerovském ultrazvuku bylo zjištěno charakteristické prokrvení (představující cévní hilus vstupující do masy), které nabízí 90% senzitivitu při diagnostice IPAS . Při kontrastem zesílené ultrasonografii (CEUS) s použitím přípravku Levovist® (Schering, Berlín, Německo) vykazuje IPAS nehomogenní zesílení v časné vaskulární fázi, zesílení podobné zesílení sleziny v postvaskulární fázi a prodloužené zesílení v hepatosplenické parenchymové fázi .
Nález při EUS zahrnuje kulatou až oválnou lézi s ostrými pravidelnými okraji a homogenní texturou echa, od hypo- až po hyperechogenní . FNA cytologie pod EUS kontrolou odhaluje populaci převážně malých lymfocytů a smíšený zánětlivý infiltrát představující bílou pulpu. Pozorována je také nápadná cévní složka tvořená tenkostěnnými cévami, které reprezentují slezinné dutiny, a.. Tyto dutiny jsou dobře patrné na řezu buněčným blokem. Zajímavé je, že baculaté endotelové buňky slezinných sinusů se charakteristicky imunobarví na CD8, který je častěji rozpoznáván jako marker T-buněk. Barvení se zdá být specifické, protože systémové endotelové buňky a hemangiomy jsou pro CD8 negativní . V případech, kdy FNA akcesorní sleziny poskytne pouze lymfocyty bez jiných prvků sleziny, lze použít průtokovou cytometrii a imunohistochemii k vyloučení lymfoproliferativního onemocnění, včetně Hodgkinova lymfomu, i když nelze potvrdit definitivní diagnózu akcesorní sleziny . Schreiner a kol. popsali tři případy IPAS, které byly diagnostikovány pomocí EUS navigované biopsie FNA . V našem případě, pravděpodobně v důsledku odběru vzorků shluků ostrůvkových buněk z přilehlého pankreatického parenchymu, byl stejným postupem indikován neuroendokrinní tumor, což vedlo k chirurgickému přeléčení.
Podobnou falešně pozitivní EUS-FNA, při níž byl pankreatický uzlík sleziny mylně považován za nádor z ostrůvkových buněk, popsali také Ardengh et al . Obecně má EUS-FNA vysokou (80-90%) senzitivitu a specificitu pro neuroendokrinní nádory pankreatu, i když její přesnost pro tyto nádory je považována za nižší než pro adenokarcinom pankreatu . V zájmu minimalizace diagnostických chyb by EUS-FNA malých neuroendokrinních nádorů měl provádět zkušený endoskopista a cytopatologické hodnocení by mělo být kombinováno s imunohistochemií .
99mTechneciová scintigrafie tepelně poškozených červených krvinek (99mTc- HDRBC) v kombinaci s jednofotonovou emisní počítačovou tomografií (SPECT) je vysoce citlivá a specifická metoda pro detekci tkáně sleziny, protože až 90 % injikovaných HDRBC je touto tkání zachyceno . Přestože scintigrafie umožňuje selektivní vizualizaci sleziny s vynikajícím poměrem sleziny k játrům, je vizualizace sleziny stále obtížná v podmínkách, kdy je přítomna minimálně funkční slezinná tkáň, jako v případech akcesorní sleziny . Kromě toho scintigrafie, dokonce i se SPECT, nabízí horší prostorové rozlišení ve srovnání s jinými průřezovými zobrazovacími metodami, jako je CT nebo MRI. Proto se scintigrafie často používá ve spojení s jinými průřezovými zobrazovacími technikami. Navíc se uvádí, že superparamagnetickým oxidem železa (SPIO) zesílená MRI je vynikající alternativou ke scintigrafii 99mTc-HDRBC, pokud má IPAS podobný pokles signálu jako slezina. Kromě uvedeného poklesu signálu je dalším rozdílem mezi IPAS a hypervaskulárními novotvary pankreatu heterogenní zesílení na CT vyšetření v arteriální fázi .
Akcesorické sleziny mohou vyžadovat chirurgickou léčbu, pokud napodobují lymfadenopatie nebo nádory nebo pokud se stanou symptomatickými v důsledku torze, spontánní ruptury, krvácení nebo tvorby cyst. Veškerá funkční slezinná tkáň by měla být odstraněna také při léčbě hematologických onemocnění, jako je ITP.
Závěrem lze říci, že moderní zobrazovací techniky pravděpodobně povedou k tomu, že v budoucnu bude objevován stále větší počet intrapankreatických akcesorních slezin, což bude představovat významnou diagnostickou a terapeutickou výzvu. V takových případech by měly být využity všechny neinvazivní diagnostické prostředky, aby se předešlo zbytečným chirurgickým výkonům a snížila se celková morbidita pacientů .
Konflikt zájmů
Autoři nemají žádný potenciální konflikt zájmů
- Halpert B, Gyorkey F. Léze pozorované v akcesorních slezinách u 311 pacientů. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Accessory spleens in or at the tail of the pancreas (Přídatné sleziny v ocase nebo na ocase slinivky břišní): A survey of 2 700 additional necropsies. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapankreatická akcesorní slezina: nálezy na MR zobrazení, CT, USG a scintigrafii a patologická analýza. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human (Vyvíjející se člověk). Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Příspěvek k embryologii, topografii a patologii ektopické slezinné tkáně. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Accessory spleen in the head of the pancreas (Přídatná slezina v hlavě pankreatu). Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapankreatická akcesorní slezina: kazuistika. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapankreatická akcesorní slezina imitující pankreatickou masu na CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikální pankreatoduodenektomie pro chybně diagnostikovanou pankreatickou masu. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapankreatická akcesorní slezina imitující endokrinní tumor pankreatu: kazuistika a přehled literatury. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomů a nefunkčních endokrinních nádorů pankreatu: Klinická prezentace, diagnostika a pokroky v léčbě. In: Pankreatický karcinom: Mignon M, Jensen RT, eds. Endokrinní nádory slinivky břišní: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Switzerland: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Maligní nefunkční endokrinní nádory pankreatu: prediktivní faktory přežití po chirurgické léčbě. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonografie akcesorní sleziny. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Kontrastní sonografie intrapankreatické akcesorní sleziny u šesti pacientů. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: a potential cause of misdiagnosis at EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnostika případu pomocí aspirační cytologie tenkou jehlou. Acta Cytol 1988; 32:91-3.
- Kraus MD. Histologie a histopatologie sleziny: aktualizace. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. Kazuistika případu. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosis of deep-seated lymphoma and leukemia by endoscopic ultrasound-guided fine-needle aspiration biopsy. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapankreatická akcesorní slezina: mimikry pankreatického endokrinního tumoru diagnostikované pomocí endoskopické ultrazvukem navigované tenkojehlové aspirační biopsie. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. FNA pod EUS kontrolou v diagnostice neuroendokrinních nádorů pankreatu před operací. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapankreatická akcesorní slezina diagnostikovaná pomocí technecium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT a superparamagnetickým oxidem železa (SPIO) zesílené MR nálezy intrapankreatické akcesorní sleziny u sedmi pacientů. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapankreatická akcesorní slezina. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Accessory spleen causing a mass in the tail of the pancreas [Přídatná slezina způsobující útvar v ocase slinivky břišní]: Zobrazovací nálezy na magnetické rezonanci. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapankreatická akcesorní slezina. vzácná příčina pankreatické masy. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapankreatická akcesorní slezina. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapankreatická akcesorní slezina imitující neuroendokrinní tumor: nálezy magnetické rezonance a možná diagnostická role různých testů nukleární medicíny. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Clinical challenges and images in GI. Intrapankreatická akcesorní slezina imitující nefunkční neuroendokrinní tumor. Gastroenterology 2006; 131:350, 689.