Keywords
Endosonografia; Tumores neuroendócrinos; Pancreatectomia
A abreviações
HDRBC: eritrócitos danificados pelo calor; IPAS: baço acessório intrapancreático; ITP: púrpura trombocitopênica idiopática; SPECT: tomografia computadorizada por emissão de fóton único; SPIO: óxido de ferro superparamagnético
INTRODUÇÃO
Ectopic acessório esplênico pode ser encontrado em qualquer lugar ao longo dos vasos esplênicos, na parede do jejuno, no mesentério, no omento maior, na pélvis ou no escroto esquerdo. Embora raramente notado radiologicamente, é relativamente comum, ocorrendo em aproximadamente 10% da população de acordo com estudos de autópsia. Os baços acessórios estão localizados no hilo esplênico ou próximo a ele em 80% dos casos. No restante dos casos, ocorre na cauda do pâncreas ou próximo a ela. Os baços acessórios geralmente não representam nenhuma ameaça clínica e os achados radiológicos das técnicas de imagem atualmente avançadas são ferramentas de diagnóstico úteis para evitar cirurgias. O único método de diagnóstico seguro é a amostragem direta, a menos que produza falsamente células de ilhotas pancreáticas, como no nosso caso. Neste relatório analisamos o caso de um baço acessório intrapancreático tratado cirurgicamente (IPAS) que, radiologicamente e citologicamente, imitou um tumor pancreático neuroendócrino.
RELATÓRIO DO CAASE
Um homem de 60 anos de idade, branco, foi encaminhado à nossa clínica para avaliação e tratamento de uma massa solitária incidental, no corpo do pâncreas, imitando um tumor endócrino. Em um check-up de rotina, o paciente teve uma leve elevação do antígeno carboidrato (CA) de 19-9 a 40 U/mL (faixa de referência: 0-37 U/mL). A tomografia computadorizada (TC) de contraste mostrou uma lesão redonda homogênea, de 1,2 cm de diâmetro, localizada na parte superior do corpo pancreático (Figura 1).
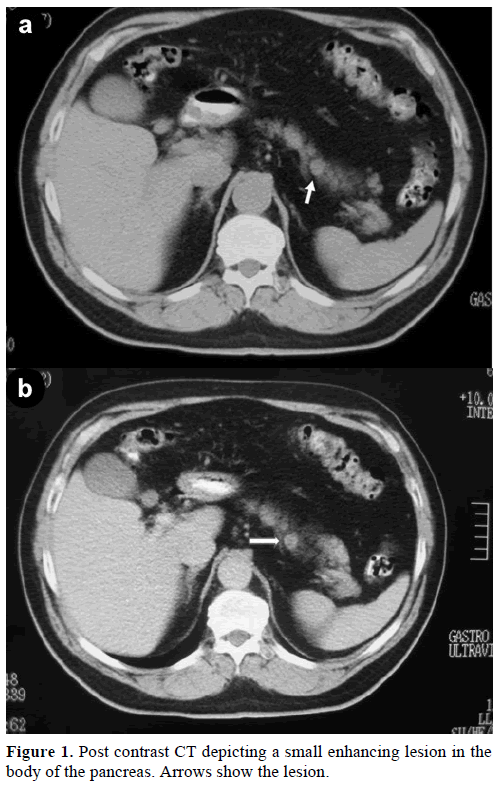
Figure 1. TC pós-contraste representando uma pequena lesão de realce no corpo do pâncreas. As setas mostram a lesão.
Ressonância magnética de contraste (RM) revelou uma massa redonda, bem definida, de 1 cm de diâmetro, com baixo sinal nas imagens ponderadas em T1, realce heterogêneo da lesão durante a fase arterial nas imagens ponderadas em T1 com gadolínio e hiperintensidade nas imagens ponderadas em T2 saturadas de gordura (Figura 2).
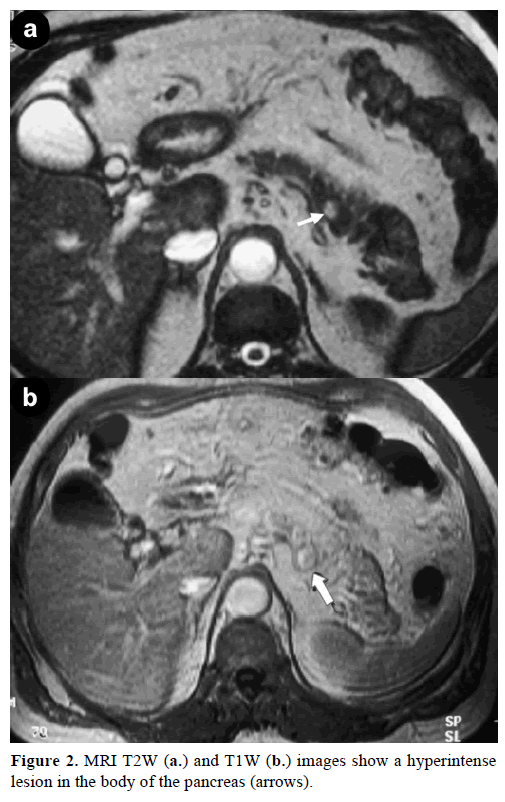
Figure 2. Imagens RM T2W (a.) e T1W (b.) mostram uma hiperintenselização no corpo do pâncreas (setas).
Supra-sonografia endoscópica (EUS) mostrou um nódulo bem delineado, cerca de 1,2 cm de tamanho, relativamente homogêneo com margens bem definidas e suaves, aumento do suprimento sanguíneo e ecogenicidade mista. Estes atributos eram compatíveis com um tumor neuroendócrino. A massa estava localizada no corpo do pâncreas, diretamente perifericamente ao tronco celíaco e entre o ducto pancreático e a parede gástrica. Não foram observados nódulos linfáticos regionais ou outros achados patológicos.
Uma biópsia por aspiração com agulha fina guiada por EUS (FNA) resultou em grupos celulares de vários tamanhos, imunopositivos para cromogranina, glucagon, gastrina e somatostatina e com índice de proliferação Ki-67 inferior a 2%; estes achados foram morfologicamente e imunohistoquimicamente característicos de uma neoplasia neuroendócrina (Figura 3).
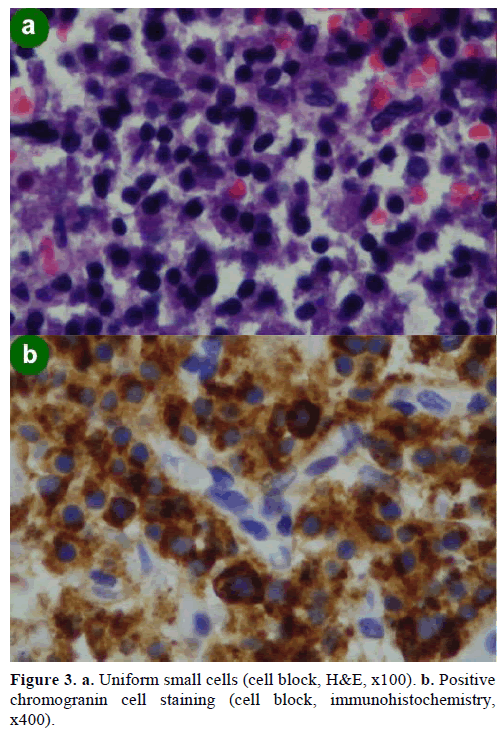
Figure 3. a. Células pequenas uniformes (bloco celular, H&E, x100). b. Coloração de células positivechromogranina (bloco celular, imunohistoquímica,x400).
Cintilografia de todo o corpo 111indium-octreotídeo foi negativa para receptores somatostatina.
Testes laboratoriais não revelaram nenhum achado anormal nem houve marcadores tumorais como antígeno carcinoembrionário (CEA), alfa-fetoproteína (AFP) e CA 19-9 (15 U/mL). Os níveis séricos de glucagon, gastrina e somatostatina foram relatados como 77,2 pg/mL (faixa de referência: 30-210 pg/mL), 20 pg/mL (faixa de referência: 0-110 pg/mL) e 19,3 pg/mL (faixa de referência: 5-27 pg/mL), respectivamente. Para excluir a síndrome de neoplasia endócrina múltipla tipo 1 (MEN-1), foram medidos os seguintes níveis séricos de hormônio: paratormônio (PTH) intacto (82,4 pg/mL; faixa de referência: 15-65 pg/mL), triiodotironina (T3: 0,9 ng/mL; faixa de referência: 0.7-1,5 ng/mL), tiroxina (T4: 7,4 μg/dL; faixa de referência: 4,5- 12 μg/dL), hormônio estimulador da tireóide (TSH: 1,8 μIU/mL; faixa de referência: 0,4-4,5 7μg/mL), índice de tiroxina livre (FTI: 9.μg/dL; faixa de referência: 6,3- 12.μIU/dL). A RM da hipófise não foi notável.
Na base dos resultados acima, suspeitou-se de tumor endócrino não funcional e foi realizada uma pancreatectomia distal com esplenectomia. A peça cirúrgica continha um nódulo redondo, bem demarcado, liso, vermelho escuro, de 1 cm de diâmetro, circundado por tecido pancreático. Não foram identificadas outras lesões grosseiramente, após meticulosa secção. Microscopicamente, o nódulo apresentava a estrutura de um baço. Assim, a massa foi diagnosticada como um IPAS (Figuras 4 e 5). Oito linfonodos, identificados no hilo esplênico, eram benignos.
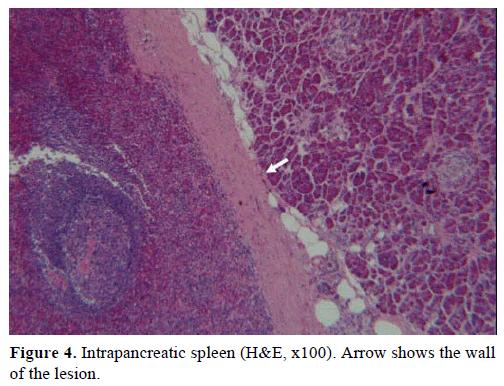
Figure 4. Baço intrapancreático (H&E, x100). A seta mostra o wallof da lesão.
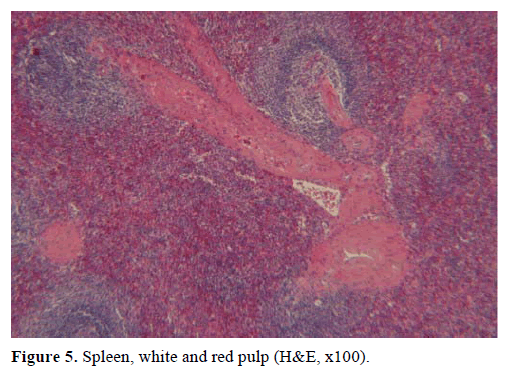
Figura 5. Baço, polpa branca e vermelha (H&E, x100).
DISCUSSÃO
Tecido esplênico ectópico pode ser classificado em duas categorias: esplenose devida ao autotransplante de tecido esplênico (geralmente após esplenectomia) e baços acessórios que constituem focos congênitos de tecido esplênico saudável separado do corpo principal do baço . Embriologicamente, o baço é derivado do tecido mesenquimatoso que se encontra entre as camadas do mesogástrio dorsal. Durante a 6ª a 8ª semana de vida, o baço está muito próximo da extensão mais cefálica do mesonefrócito. Após a fusão esplenorenal, um baço acessório pode ser encontrado parenalmente e retroperitonealmente ou pode descer para a pélvis ou escroto. Ao exame grosseiro, um IPAS é geralmente cercado por uma cápsula fibrótica que o separa do parênquima pancreático adjacente. Sua histologia é semelhante à do baço ortotópico. Lesões ou processos relativos ao baço, tais como hemossiderose, leucemia, linfoma e hiperesplenismo podem afetar o tecido esplênico acessório. Assim, a busca cuidadosa de baços acessórios deve ser considerada no diagnóstico diferencial das densidades nodulares demonstradas pelo estudo radiológico do pâncreas .
A existência de um IPAS deve ser considerada quando uma massa pancreática tem densidades de sinal de TC e/ou RM semelhantes às do baço, sobre as imagens pré-contraste e contrastadas de todas as modalidades de imagem. Em particular, o realce não homogêneo de um IPAS em suas fases iniciais pode ser uma pista de diagnóstico. A demonstração angiográfica de um suprimento sanguíneo esplênico pode ser útil para excluir um tumor pancreático ou adrenal .
O diagnóstico diferencial para baço acessório intra e peri-pancreático pode incluir tumores neuroendócrinos pancreáticos, cistos linfoepiteliais, linfomas, metástases hipervasculares, pseudopapilares sólidos e adenocarcinomas pancreáticos . Atualmente, não há critérios clínicos ou radiográficos para o diagnóstico ou diferenciação de uma IPAS de uma malignidade .
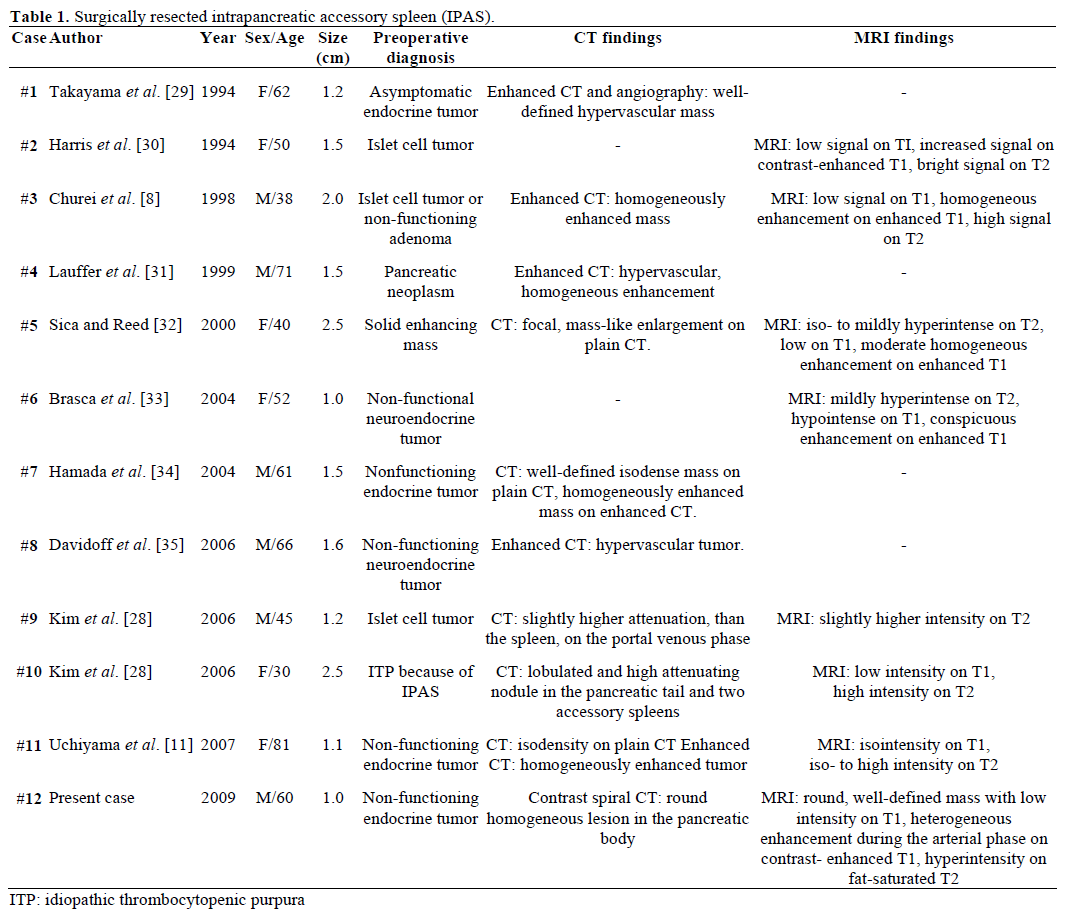
Os achados radiológicos e o diagnóstico pré-operatório da IPAS referida, ressecada cirurgicamente e confirmada patologicamente estão resumidos na Tabela 1. A maioria dos casos foi inicialmente considerada como sendo tumores endócrinos não funcionais ou tumores de células de ilhotas e apenas um em doze casos foi conclusivamente diagnosticado no pré-operatório como IPAS após tratamento cirúrgico repetitivo sem sucesso da púrpura trombocitopênica idiopática (PTI). O tamanho variou de 1,0 a 2,5 cm, com um valor médio de 1,55 cm . Os tumores endócrinos não funcionais são responsáveis por 15-41% dos tumores endócrinos do pâncreas e a taxa de sua transformação maligna é de 62-92%, dependendo do tipo de tumor . A ressecção total do tumor é o preditor final da sobrevida a longo prazo, independentemente do tamanho, localização, diferenciação histológica, envolvimento dos gânglios linfáticos e outros parâmetros .
Desde que não foi estabelecido um tamanho de corte para diferenciar entre tumores neuroendócrinos malignos e benignos não funcionais do pâncreas, tem sido sugerido que todos esses tumores superiores a 1 cm devem ser excisados se o paciente for um bom candidato à cirurgia .
Na ultra-sonografia de base em escala de cinza, uma IPAS é geralmente vista como uma massa redonda ou oval com uma textura ligeiramente ecogênica e homogênea, circundada por uma interface de alta amplitude e mostrando realce por trás da lesão. No ultra-som Doppler colorido ou de potência, um suprimento sanguíneo característico (representando o hilo vascular que entra na massa), tem sido relatado para oferecer uma sensibilidade de 90% no diagnóstico de um IPAS . Na ultrassonografia com contraste (CEUS) usando Levovist® (Schering, Berlim, Alemanha), uma IPAS mostra realce não homogêneo na fase vascular inicial, realce semelhante ao do baço durante a fase pós-vascular e realce prolongado na fase parenquimatoscópica hepatoesplênica .
Apeso na EUS inclui uma lesão redonda aoval com margens regulares agudas e textura de eco homogênea, variando de hipo a hiper-ecóico . A citologia do FNA guiado por EUS revela uma população de linfócitos predominantemente pequenos e um infiltrado inflamatório misto representando polpa branca. Um componente vascular conspícuo composto por vasos sanguíneos de paredes finas representando os seios esplênicos também é observado. Estes seios nasais são bem-visualizados em secções de blocos celulares. Curiosamente, as células endoteliais dos seios esplênicos são caracteristicamente imunes ao CD8, que é mais comumente reconhecido como um marcador de células T. A coloração parece ser específica, porque células endoteliais sistêmicas e hemangiomas são negativos para CD8 . Em casos onde o FNA do baço acessório produz apenas linfócitos, sem outros elementos esplênicos, a citometria de fluxo e a imunohistoquímica podem ser empregadas para excluir uma doença linfoproliferativa, incluindo o linfoma de Hodgkin, mesmo que um diagnóstico definitivo de baço acessório não possa ser confirmado. Schreiner et al. relataram três casos de IPAS sendo diagnosticados por biópsia de FNA guiada pela EUS. No nosso caso, provavelmente devido à amostragem de grupos de células de ilhotas do parênquima pancreático adjacente, o mesmo procedimento foi indicativo de um tumor neuroendócrino, levando a um supertratamento cirúrgico.
Um falso positivo semelhante EUS-FNA, no qual um nódulo esplênico pancreático foi confundido com um tumor de células de ilhotas também foi relatado por Ardengh et al. Em geral, o EUS-FNA tem uma alta (80-90%) sensibilidade e especificidade para tumores neuroendócrinos pancreáticos, embora sua precisão para tais tumores seja considerada inferior à do adenocarcinoma pancreático. A fim de minimizar erros diagnósticos, o EUS-FNA de pequenos tumores neuroendócrinos deve ser realizado por endoscopistas experientes e a avaliação citopatológica deve ser combinada com a imuno-histoquímica.
99mTechnetium – células vermelhas danificadas por calor (99mTc- HDRBC) – a cintilografia, combinada com a tomografia computadorizada por emissão de fóton único (SPECT), é um método altamente sensível e específico para detecção de tecido esplênico, uma vez que até 90% dos HDRBC injetados são aprisionados por este tecido . Embora a cintilografia permita a visualização selectiva do esplênico com uma excelente relação baço/fígado, a visualização do esplênico ainda é difícil em condições nas quais o tecido esplênico funciona minimamente, como nos casos de baços acessórios . Além disso, a cintilografia, mesmo com SPECT, oferece resolução espacial inferior à de outras modalidades de imagem transversal, como a TC ou a RM. Portanto, a cintilografia é freqüentemente utilizada em conjunto com outras técnicas de imagem de corte transversal. Além disso, a RM com óxido de ferro superparamagnético (SPIO) é relatada como uma excelente alternativa à cintilografia de 99mTc-HDRBC, quando uma IPAS tem uma queda de sinal semelhante à do baço. Além da referida queda de sinal, outra diferença entre IPASs e neoplasias pancreáticas hipervasculares é o realce heterogêneo na tomografia de fase arterial .
Baço acessório pode precisar de tratamento cirúrgico quando imitam linfadenopatias ou tumores, ou quando se tornam sintomáticos devido à torção, ruptura espontânea, hemorragia ou formação de cisto. Todo o tecido esplênico funcional também deve ser removido para o tratamento de distúrbios hematológicos como ITP.
Em conclusão, as técnicas modernas de imagem provavelmente levarão a um número crescente de baços acessórios intrapancreáticos a serem descobertos no futuro, representando desafios diagnósticos e terapêuticos significativos. Nesses casos, todos os meios de diagnóstico não invasivos devem ser utilizados para evitar procedimentos cirúrgicos desnecessários e diminuir a morbidade geral do paciente .
Conflito de interesse
Os autores não têm conflitos de interesse potenciais
- Halpert B, Gyorkey F. Lesões observadas em baços acessórios de 311 pacientes. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Baços acessórios no pâncreas ou na cauda do pâncreas: Um levantamento de 2.700 necropsias adicionais. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Baço acessório intrapancreático: achados sobre imagens de RM, TC, US e cintilografia, e a análise patológica. Coreano J Radiol 2008; 9:162-74.
- Moore K. O humano em desenvolvimento. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Baço acessório na cauda pancreática — uma entidade negligenciada? Uma contribuição para a embriologia, topografia e patologia do tecido ectópico esplênico. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Baço acessório na cabeça do pâncreas. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Baço acessório intrapancreático: relato de caso. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Baço acessório intrapancreático imitando massa pancreática na TC. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Pancreatoduodenectomia radical para massa pancreática mal-diagnosticada. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Baço acessório intrapancreático imitando tumor endócrino do pâncreas: relato de caso e revisão da literatura. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomas e tumores endócrinos pancreáticos não funcionais: Apresentação clínica, diagnóstico e avanços no manejo. In: Mignon M, Jensen RT, eds. Tumores endócrinos do pâncreas: Avanços recentes na pesquisa e no manejo. Fronteiras da Pesquisa Gastrointestinal. Basiléia, Suíça: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Tumores Endócrinos do Pâncreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Tumores endócrinos malignos não funcionais do pâncreas: fatores preditivos de sobrevivência após tratamento cirúrgico. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Cirurgia de tumores neuroendócrinos do pâncreas ressecáveis e não funcionais. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonografia do baço acessório. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Sonografia de contraste do baço acessório intrapancreático em seis pacientes. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Baço acessório: uma causa potencial de diagnóstico errado na EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Esplenose torácica diagnosticada por citologia por aspiração de fineneedle: um relato de caso. Diagnóstico Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnóstico de um caso por citologia por aspiração fina da agulha. Acta Cytol 1988; 32:91-3.
- Kraus MD. Histologia esplênica e histopatologia: uma atualização. Semin Diagnostic Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Aspiração fina da esplenose torácica com agulha. Relato de um caso. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnóstico de linfoma de sede profunda e leucemia por biópsia endoscópica guiada por ultra-som de aspiração fina de agulha. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Baço acessório intrapancreático: imitação de tumor endócrino pancreático diagnosticado por biópsia de aspiração de agulha fina guiada por ultra-som endoscópico. Diagnóstico Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. FNA guiado por EUS no diagnóstico de tumores neuroendócrinos pancreáticos antes da cirurgia. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Valor da biópsia endoscópica por aspiração com agulha fina guiada por ultra-som no diagnóstico de massas pancreáticas sólidas. Intestino 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Baço acessório intrapancreático diagnosticado por tecnécio-99m de células vermelhas danificadas por calor SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT e óxido de ferro superparamagnético (SPIO) – achados de RM do baço intrapancreático acessório em sete pacientes. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Baço acessório intrapancreático. Lanceta. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Baço acessório causando uma massa na cauda do pâncreas: Imagens de RM. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Baço acessório intrapancreático. Uma causa rara de massa pancreática. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Baço acessório intra-pancreático. Radiologia 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Baço acessório intrapancreático imitando um tumor neuroendócrino: achados de ressonância magnética e possível papel diagnóstico de diferentes testes de medicina nuclear. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Ressecção laparoscópica da cauda do pâncreas para um baço acessório intrapancreático imitando um tumor endócrino não funcional: relato de um caso. Surgido hoje 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Desafios clínicos e imagens em GI. Baço acessório intrapancreático imitando tumor neuroendócrino não funcional. Gastroenterologia 2006; 131:350, 689.