Keywords
Endosonografie; Neuro-endocriene Tumoren; Pancreatectomie
Afkortingen
HDRBC: door warmte beschadigde rode bloedcel; IPAS: intrapancreatische accessoire milt; ITP: idiopathische trombocytopenische purpura; SPECT: single photon emission computed tomography; SPIO: superparamagnetisch ijzeroxide
INTRODUCTIE
Ectopisch accessoir miltweefsel kan overal worden aangetroffen langs de miltvaten, in de wand van het jejunum, in het mesenterium, in het grote omentum, in het bekken of in het linker scrotum. Hoewel radiologisch zelden waargenomen, komt het relatief vaak voor, bij ongeveer 10% van de bevolking volgens autopsiestudies. In 80% van de gevallen bevindt de bijholte zich op of nabij het hilum van de milt. In de rest van de gevallen bevindt de milt zich in de pancreastaart of in de nabijheid daarvan. Accessoire milten vormen gewoonlijk geen klinische bedreiging en de radiologische bevindingen van de huidige geavanceerde beeldvormingstechnieken zijn nuttige diagnostische hulpmiddelen om chirurgie te vermijden. De enige veilige diagnostische methode is directe bemonstering, tenzij deze ten onrechte pancreatische isletcellen oplevert, zoals in ons geval. In dit rapport analyseren we het geval van een chirurgisch behandelde intrapancreatische accessoire milt (IPAS) die radiologisch en cytologisch een neuro-endocriene pancreastumor nabootste.
CASE REPORT
Een 60-jarige Kaukasische man werd naar onze kliniek verwezen voor verdere evaluatie en behandeling van een incidentele solitaire massa, in het lichaam van de pancreas, die een endocriene tumor nabootste. Bij een routinecontrole had de patiënt een lichte verhoging van het carbohydraat antigeen (CA) 19-9 tot 40 U/mL (referentiebereik: 0-37 U/mL). Contrast spiraal computertomografie (CT) toonde een ronde homogene laesie, 1,2 cm in diameter, gelegen in het bovenste deel van het pancreaslichaam (figuur 1).
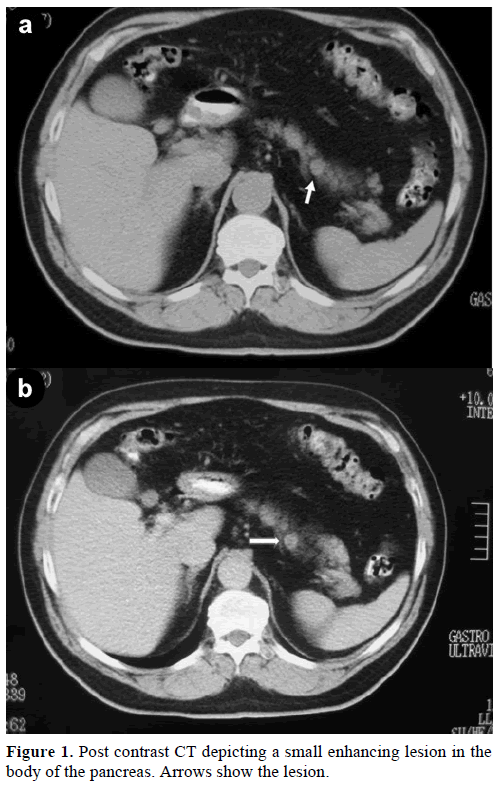
Figuur 1. CT-scan na contrast toont een kleine, versterkende laesie in het pancreaslichaam. Pijlen tonen de laesie.
Contrast magnetische resonantiebeeldvorming (MRI) toonde een ronde, goed gedefinieerde massa, 1 cm in diameter, met lage signaalintensiteit op T1-gewogen beelden, heterogene laesieverhoging tijdens de arteriële fase op gadolinium-verrijkte T1-gewogen beelden en hyperintensiteit op vetverzadigde T2-gewogen beelden (figuur 2).
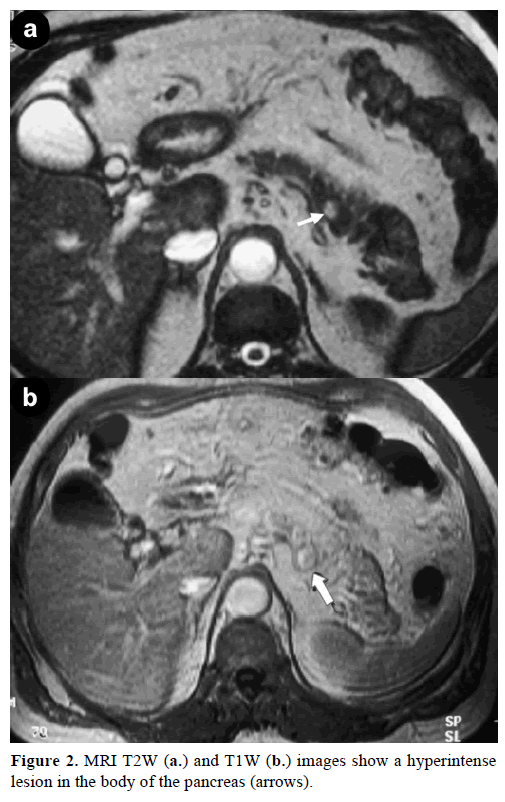
Figuur 2. MRI T2W (a.) en T1W (b.) beelden tonen een hyperintenselesie in het lichaam van de pancreas (pijlen).
Endoscopische ultrasonografie (EUS) toonde een goed afgelijnde knobbel, ongeveer 1,2 cm groot, relatief homogeen met goed gedefinieerde en gladde marges, verhoogde bloedtoevoer en gemengde echogeniciteit. Deze kenmerken waren verenigbaar met een neuro-endocriene tumor. De massa bevond zich in het lichaam van de pancreas, direct perifeer van de coeliacale stam en tussen de pancreaskanalen en de maagwand. Er werden geen regionale lymfeklieren of andere pathologische bevindingen vastgesteld.
Een EUS-geleide fijne naald aspiratie (FNA) biopsie resulteerde in celclusters van verschillende grootte, immunopositief voor chromogranine, glucagon, gastrine en somatostatine en met een Ki-67 proliferatie-index minder dan 2%; deze bevindingen waren morfologisch en immunohistochemisch kenmerkend voor een neuro-endocriene neoplasma (figuur 3).
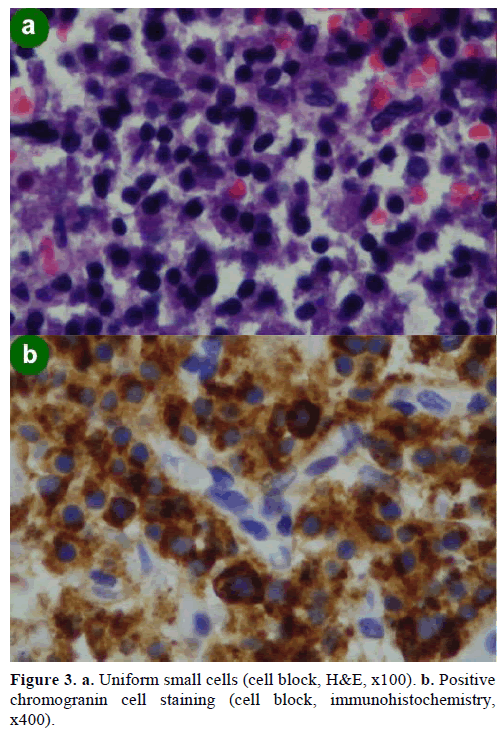
Figuur 3. a. Uniforme kleine cellen (celblok, H&E, x100). b. Positieve chromograninecelkleuring (celblok, immunohistochemie, x400).
Whole body 111indium-octreotide scintigrafie was negatief voor somatostatinereceptoren.
laboratoriumtests toonden geen abnormale bevindingen, noch tumormarkers zoals carcino-embryonaal antigeen (CEA), alfa-foetoproteïne (AFP) en CA 19-9 (15 U/mL). Serumspiegels van glucagon, gastrine en somatostatine werden gerapporteerd als respectievelijk 77,2 pg/mL (referentiebereik: 30-210 pg/mL), 20 pg/mL (referentiebereik: 0-110 pg/mL) en 19,3 pg/mL (referentiebereik: 5-27 pg/mL). Om het multipele endocriene neoplasie type 1 syndroom (MEN-1) uit te sluiten, werden de volgende serum hormoonspiegels gemeten: parathormoon (PTH) intact (82,4 pg/mL; referentiebereik: 15-65 pg/mL), triiodothyronine (T3: 0,9 ng/mL; referentiebereik: 0.7-1,5 ng/mL), thyroxine (T4: 7,4 μg/dL; referentiebereik: 4,5- 12 μg/dL), schildklier stimulerend hormoon (TSH: 1,8 μIU/mL; referentiebereik: 0,4-4,5 μIU/mL), vrije thyroxine-index, (FTI: 9,7μg/dL; referentiebereik: 6,3- 12,4μg/dL). MRI van de hypofyse was onopvallend.
Op basis van de bovenstaande resultaten werd een niet-functionerende endocriene tumor verdacht en een distale pancreatectomie met splenectomie werd uitgevoerd. Het chirurgisch preparaat bevatte een ronde, goed begrensde, gladde, donkerrode knobbel, 1 cm in diameter, omgeven door pancreasweefsel. Na zorgvuldige sectie werden geen andere laesies grof vastgesteld. Microscopisch had de knobbel de structuur van een milt. Bijgevolg werd de massa gediagnosticeerd als een IPAS (Figuren 4 en 5). Acht lymfeklieren, geïdentificeerd aan het milthilum, waren goedaardig.
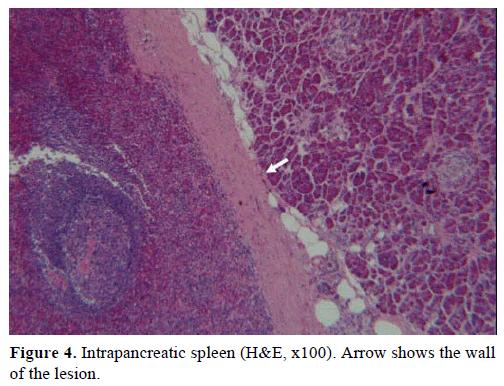
Figuur 4. Intrapancreatische milt (H&E, x100). Pijl toont de wand van de laesie.
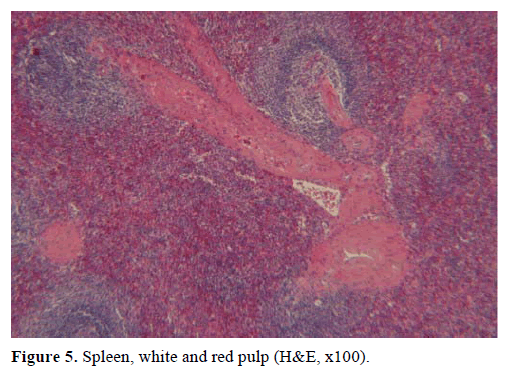
Figuur 5. Milt, witte en rode pulp (H&E, x100).
DISCUSSIE
Ectopisch miltweefsel kan in twee categorieën worden ingedeeld: splenose als gevolg van autotransplantatie van miltweefsel (meestal na splenectomie) en accessoire milten die congenitale foci vormen van gezond miltweefsel dat gescheiden is van het hoofdlichaam van de milt. Embryologisch gezien is de milt afgeleid van mesenchymaal weefsel dat tussen de lagen van het dorsale mesogastrium ligt. Tijdens de 6e tot en met de 8e levensweek bevindt de milt zich dicht bij de meest cefhaladische extensie van de mesonefros. Na de samensmelting van de milt met de miltoren kan een bijkomende milt pararenaal en retroperitoneaal worden aangetroffen of in het bekken of scrotum neerdalen. Bij macroscopisch onderzoek is een IPAS gewoonlijk omgeven door een fibrotisch kapsel dat het scheidt van het aangrenzende pancreasparenchym. De histologie is vergelijkbaar met die van de orthotope milt. Letsels of processen met betrekking tot de milt, zoals hemosiderose, leukemie, lymfoom en hypersplenisme kunnen bijkomend miltweefsel aantasten. Daarom moet een zorgvuldige zoektocht naar accessoire milten worden overwogen in de differentiële diagnose van nodulaire verdichtingen aangetoond door radiologisch onderzoek van de alvleesklier.
Het bestaan van een IPAS moet worden overwogen wanneer een pancreasmassa de CT-dichtheden en/of MRI-signaalintensiteiten heeft die vergelijkbaar zijn met die van de milt, op de precontrast en contrast-verrijkte beelden van alle beeldvormingsmodaliteiten. Met name de inhomogene versterking van een IPAS in de vroege stadia kan een diagnostische aanwijzing zijn. Angiografisch aantonen van een bloedtoevoer naar de milt kan nuttig zijn bij het uitsluiten van een pancreas- of een bijniertumor.
Differentiële diagnose voor intra- en peri-pancreatische accessoire milt kan omvatten pancreas neuro-endocriene tumoren, lymfe-epitheliale cysten, lymfomen, hypervasculaire metastasen, solide pseudopapillaire tumoren en pancreas adenocarcinomen. Momenteel zijn er geen klinische of radiografische criteria voor de diagnose of differentiatie van een IPAS van een maligniteit .
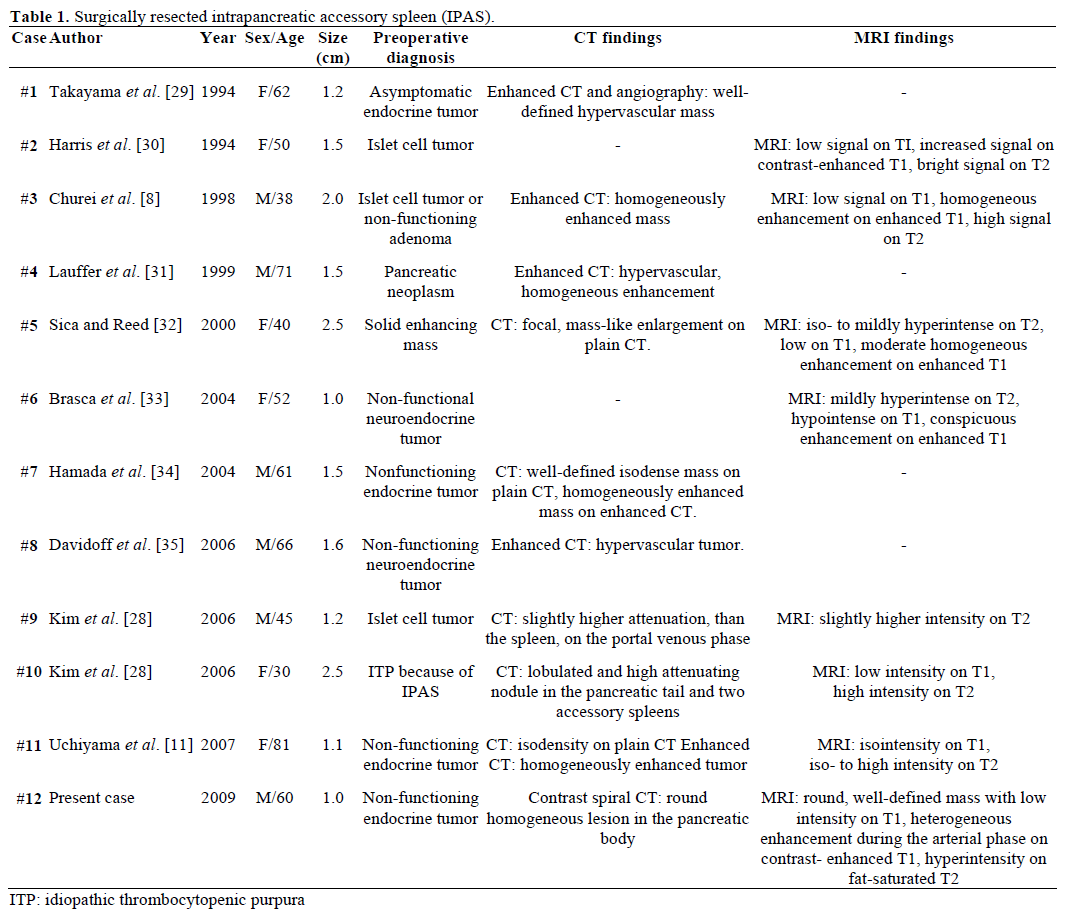
De radiologische bevindingen en preoperatieve diagnose van de verwezen, chirurgisch geresecteerde en pathologisch bevestigde IPAS zijn samengevat in tabel 1. De meeste gevallen werden aanvankelijk beschouwd als niet-functionerende endocriene tumoren of islet celtumoren en slechts één op de twaalf gevallen werd preoperatief definitief gediagnosticeerd als een IPAS na onsuccesvolle herhaalde chirurgische behandeling voor idiopathische trombocytopenische purpura (ITP). De grootte varieerde van 1,0 tot 2,5 cm, met een gemiddelde waarde van 1,55 cm . Niet-functionerende endocriene tumoren maken 15-41% uit van de endocriene pancreastumoren en het percentage van hun maligne transformatie is 62-92%, afhankelijk van het type tumor . Totale tumorresectie is de ultieme voorspeller van overleving op lange termijn, onafhankelijk van grootte, lokalisatie, histologische differentiatie, lymfeklierbetrokkenheid en andere parameters.
Omdat er geen afkapmaat is vastgesteld om onderscheid te maken tussen kwaadaardige en goedaardige niet-functionerende neuro-endocriene tumoren van de pancreas, is gesuggereerd dat al dergelijke tumoren groter dan 1 cm moeten worden geëxcideerd als de patiënt een goede kandidaat is voor chirurgie.
Op grijs-schaal baseline echografie, wordt een IPAS meestal gezien als een ronde of ovale massa met een mild echogene en homogene textuur, omgeven door een hoge amplitude interface en met enhancement achter de laesie. Bij kleuren- of power-Doppler-echografie is een karakteristieke bloedtoevoer (die het vasculaire hilum vertegenwoordigt dat de massa binnendringt) gemeld met een gevoeligheid van 90% bij de diagnose van een IPAS . Bij contrastversterkende echografie (CEUS) met Levovist® (Schering, Berlijn, Duitsland) vertoont een IPAS een inhomogene versterking in de vroege vasculaire fase, een soortgelijke versterking als die van de milt in de postvasculaire fase en een langdurige versterking in de hepatosplenische parenchymale fase.
De bevindingen bij EUS omvatten een ronde tot ovale laesie met scherpe, regelmatige marges en een homogene echostructuur, variërend van hypo- tot hypo-echoïsch. EUS-geleide FNA-cytologie onthult een populatie van overwegend kleine lymfocyten en een gemengd ontstekingsinfiltraat dat witte pulpa vertegenwoordigt. Een opvallende vasculaire component, bestaande uit dunwandige bloedvaten die de sinussen van de milt vertegenwoordigen, wordt ook waargenomen. Deze sinussen zijn goed zichtbaar op celbloksecties. Interessant is dat de mollige sinus-endotheliale cellen van de milt kenmerkend immunokleuren vertonen voor CD8, dat meer algemeen wordt herkend als een T-celmerker. De kleuring lijkt specifiek te zijn, omdat systemische endotheelcellen en hemangiomen negatief zijn voor CD8. In gevallen waarin een FNA van de milt alleen lymfocyten oplevert, zonder andere miltelementen, kunnen flowcytometrie en immunohistochemie worden gebruikt om een lymfoproliferatieve aandoening uit te sluiten, waaronder Hodgkin-lymfoom, zelfs als de definitieve diagnose van een milt-accessoire niet kan worden bevestigd. Schreiner et al. meldden drie gevallen van IPAS die werden gediagnosticeerd door EUS-geleide FNA-biopsie. In ons geval, waarschijnlijk als gevolg van bemonstering van eilandjescelclusters uit het aangrenzende pancreasparenchym, was dezelfde procedure indicatief voor een neuro-endocriene tumor, wat leidde tot chirurgische overbehandeling.
Een vergelijkbare fout-positieve EUS-FNA, waarbij een pancreas-spleneknobbel werd aangezien voor een eilandjesceltumor, is ook gemeld door Ardengh et al. In het algemeen heeft EUS-FNA een hoge (80-90%) sensitiviteit en specificiteit voor pancreas neuro-endocriene tumoren, hoewel de nauwkeurigheid voor dergelijke tumoren als lager wordt beschouwd dan die voor pancreas adenocarcinoom . Om diagnostische fouten te minimaliseren, moet EUS-FNA van kleine neuro-endocriene tumoren worden uitgevoerd door ervaren endoscopisten en moet cytopathologische beoordeling worden gecombineerd met immunohistochemie .
99mTechnetium heat-damaged red blood cells (99mTc- HDRBC) scintigrafie, gecombineerd met single photon emissie computertomografie (SPECT), is een zeer gevoelige en specifieke methode voor detectie van splenisch weefsel, aangezien tot 90% van de geïnjecteerde HDRBCs door dit weefsel worden gevangen . Hoewel scintigrafie selectieve visualisatie van de milt mogelijk maakt met een uitstekende milt/lever-verhouding, is visualisatie van de milt nog steeds moeilijk in omstandigheden waarin minimaal functionerend miltweefsel aanwezig is, zoals in gevallen van accessoire milten. Bovendien biedt scintigrafie, zelfs met SPECT, een inferieure ruimtelijke resolutie in vergelijking met andere modaliteiten voor transversale beeldvorming, zoals CT of MRI. Daarom wordt scintigrafie vaak gebruikt in combinatie met andere transversale beeldvormingstechnieken. Bovendien wordt superparamagnetisch ijzeroxide (SPIO)-verrijkte MRI gerapporteerd als een uitstekend alternatief voor 99mTc-HDRBC-scintigrafie, wanneer een IPAS een signaaldaling heeft die vergelijkbaar is met die van de milt. Naast de bedoelde signaaldaling is een ander verschil tussen IPAS’s en hypervasculaire pancreasneoplasma’s de heterogene versterking op arteriële fase CT-scan.
Accessoire milten kunnen chirurgische behandeling vereisen wanneer zij lymfadenopathieën of tumoren imiteren, of wanneer zij symptomatisch worden door torsie, spontane ruptuur, bloeding of cystevorming. Al het functionele miltweefsel moet ook worden verwijderd voor de behandeling van hematologische aandoeningen zoals ITP.
In conclusie, moderne beeldvormingstechnieken zullen er waarschijnlijk toe leiden dat in de toekomst een toenemend aantal intrapancreatische accessoire milten zal worden ontdekt, wat aanzienlijke diagnostische en therapeutische uitdagingen met zich meebrengt. In dergelijke gevallen moeten alle niet-invasieve diagnostische middelen worden gebruikt om onnodige chirurgische ingrepen te vermijden en de totale morbiditeit van de patiënt te verminderen.
Conflict of interest
De auteurs hebben geen potentiële belangenconflicten
- Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Accessoire milten in of aan de staart van de pancreas: A survey of 2,700 additional necropsies. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapancreatic accessoire milt: bevindingen op MR Imaging, CT, US en scintigrafie, en de pathologische analyse. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Een bijdrage tot de embryologie, topografie en pathologie van ectopisch miltweefsel. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Accessory spleen in the head of the pancreas. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreatic accessory spleen: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapancreatic accessory spleen mimicking pancreatic mass on CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radical pancreatoduodenectomy for misdiagnosed pancreatic mass. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapancreatic accessory spleen mimicking endocrine tumor of the pancreas: case report and review of the literature. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomas en niet-functionerende endocriene pancreastumoren: Klinische presentatie, diagnose, en vooruitgang in het beheer. In: Mignon M, Jensen RT, eds. Endocriene Tumoren van de Pancreas: Recent Advances in Research and Management. Grenzen van Gastro-intestinaal Onderzoek. Basel, Zwitserland: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumors of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Maligne niet-functionerende endocriene tumoren van de pancreas: voorspellende factoren voor overleving na chirurgische behandeling. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonography of the accessory spleen. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Contrast-enhanced sonography of intrapancreatic accessory spleen in six patients. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: a potential cause of misdiagnosis at EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnosis of a case by fine needle aspiration cytology. Acta Cytol 1988; 32:91-3.
- Kraus MD. Splenic histologie en histopathologie: een update. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. A case report. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosis of deep-seated lymphoma and leukemia by endoscopic ultrasound-guided fine-needle aspiration biopsy. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreatic accessory spleen: mimic of pancreatic endocrine tumor diagnosed by endoscopic ultrasound-guided fine-needle aspiration biopsy. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-guided FNA in the diagnosis of pancreatic neuroendocrine tumors before surgery. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT and superparamagnetic iron oxide (SPIO)-enhanced MR findings of intrapancreatic accessory spleen in seven patients. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreatic accessoire milt. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Accessory spleen causing a mass in the tail of the pancreas: MR imaging bevindingen. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapancreatic accessoire milt.Een zeldzame oorzaak van pancreas massa. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiologie 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatic accessory spleen mimicking a neuroendocrine tumor: magnetic resonance findings and possible diagnostic role of different nuclear medicine tests. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Clinical challenges and images in GI. Intrapancreatische accessoire milt die een niet-functionerende neuro-endocriene tumor nabootst. Gastroenterology 2006; 131:350, 689.