Keywords
Endosonography; Neuroendocrine Tumors; Pancreatectomy
Abbreviations
HDRBC: heat-damaged red blood cell; IPAS: intrapancreatic accessory spleen; ITP: idiopathic thrombocytopenic purpura; SPECT: single photon emission computed tomography; SPIO: superparamagnetic iron oxide
INTRODUCTION
Ektopową dodatkową tkankę śledzionową można znaleźć w dowolnym miejscu wzdłuż naczyń śledzionowych, w ścianie jelita czczego, w krezce, w jelicie grubym, w miednicy lub lewej mosznie. Chociaż rzadko zauważana radiologicznie, jest stosunkowo częsta, występując u około 10% populacji według badań autopsyjnych. W 80% przypadków śledziona dodatkowa jest zlokalizowana we wnęce śledziony lub w jej pobliżu. W pozostałych przypadkach występuje w ogonie trzustki lub w jego pobliżu. Śledziony dodatkowe zwykle nie stanowią zagrożenia klinicznego, a wyniki badań radiologicznych wykonywanych obecnie zaawansowanymi technikami obrazowymi są pomocnymi narzędziami diagnostycznymi pozwalającymi na uniknięcie zabiegu operacyjnego. Jedyną bezpieczną metodą diagnostyczną jest bezpośrednie pobieranie próbek, o ile nie daje ono, jak w naszym przypadku, fałszywego wyniku w postaci komórek wysepek trzustkowych. W niniejszym doniesieniu analizujemy przypadek leczonego chirurgicznie wewnątrztrzustkowego śledziony pomocniczej (intrapancreatic accessory spleen – IPAS), który radiologicznie i cytologicznie imitował neuroendokrynny guz trzustki.
Raport przypadku
60-letni mężczyzna rasy kaukaskiej został skierowany do naszej kliniki w celu dalszej oceny i leczenia przypadkowej samotnej masy w trzonie trzustki, imitującej guz endokrynny. Podczas rutynowej kontroli pacjent miał nieznacznie podwyższone stężenie antygenu węglowodanowego (CA) 19-9 do 40 U/mL (zakres referencyjny: 0-37 U/mL). Spiralna tomografia komputerowa z kontrastem (CT) wykazała okrągłą jednorodną zmianę o średnicy 1,2 cm, zlokalizowaną w górnej części trzonu trzustki (Rycina 1).
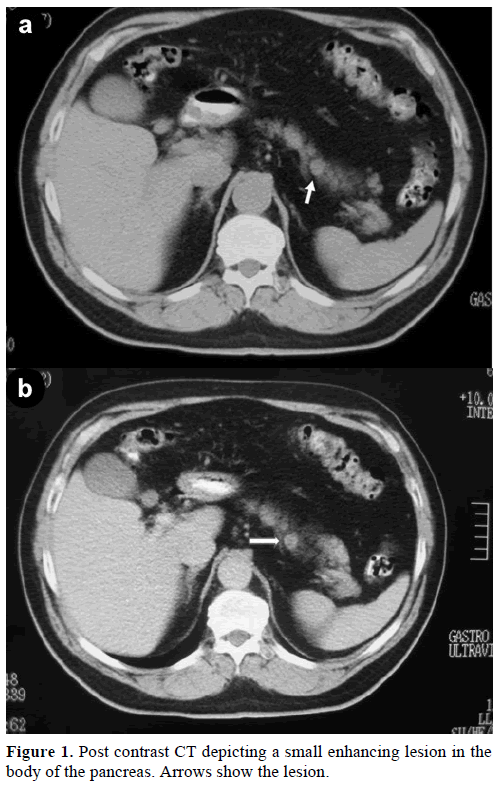
Rycina 1. Tomografia komputerowa po podaniu kontrastu przedstawiająca niewielką, wzmacniającą się zmianę w trzonie trzustki. Arrows show the lesion.
Kontrastowy rezonans magnetyczny (MRI) ujawnił okrągłą, dobrze zdefiniowaną masę, o średnicy 1 cm, o niskiej intensywności sygnału na obrazach T1-zależnych, niejednorodne wzmocnienie zmiany w fazie tętniczej na obrazach T1-zależnych wzmocnionych gadolinem oraz hiperintensywność na obrazach T2-zależnych nasyconych tłuszczem (ryc. 2).
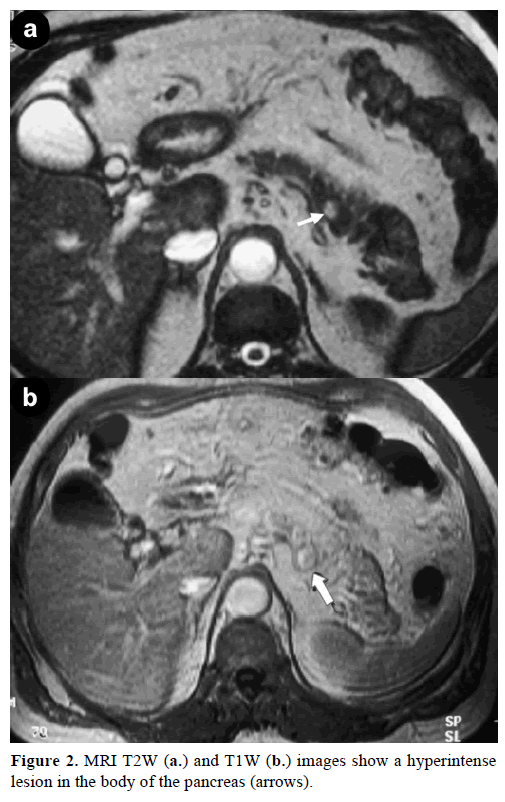
Rycina 2. Obrazy MRI T2W (a.) i T1W (b.) przedstawiają hiperintensję w trzonie trzustki (strzałki).
Endoskopowa ultrasonografia (EUS) wykazała dobrze odgraniczony guzek, wielkości około 1,2 cm, stosunkowo jednorodny z dobrze zdefiniowanymi i gładkimi brzegami, zwiększonym ukrwieniem i mieszaną echogenicznością. Cechy te odpowiadały guzowi neuroendokrynnemu. Masa była zlokalizowana w trzonie trzustki, bezpośrednio obwodowo w stosunku do pnia celiakii i pomiędzy przewodem trzustkowym a ścianą żołądka. Nie stwierdzono obecności regionalnych węzłów chłonnych ani innych zmian patologicznych.
W wyniku biopsji aspiracyjnej cienkoigłowej (FNA) pod kontrolą EUS stwierdzono skupiska komórek różnej wielkości, immunopozytywne dla chromograniny, glukagonu, gastryny i somatostatyny oraz z indeksem proliferacji Ki-67 poniżej 2%; wyniki te były morfologicznie i immunohistochemicznie charakterystyczne dla nowotworu neuroendokrynnego (ryc. 3).
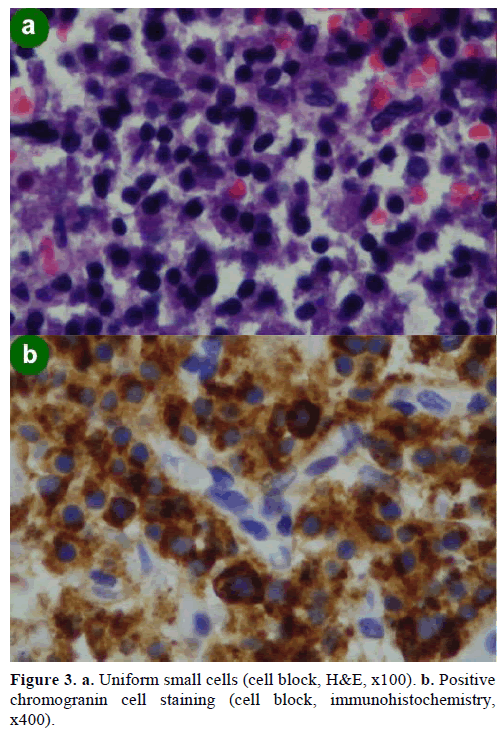
Rycina 3. a. Jednolite małe komórki (blok komórek, H&E, x100). b. Dodatnie barwienie komórek chromograniny (blok komórek, immunohistochemia, x400).
Scyntygrafia całego ciała 111indium-octreotide była ujemna dla receptorów somatostatyny.
Badania laboratoryjne nie wykazały żadnych nieprawidłowości, nie stwierdzono również markerów nowotworowych, takich jak antygen karcinoembrionalny (CEA), alfa-fetoproteina (AFP) i CA 19-9 (15 U/mL). Stężenie glukagonu, gastryny i somatostatyny w surowicy wynosiło odpowiednio 77,2 pg/mL (zakres referencyjny: 30-210 pg/mL), 20 pg/mL (zakres referencyjny: 0-110 pg/mL) i 19,3 pg/mL (zakres referencyjny: 5-27 pg/mL). W celu wykluczenia zespołu mnogiej neoplazji endokrynnej typu 1 (MEN-1) oznaczono stężenie następujących hormonów w surowicy: parathormonu (PTH) w stanie nienaruszonym (82,4 pg/mL; zakres referencyjny: 15-65 pg/mL), trójjodotyroniny (T3: 0,9 ng/mL; zakres referencyjny: 0.7-1,5 ng/mL), tyroksyna (T4: 7,4 μg/dL; zakres referencyjny: 4,5- 12 μg/dL), hormon tyreotropowy (TSH: 1,8 μIU/mL; zakres referencyjny: 0,4-4,5 μIU/mL), wskaźnik wolnej tyroksyny (FTI: 9,7 μg/dL; zakres referencyjny: 6,3- 12,4 μg/dL). Rezonans magnetyczny przysadki był bez zmian.
Na podstawie powyższych wyników wysunięto podejrzenie niefunkcjonującego guza endokrynnego i wykonano dystalną pankreatektomię ze splenektomią. W wycinku chirurgicznym stwierdzono okrągły, dobrze odgraniczony, gładki, ciemnoczerwony guzek o średnicy 1 cm, otoczony tkanką trzustki. Po dokładnym pobraniu wycinków nie stwierdzono innych zmian. Mikroskopowo guzek miał strukturę śledziony. W związku z tym masę rozpoznano jako IPAS (ryc. 4 i 5). Osiem węzłów chłonnych, zidentyfikowanych we wnęce śledziony, było łagodnych.
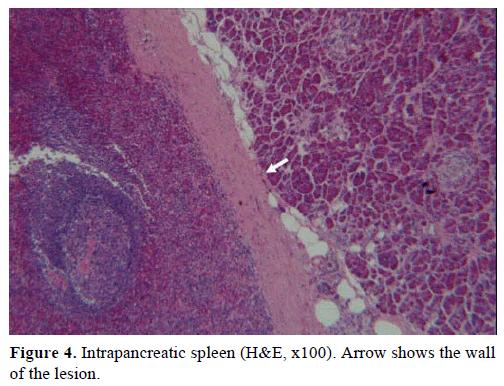
Ryc. 4. Śledziona wewnątrztrzustkowa (H&E, x100). Strzałka pokazuje ścianę zmiany.
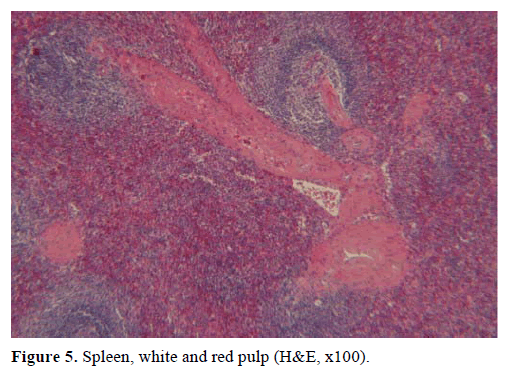
Ryc. 5. Śledziona, miąższ biały i czerwony (H&E, x100).
DYSCYPLINA
Ektopową tkankę śledzionową można podzielić na dwie kategorie: splenezy spowodowane autotransplantacją tkanki śledzionowej (zwykle po splenektomii) oraz śledziony dodatkowe, które stanowią wrodzone ogniska zdrowej tkanki śledzionowej oddzielone od głównego trzonu śledziony . Embriologicznie śledziona wywodzi się z tkanki mezenchymalnej, która leży pomiędzy warstwami mezogastrium grzbietowego. W okresie od 6. do 8. tygodnia życia śledziona znajduje się w bezpośredniej bliskości najbardziej dogłowowego przedłużenia mezonercza. Po zespoleniu śledziony z nerkami, dodatkowa śledziona może być położona pozajelitowo i zaotrzewnowo lub może zstępować do miednicy lub moszny. W badaniu przedmiotowym IPAS jest zwykle otoczony torebką włóknistą, która oddziela go od sąsiadującego miąższu trzustki. Jego obraz histologiczny jest podobny do śledziony ortotopowej. Zmiany lub procesy dotyczące śledziony, takie jak hemosideroza, białaczka, chłoniak i hipersplenizm mogą wpływać na obecność dodatkowej tkanki śledzionowej. W związku z tym w diagnostyce różnicowej guzkowych zagęszczeń wykazanych w badaniu radiologicznym trzustki należy rozważyć staranne poszukiwanie dodatkowych śledzion. Istnienie IPAS należy rozważyć, gdy masa trzustkowa ma gęstości CT i/lub intensywności sygnału MRI podobne do śledziony, na obrazach przedkontrastowych i wzmocnionych kontrastem we wszystkich metodach obrazowania. W szczególności, niejednorodne wzmocnienie IPAS we wczesnych fazach może być wskazówką diagnostyczną. Angiograficzne wykazanie ukrwienia śledziony może być pomocne w wykluczeniu guza trzustki lub nadnercza .
Diagnostyka różnicowa wewnątrz- i okołotrzustkowych śledzion dodatkowych może obejmować guzy neuroendokrynne trzustki, torbiele limfoepitelialne, chłoniaki, przerzuty hiperwaskularne, lite guzy rzekome brodawkowate i gruczolakoraki trzustki . Obecnie nie istnieją kliniczne ani radiograficzne kryteria rozpoznania lub różnicowania IPAS z nowotworem złośliwym
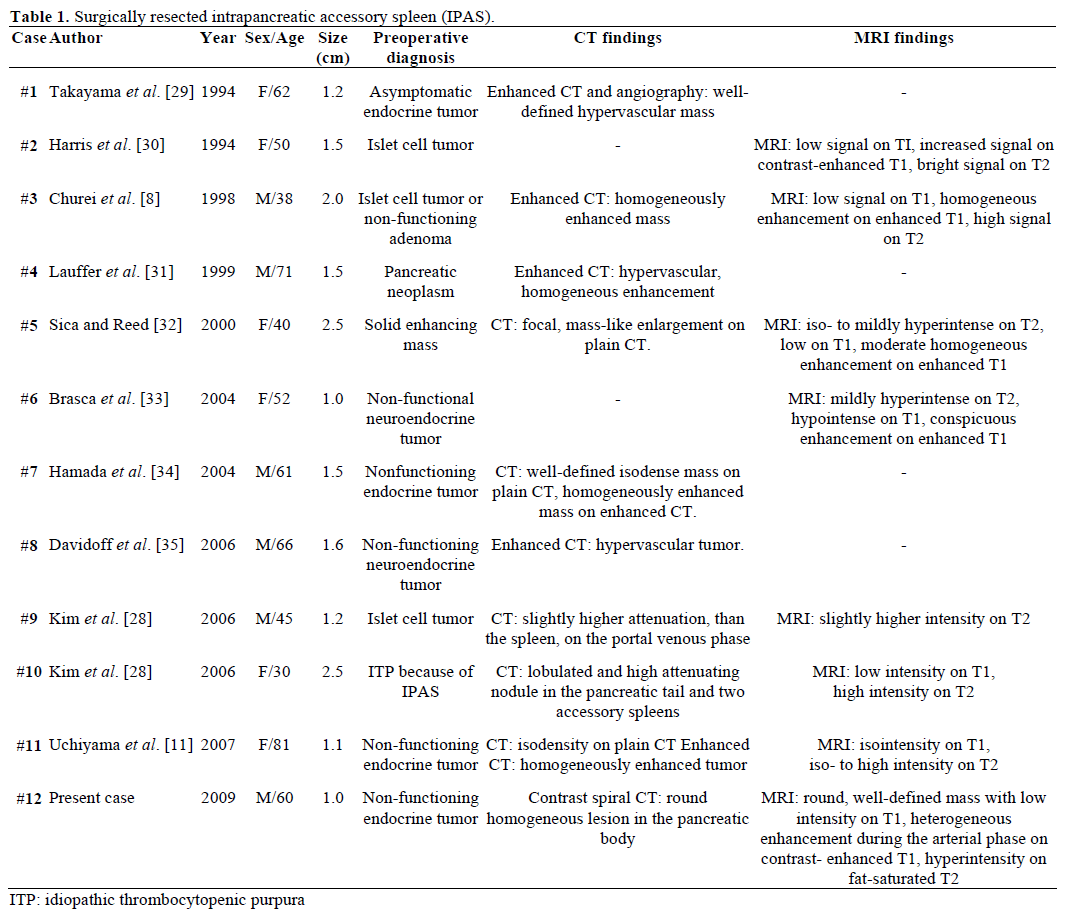
Wyniki badań radiologicznych i rozpoznanie przedoperacyjne skierowanych, chirurgicznie resekowanych i potwierdzonych patologicznie IPAS podsumowano w tabeli 1. Większość przypadków była początkowo uważana za niefunkcjonujące guzy endokrynne lub guzy komórek wysepek, a tylko jeden na dwanaście przypadków został ostatecznie zdiagnozowany przedoperacyjnie jako IPAS po nieudanym powtarzającym się leczeniu chirurgicznym z powodu idiopatycznej plamicy małopłytkowej (ITP). Wielkość wahała się od 1,0 do 2,5 cm, przy średniej wartości 1,55 cm. Niefunkcjonujące guzy endokrynne stanowią 15-41% guzów endokrynnych trzustki, a odsetek ich złośliwej transformacji wynosi 62-92%, w zależności od typu guza. Całkowita resekcja guza jest ostatecznym predyktorem długoterminowego przeżycia, niezależnie od jego wielkości, lokalizacji, zróżnicowania histologicznego, zajęcia węzłów chłonnych i innych parametrów.
Ponieważ nie ustalono rozmiaru odcięcia w celu odróżnienia złośliwych i łagodnych niefunkcjonujących guzów neuroendokrynnych trzustki, sugeruje się, że wszystkie takie guzy większe niż 1 cm powinny być wycięte, jeśli pacjent jest dobrym kandydatem do operacji.
Wyniki w EUS obejmują okrągłą do owalnej zmianę z ostrymi, regularnymi brzegami i jednorodną teksturą echa, od hipo- do hiperechogenicznej . Cytologia FNA wykonana pod kontrolą EUS ujawnia populację przeważnie małych limfocytów i mieszany naciek zapalny reprezentujący miazgę białą. Obserwuje się również wyraźny komponent naczyniowy składający się z cienkościennych naczyń krwionośnych reprezentujących zatoki śledzionowe. Zatoki te są dobrze uwidocznione na przekrojach bloków komórkowych. Co ciekawe, pulchne komórki śródbłonka zatok śledzionowych charakterystycznie barwią się na CD8, który jest bardziej powszechnie rozpoznawany jako marker komórek T. Barwienie wydaje się być specyficzne, ponieważ systemowe komórki śródbłonka i naczyniaki są negatywne dla CD8. W przypadkach, w których FNA śledziony dodatkowej daje tylko limfocyty, bez innych elementów śledziony, cytometria przepływowa i immunohistochemia mogą być zastosowane w celu wykluczenia zaburzeń limfoproliferacyjnych, w tym chłoniaka Hodgkina, nawet jeśli nie można potwierdzić ostatecznego rozpoznania śledziony dodatkowej. Schreiner i wsp. opisali trzy przypadki IPAS rozpoznane na podstawie biopsji FNA pod kontrolą EUS. W naszym przypadku, prawdopodobnie z powodu pobierania próbek skupisk komórek wysepek z sąsiedniego miąższu trzustki, ta sama procedura wskazywała na guz neuroendokrynny, prowadząc do chirurgicznego przeleczenia.
Podobny fałszywie dodatni wynik EUS-FNA, w którym guzek śledziony trzustki został pomylony z guzem komórek wysepek, został również opisany przez Ardengha i wsp. Ogólnie rzecz biorąc, EUS-FNA ma wysoką (80-90%) czułość i swoistość dla guzów neuroendokrynnych trzustki, chociaż jej dokładność dla takich guzów jest uważana za niższą niż dla gruczolakoraka trzustki. W celu zminimalizowania błędów diagnostycznych, EUS-FNA małych guzów neuroendokrynnych powinna być wykonywana przez doświadczonego endoskopistę, a ocena cytopatologiczna powinna być połączona z immunohistochemią.
99mTechnetium heat-damaged red blood cells (99mTc- HDRBC) scintigraphy, combined with single photon emission computed tomography (SPECT), is a highly sensitive and specific method for detection of splenic tissue, since up to 90% of the injected HDRBCs are trapped by this tissue . Chociaż scyntygrafia umożliwia selektywną wizualizację śledziony z doskonałym stosunkiem śledziony do wątroby, wizualizacja śledziony jest nadal trudna w warunkach, w których minimalnie funkcjonująca tkanka śledzionowa jest obecna, jak w przypadku śledziony dodatkowej. Ponadto scyntygrafia, nawet z użyciem SPECT, oferuje gorszą rozdzielczość przestrzenną w porównaniu z innymi metodami obrazowania przekrojowego, takimi jak CT czy MRI. Dlatego scyntygrafia jest często stosowana w połączeniu z innymi technikami obrazowania przekrojowego. Co więcej, badanie MRI z zastosowaniem superparamagnetycznego tlenku żelaza (SPIO) jest doskonałą alternatywą dla scyntygrafii z użyciem 99mTc-HDRBC, gdy IPAS charakteryzuje się spadkiem sygnału podobnym do tego, jaki występuje w śledzionie. Poza wspomnianym spadkiem sygnału, kolejną różnicą między IPAS a hiperwaskularnymi nowotworami trzustki jest niejednorodne wzmocnienie w tomografii komputerowej w fazie tętniczej .
Następcze śledziony mogą wymagać leczenia chirurgicznego, gdy imitują limfadenopatie lub guzy, lub gdy stają się objawowe z powodu skręcenia, samoistnego pęknięcia, krwotoku lub tworzenia się torbieli. Cała funkcjonalna tkanka śledziony powinna być również usunięta w celu leczenia zaburzeń hematologicznych, takich jak ITP.
Podsumowując, nowoczesne techniki obrazowania prawdopodobnie doprowadzą w przyszłości do wykrycia coraz większej liczby wewnątrztrzustkowych śledzion dodatkowych, stawiając istotne wyzwania diagnostyczne i terapeutyczne. W takich przypadkach należy stosować wszystkie nieinwazyjne metody diagnostyczne w celu uniknięcia niepotrzebnych zabiegów chirurgicznych i zmniejszenia ogólnej zachorowalności pacjentów.
Konflikt interesów
Autorzy nie mają potencjalnych konfliktów interesów
- Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Accessory spleens in or at the tail of the pancreas: Badanie 2,700 dodatkowych nekropsji. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapancreatic accessory spleen: findings on MR Imaging, CT, US and scintigraphy, and the pathologic analysis. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? A contribution to embryology, topography and pathology of ectopic splenic tissue. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Accessory spleen in the head of the pancreas. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreatic accessory spleen: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapancreatic accessory spleen mimicking pancreatic mass on CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radical pancreatoduodenectomy for misdiagnosed pancreatic mass. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapancreatic accessory spleen mimicking endocrine tumor of the pancreas: case report and review of the literature. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomaty i niefunkcjonujące endokrynne guzy trzustki: Prezentacja kliniczna, diagnostyka i postępy w postępowaniu. In: Mignon M, Jensen RT, eds. Endocrine Tumors of the Pancreas: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Switzerland: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Malignant nonfunctioning endocrine tumors of the pancreas: predictive factors for survival after surgical treatment. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonography of the accessory spleen. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Contrast-enhanced sonography of intrapancreatic accessory spleen in six patients. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: a potential cause of misdiagnosis at EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnosis of a case by fine needle aspiration cytology. Acta Cytol 1988; 32:91-3.
- Kraus MD. Splenic histology and histopathology: an update. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. A case report. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosis of deep-seated lymphoma and leukemia by endoscopic ultrasound-guided fine-needle aspiration biopsy. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreatic accessory spleen: mimic of pancreatic endocrine tumor diagnosed by endoscopic ultrasound-guided fine-needle aspiration biopsy. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-guided FNA in the diagnosis of pancreatic neuroendocrine tumors before surgery. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT and superparamagnetic iron oxide (SPIO)-enhanced MR findings of intrapancreatic accessory spleen in seven patients. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreatic accessory spleen. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Accessory spleen causing a mass in the tail of the pancreas: MR imaging findings. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapancreatic accessory spleen.A rare cause of pancreatic mass. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatic accessory spleen mimicking a neuroendocrine tumor: magnetic resonance findings and possible diagnostic role of different nuclear medicine tests. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Clinical challenges and images in GI. Intrapancreatic accessory spleen mimicking nonfunctioning neuroendocrine tumor. Gastroenterology 2006; 131:350, 689.