Cuvintele cheie
Endosonografie; Tumori neuroendocrine; Pancreatectomie
Abbreviații
HDRBC: globule roșii deteriorate termic; IPAS: splină accesorie intrapancreatică; ITP: purpură trombocitopenică idiopatică; SPECT: tomografie computerizată cu emisie de fotoni unici; SPIO: oxid de fier superparamagnetic
INTRODUCERE
Tesutul splenic accesoriu ectopic poate fi găsit oriunde de-a lungul vaselor splenice, în peretele jejunului, în mezenter, în mezenterul mare, în omentul mare, în pelvis sau în scrotul stâng. Deși este rareori observat radiologic, este relativ frecvent, apărând la aproximativ 10% din populație, conform studiilor autopsiei. Splina accesorie este localizată la nivelul sau în apropierea hilului splenic în 80% din cazuri. În restul cazurilor apare fie în coada pancreatică, fie în apropierea acesteia . Splina accesorie nu reprezintă, de obicei, o amenințare clinică, iar rezultatele radiologice ale tehnicilor imagistice avansate din prezent sunt instrumente de diagnosticare utile pentru evitarea intervenției chirurgicale . Singura metodă de diagnosticare sigură este prelevarea directă de probe, cu excepția cazului în care aceasta produce în mod fals celule de insule pancreatice, ca în cazul nostru. În acest raport analizăm cazul unei spline accesorii intrapancreatice (IPAS) tratate chirurgical, care a mimat radiologic și citologic o tumoră pancreatică neuroendocrină.
Raport de caz
Un bărbat caucazian în vârstă de 60 de ani a fost trimis la clinica noastră pentru o evaluare și un tratament suplimentar al unei mase solitare accidentale, în corpul pancreasului, care imita o tumoră endocrină. La un control de rutină, pacientul a prezentat o ușoară creștere a antigenului carbohidrat (CA) 19-9 la 40 U/mL (interval de referință: 0-37 U/mL). Tomografia computerizată (CT) spiralată cu substanță de contrast a evidențiat o leziune rotundă omogenă, cu diametrul de 1,2 cm, localizată în partea superioară a corpului pancreatic (figura 1).
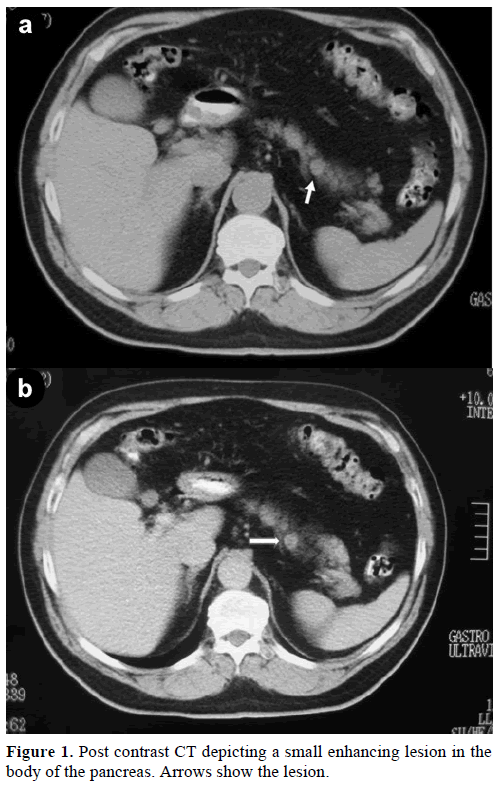
Figura 1. CT postcontrast care descrie o mică leziune potențatoare în corpul pancreasului. Săgețile indică leziunea.
Imagistica prin rezonanță magnetică (IRM) cu contrast a evidențiat o masă rotundă, bine definită, cu diametrul de 1 cm, cu o intensitate scăzută a semnalului pe imaginile ponderate în T1, cu intensificare heterogenă a leziunii în timpul fazei arteriale pe imaginile ponderate în T1 cu gadoliniu și cu hiperintensitate pe imaginile ponderate în T2 saturate cu grăsime (figura 2).
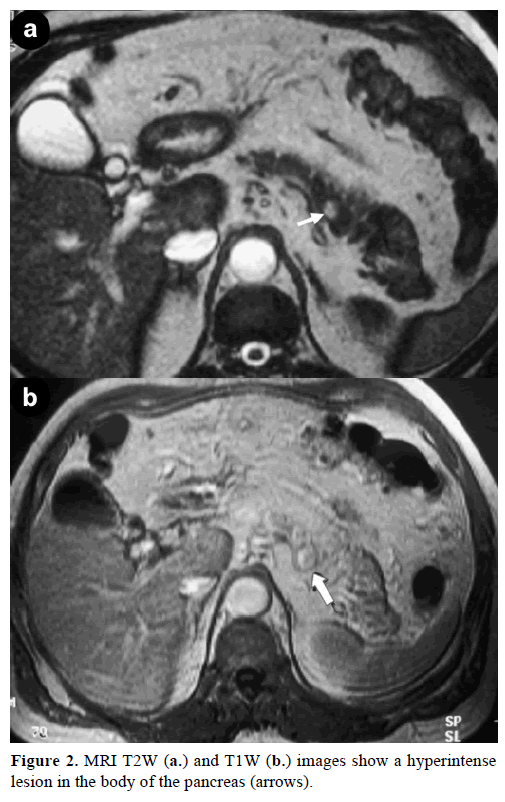
Figura 2. Imaginile RMN T2W (a.) și T1W (b.) arată un hiperintenselesion în corpul pancreasului (săgeți).
Ecografia endoscopică (EUS) a arătat un nodul bine delimitat, cu o dimensiune de aproximativ 1,2 cm, relativ omogen, cu margini bine definite și netede, aport sanguin crescut și ecogenitate mixtă. Aceste atribute au fost compatibile cu o tumoră neuroendocrină. Masa era localizată în corpul pancreasului, direct periferic față de trunchiul celiac și între canalul pancreatic și peretele gastric. Nu au fost observați ganglioni limfatici regionali sau alte constatări patologice.
O biopsie prin aspirație cu ac fin (FNA) ghidată de EUS a dus la apariția unor grupuri de celule de diferite dimensiuni, imunopozitive pentru cromogranină, glucagon, gastrină și somatostatină și cu un indice de proliferare Ki-67 mai mic de 2%; aceste constatări au fost caracteristice din punct de vedere morfologic și imunohistochimic unui neoplasm neuroendocrin (figura 3).
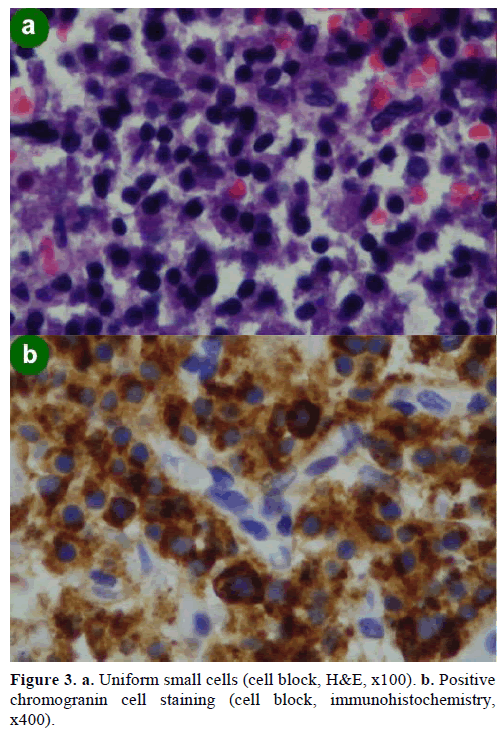
Figură 3. a. Celule mici uniforme (bloc celular, H&E, x100). b. Colorație pozitivă a celulelor cu cromogranină (bloc celular, imunohistochimie,x400).
Scintigrafia cu 111indiu-octreotidă pe tot corpul a fost negativă pentru receptorii de somatostatină.
Testele de laborator nu au evidențiat rezultate anormale și nici markeri tumorali, cum ar fi antigenul carcinoembrionar (CEA), alfa-fetoproteina (AFP) și CA 19-9 (15 U/mL). Nivelurile serice de glucagon, gastrină și somatostatină au fost raportate la 77,2 pg/mL (interval de referință: 30-210 pg/mL), 20 pg/mL (interval de referință: 0-110 pg/mL) și, respectiv, 19,3 pg/mL (interval de referință: 5-27 pg/mL). Pentru a exclude sindromul de neoplazie endocrină multiplă de tip 1 (MEN-1), au fost măsurate următoarele niveluri hormonale serice: parathormon (PTH) intact (82,4 pg/mL; interval de referință: 15-65 pg/mL), triiodotironină (T3: 0,9 ng/mL; interval de referință: 0.7-1,5 ng/mL), tiroxina (T4: 7,4 μg/dL; interval de referință: 4,5- 12 μg/dL), hormonul de stimulare a tiroidei (TSH: 1,8 μIU/mL; interval de referință: 0,4-4,5 μIU/mL), indicele tiroxinei libere, (FTI: 9,7μg/dL; interval de referință: 6,3- 12,4μg/dL). RMN-ul hipofizar a fost neremarcabil.
Pe baza rezultatelor de mai sus, s-a suspectat o tumoră endocrină nefuncțională și s-a efectuat o pancreatectomie distală cu splenectomie. Proba chirurgicală conținea un nodul rotund, bine delimitat, neted, neted, roșu-închis, cu diametrul de 1 cm, înconjurat de țesut pancreatic. Nu au fost identificate alte leziuni la nivel macroscopic, în urma secționării meticuloase. Microscopic, nodulul avea structura unei spline. Astfel, masa a fost diagnosticată ca fiind un IPAS (figurile 4 și 5). Opt ganglioni limfatici, identificați la nivelul hilului splenic, au fost benigni.
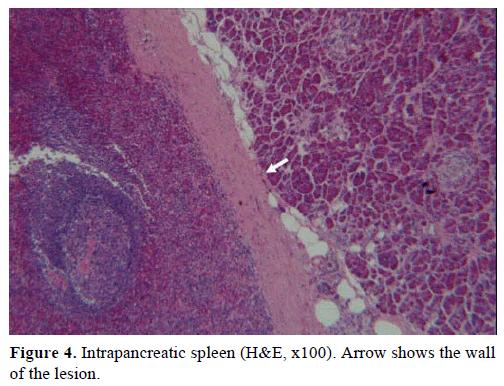
Figura 4. Splina intrapancreatică (H&E, x100). Săgeata arată valul leziunii.
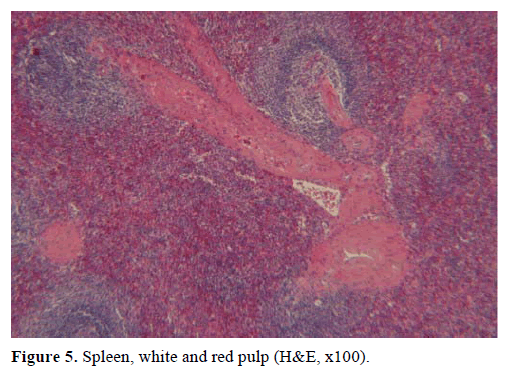
Figura 5. Splina, pulpa albă și roșie (H&E, x100).
DISCUȚII
Tesutul splenic ectopic poate fi clasificat în două categorii: splenoza datorată autotransplantului de țesut splenic (de obicei după splenectomie) și splenele accesorii care constituie focare congenitale de țesut splenic sănătos separate de corpul principal al splinei . Din punct de vedere embriologic, splina este derivată din țesutul mezenchimal care se află între straturile mezogastrului dorsal. În timpul săptămânii a 6-a până la a 8-a de viață, splina se află în imediata apropiere de extensia cea mai cefalică a mezonefrosului . După fuziunea splenorenală, o splină accesorie poate fi găsită la nivel pararenal și retroperitoneal sau poate coborî în pelvis sau în scrot . La examinarea macroscopică, un IPAS este, de obicei, înconjurat de o capsulă fibrotică care îl separă de parenchimul pancreatic adiacent. Histologia sa este similară cu cea a splinei ortotopice . Leziunile sau procesele care privesc splina, cum ar fi hemosideroza, leucemia, limfomul și hipersplenismul, pot afecta țesutul splenic accesoriu. Astfel, o căutare atentă a splinei accesorii trebuie avută în vedere în diagnosticul diferențial al densităților nodulare demonstrate prin studiul radiologic al pancreasului .
Existența unui IPAS trebuie luată în considerare atunci când o masă pancreatică are densitățile CT și/sau intensitățile semnalului IRM similare cu cele ale splinei, pe imaginile cu precontrast și cu substanță de contrast ale tuturor modalităților imagistice. În special, intensificarea neomogenă a unui IPAS în fazele sale timpurii poate fi un indiciu de diagnostic. Demonstrarea angiografică a unui aport sanguin splenic ar putea fi utilă în excluderea unei tumori pancreatice sau a unei tumori suprarenale .
Diagnosticul diferențial pentru splina accesorie intra- și peri-pancreatică ar putea include tumori neuroendocrine pancreatice, chisturi limfoepiteliale, limfoame, metastaze hipervasculare, tumori solide pseudopapilare și adenocarcinoame pancreatice . În prezent, nu există criterii clinice sau radiografice pentru diagnosticarea sau diferențierea unui IPAS de o tumoră malignă .
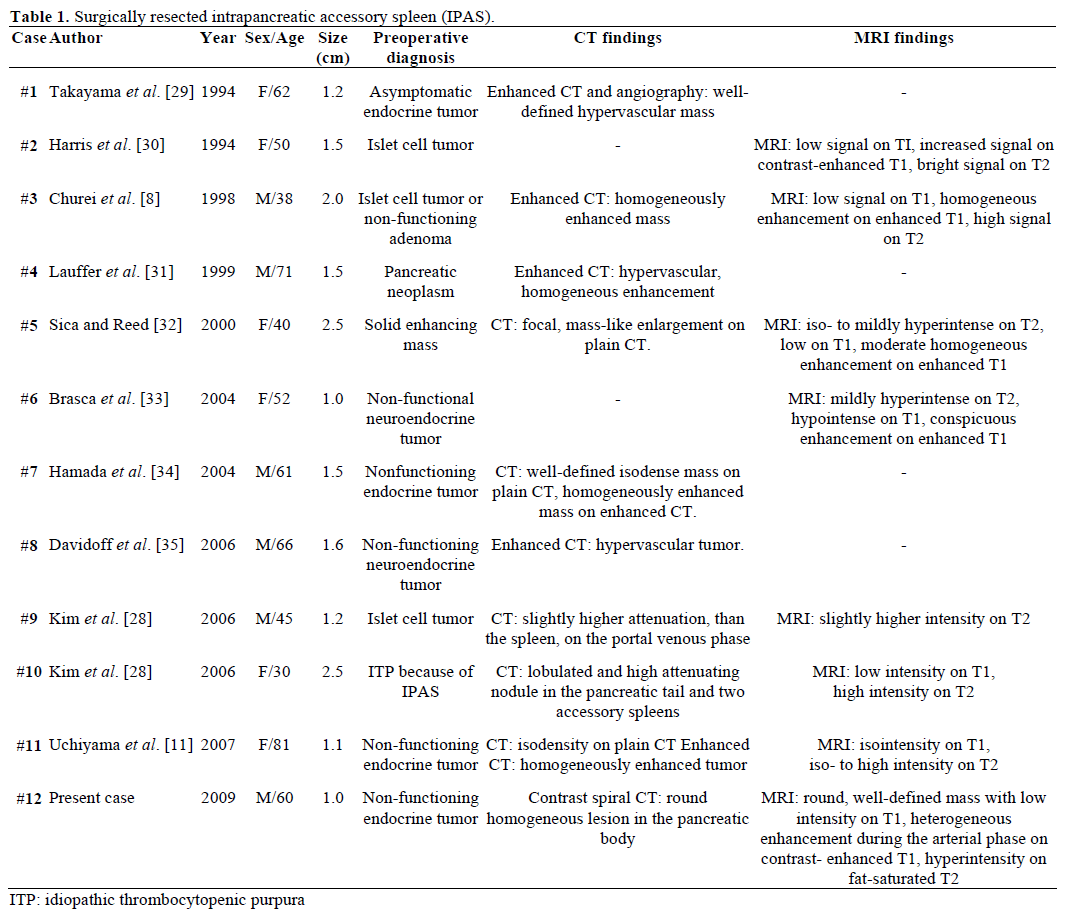
Constatările radiologice și diagnosticul preoperator al IPAS referate, rezecate chirurgical și confirmate patologic sunt rezumate în tabelul 1. Cele mai multe cazuri au fost considerate inițial ca fiind tumori endocrine nefuncționale sau tumori ale celulelor insulare și doar unul din douăsprezece cazuri a fost diagnosticat preoperator în mod concludent ca fiind un IPAS după un tratament chirurgical repetitiv nereușit pentru purpura trombocitopenică idiopatică (PTI). Dimensiunea a variat de la 1,0 la 2,5 cm, cu o valoare medie de 1,55 cm . Tumorile endocrine nefuncționale reprezintă 15-41% din tumorile pancreatice endocrine, iar rata de transformare malignă a acestora este de 62-92%, în funcție de tipul de tumoare . Rezecția totală a tumorii este predictorul suprem al supraviețuirii pe termen lung, independent de dimensiune, localizare, diferențiere histologică, implicarea ganglionilor limfatici și alți parametri .
Din moment ce nu a fost stabilită o dimensiune limită pentru a diferenția între tumorile neuroendocrine nefuncționale maligne și benigne ale pancreasului, s-a sugerat că toate aceste tumori mai mari de 1 cm ar trebui excizate dacă pacientul este un bun candidat pentru intervenție chirurgicală .
La ecografia de bază pe scara de gri, un IPAS este de obicei văzut ca o masă rotundă sau ovală cu o textură ușor ecogenă și omogenă, înconjurată de o interfață cu amplitudine mare și care prezintă un accesoriu în spatele leziunii. La ecografia Doppler color sau Doppler de putere, s-a raportat că un aport de sânge caracteristic (reprezentând hilul vascular care intră în masă) oferă o sensibilitate de 90% în diagnosticul unui IPAS . La ultrasonografia cu substanță de contrast (CEUS) utilizând Levovist® (Schering, Berlin, Germania), un IPAS prezintă o intensificare neomogenă în faza vasculară timpurie, o intensificare similară cu cea a splinei în timpul fazei postvasculare și o intensificare prelungită în faza parenchimală hepatosplenică .
Celebările la EUS includ o leziune rotundă spre ovală cu margini clare și regulate și o textură de ecou omogenă, variind de la hipo- la hiperecogenă . Citologia FNA ghidată de EUS relevă o populație de limfocite predominant mici și un infiltrat inflamator mixt reprezentând pulpa albă. Se observă, de asemenea, o componentă vasculară vizibilă formată din vase de sânge cu pereți subțiri reprezentând sinusurile splenice…. Aceste sinusuri sunt bine vizualizate pe secțiunile blocului celular. În mod interesant, celulele endoteliale pline ale sinusurilor splenice se identifică imunologic în mod caracteristic pentru CD8, care este mai frecvent recunoscut ca fiind un marker al celulelor T. Colorarea pare a fi specifică, deoarece celulele endoteliale sistemice și hemangioamele sunt negative pentru CD8 . În cazurile în care FNA din splina accesorie produce numai limfocite, fără alte elemente splenice, citometria în flux și imunohistochimia pot fi utilizate pentru a exclude o afecțiune limfoproliferativă, inclusiv limfomul Hodgkin, chiar dacă nu poate fi confirmat un diagnostic definitiv de splină accesorie . Schreiner și colab. au raportat trei cazuri de IPAS care au fost diagnosticate prin biopsie FNA ghidată prin EUS . În cazul nostru, probabil din cauza prelevării de clustere de celule insulare din parenchimul pancreatic adiacent, aceeași procedură a indicat o tumoră neuroendocrină, ceea ce a dus la suprasolicitare chirurgicală.
Un fals pozitiv EUS-FNA similar, în care un nodul splenic pancreatic a fost confundat cu o tumoră cu celule insulare a fost raportat și de Ardengh et al. În general, EUS-FNA are o sensibilitate și o specificitate ridicată (80-90%) pentru tumorile neuroendocrine pancreatice, deși acuratețea sa pentru astfel de tumori este considerată a fi mai mică decât cea pentru adenocarcinomul pancreatic . Pentru a minimiza erorile de diagnosticare, EUS-FNA a tumorilor neuroendocrine mici ar trebui să fie efectuată de către un endoscopist experimentat, iar evaluarea citopatologică ar trebui să fie combinată cu imunohistochimia .
Cintigrafia cu globule roșii deteriorate termic cu 99mTechnetium (99mTc- HDRBC), combinată cu tomografia computerizată cu emisie de fotoni unici (SPECT), este o metodă extrem de sensibilă și specifică pentru detectarea țesutului splenic, deoarece până la 90% din HDRBC-urile injectate sunt captate de acest țesut . Deși scintigrafia permite vizualizarea selectivă a splinei cu un raport excelent splină-fuzat, vizualizarea splenică este totuși dificilă în condițiile în care este prezent un țesut splenic cu funcționare minimă, cum ar fi în cazurile de splină accesorie . În plus, scintigrafia, chiar și cu SPECT, oferă o rezoluție spațială inferioară în comparație cu alte modalități de imagistică transversală, cum ar fi CT sau RMN. Prin urmare, scintigrafia este frecvent utilizată împreună cu alte tehnici de imagistică transversală. Mai mult, RMN-ul potențat cu oxid de fier superparamagnetic (SPIO) este raportat ca o alternativă excelentă la scintigrafia cu 99mTc-HDRBC, atunci când un IPAS are o scădere de semnal similară cu cea a splinei. În plus față de căderea de semnal menționată, o altă diferență între IPAS și neoplasmele pancreatice hipervasculare este consolidarea eterogenă pe tomografia computerizată în fază arterială .
Spleenele accesorii pot necesita tratament chirurgical atunci când mimează limfadenopatii sau tumori, sau când devin simptomatice din cauza torsiunii, rupturii spontane, hemoragiei sau formării de chisturi. Tot țesutul splenic funcțional ar trebui, de asemenea, să fie îndepărtat pentru tratamentul tulburărilor hematologice, cum ar fi PTI.
În concluzie, tehnicile imagistice moderne vor duce probabil la descoperirea în viitor a unui număr tot mai mare de spline accesorii intrapancreatice, ceea ce va ridica provocări diagnostice și terapeutice semnificative. În astfel de cazuri ar trebui utilizate toate mijloacele de diagnostic neinvazive pentru a evita procedurile chirurgicale inutile și pentru a scădea morbiditatea generală a pacienților.
Conflict de interese
Autorii nu au conflicte potențiale de interese
- Halpert B, Gyorkey F. Lesiuni observate în splina accesorie la 311 pacienți. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Splina accesorie în sau la coada pancreasului: Un studiu asupra a 2.700 de necropsii suplimentare. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Splina accesorie intrapancreatică: constatări pe imagistica RMN, CT, US și scintigrafie, precum și analiza patologică. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? O contribuție la embriologia, topografia și patologia țesutului splenic ectopic. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Chist splenic epidermoid care apare într-o splină accesorie intrapancreatică. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Splina accesorie în capul pancreasului. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Splina accesorie intrapancreatică: raport de caz. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Splina accesorie intrapancreatică care mimează masa pancreatică pe CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Pancreatoduodenectomia radicală pentru o masă pancreatică diagnosticată greșit. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Splina accesorie intrapancreatică care imită tumora endocrină a pancreasului: raport de caz și revizuire a literaturii. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPoame și tumori pancreatice endocrine nefuncționale: Prezentare clinică, diagnostic și progrese în management. În: Mignon M, Jensen RT, eds. Endocrine Tumors of the Pancreas: Recent Advances in Research and Management. Frontierele cercetării gastrointestinale. Basel, Elveția: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19: 753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Tumori endocrine maligne nefuncționale ale pancreasului: factori predictivi pentru supraviețuirea după tratamentul chirurgical. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Chirurgia tumorilor pancreatice neuroendocrine nefuncționale rezecabile. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Ecografia splinei accesorii. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Ecografia îmbunătățită cu contrast a splinei accesorii intrapancreatice la șase pacienți. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Splina accesorie: o cauză potențială de diagnosticare greșită la EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Splenoză toracică diagnosticată prin citologie prin aspirație cu acul fin: un raport de caz. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Splenoza toracică. Diagnosticul unui caz prin citologie aspirativă cu ac fin. Acta Cytol 1988; 32:91-3.
- Kraus MD. Histologia și histopatologia splenică: o actualizare. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. Un raport de caz. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosticul limfomului și leucemiei de adâncime prin biopsie aspirativă cu ac fin ghidată cu ultrasunete endoscopică. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Splina accesorie intrapancreatică: mimică a tumorii endocrine pancreatice diagnosticată prin biopsie prin aspirație cu ac fin ghidată cu ultrasunete endoscopică. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. FNA ghidat de EUS în diagnosticul tumorilor neuroendocrine pancreatice înainte de intervenție chirurgicală. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Splina accesorie intrapancreatică diagnosticată prin SPECT cu globule roșii deteriorate termic cu technețiu-99m. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. Constatări RM îmbunătățite cu MDCT și oxid de fier superparamagnetic (SPIO) ale splinei accesorii intrapancreatice la șapte pacienți. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Splina accesorie intrapancreatică. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Splina accesorie care provoacă o masă în coada pancreasului: Constatări imagistice prin rezonanță magnetică. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Splina accesorie intrapancreatică. o cauză rară de masă pancreatică. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Splina accesorie intrapancreatică. Radiologie 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Splina accesorie intrapancreatică care imită o tumoare neuroendocrină: constatări prin rezonanță magnetică și posibilul rol diagnostic al diferitelor teste de medicină nucleară. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Rezecția laparoscopică a cozii pancreatice cu prezervarea splinei pentru o splină accesorie intrapancreatică care mimează o tumoare endocrină nefuncțională: raportul unui caz. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Provocări clinice și imagini în GI. Splină accesorie intrapancreatică care mimează o tumoră neuroendocrină nefuncțională. Gastroenterology 2006; 131:350, 689.