Nøgleord
Endosonografi; Neuroendokrine tumorer; Pancreatectomy
Abkortelser
HDRBC: varmeskadet rød blodlegeme; IPAS: intrapancreatisk accessorisk milt; ITP: idiopatisk trombocytopenisk purpura; SPECT: single photon emission computed tomography; SPIO: superparamagnetisk jernoxid
INTRODUKTION
Ektopisk accessorisk miltvæv kan findes hvor som helst langs miltkarrene, i jejunumvæggen, i mesenteriet, i det store omentum, i bækkenet eller i venstre scrotum. Selv om det sjældent bemærkes radiologisk, er det relativt almindeligt, idet det ifølge obduktionsundersøgelser forekommer hos ca. 10 % af befolkningen. Accessorisk milt er i 80 % af tilfældene placeret ved eller i nærheden af milthjælummet. I resten af tilfældene findes den enten i bugspytkirtelhale eller i nærheden af den . Accessorisk milt udgør normalt ingen klinisk trussel, og de radiologiske resultater af de i dag avancerede billeddannelsesteknikker er nyttige diagnostiske redskaber til at undgå kirurgi . Den eneste sikre diagnostiske metode er direkte prøvetagning, medmindre den fejlagtigt giver pancreatiske ø-celler, som det var tilfældet i vores tilfælde. I denne rapport analyserer vi et tilfælde af en kirurgisk behandlet intrapancreatisk accessorisk milt (IPAS), som radiologisk og cytologisk efterlignede en neuroendokrin pancreas tumor.
CASE REPORT
En 60-årig kaukasisk mand blev henvist til vores klinik med henblik på yderligere evaluering og behandling af en tilfældig solitær masse i pancreaslegemet, der efterlignede en endokrin tumor. Ved en rutineundersøgelse havde patienten en let forhøjelse af kulhydratantigenet (CA) 19-9 til 40 U/mL (referenceområde: 0-37 U/mL). Kontrastspiral-computertomografi (CT) viste en rund homogen læsion med en diameter på 1,2 cm, der var placeret i den øverste del af pancreaskroppen (figur 1).
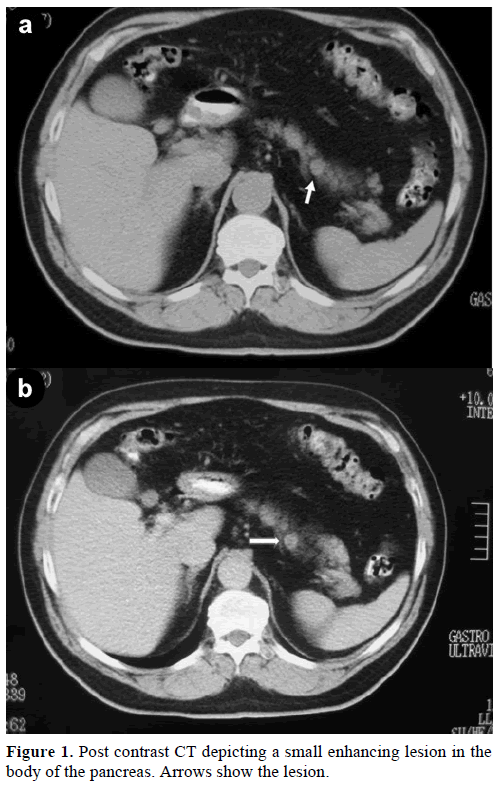
Figur 1. Postkontrast-CT, der viser en lille forstærkende læsion i pancreaslegemet. Pilene viser læsionen.
Kontrastmagnetisk resonansbilleddannelse (MRI) afslørede en rund, veldefineret masse, 1 cm i diameter, med lav signalintensitet på T1-vægtede billeder, heterogen læsionsforstærkning i den arterielle fase på gadoliniumforstærkede T1-vægtede billeder og hyperintensitet på fedtmættede T2-vægtede billeder (Figur 2).
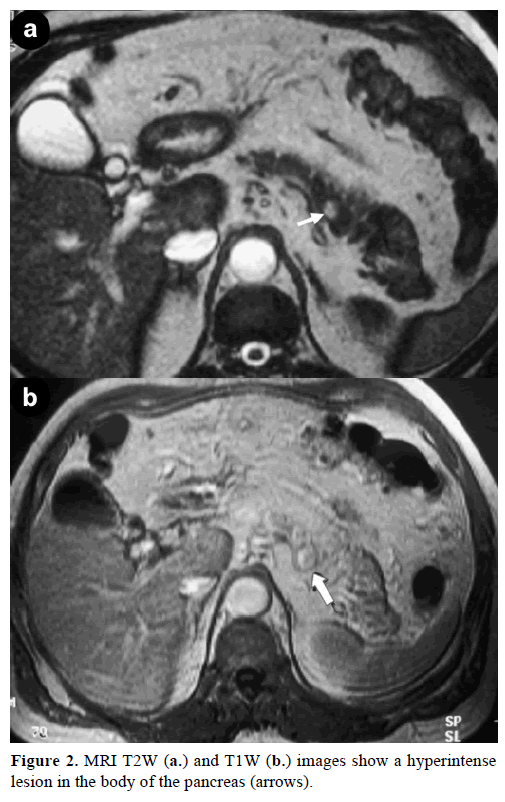
Figur 2. MRI T2W (a.) og T1W (b.) billeder viser en hyperintenselesion i pancreaslegemet (pile).
Endoskopisk ultralydsundersøgelse (EUS) viste en velafgrænset knude, ca. 1,2 cm stor, relativt homogen med veldefinerede og glatte kanter, øget blodforsyning og blandet ekkogenicitet. Disse attributter var forenelige med en neuroendokrin tumor. Massen var placeret i bugspytkirtelkroppen, direkte perifert i forhold til den celiakale stamme og mellem pancreasgangen og mavesæksvæggen. Der blev ikke konstateret regionale lymfeknuder eller andre patologiske fund.
En EUS-guided fine needle aspiration (FNA) biopsi resulterede i celleklumper af forskellig størrelse, immunopositive for chromogranin, glucagon, gastrin og somatostatin og med et Ki-67 proliferationsindeks på mindre end 2 %; disse fund var morfologisk og immunohistokemisk karakteristiske for et neuroendokrint neoplasme (figur 3).
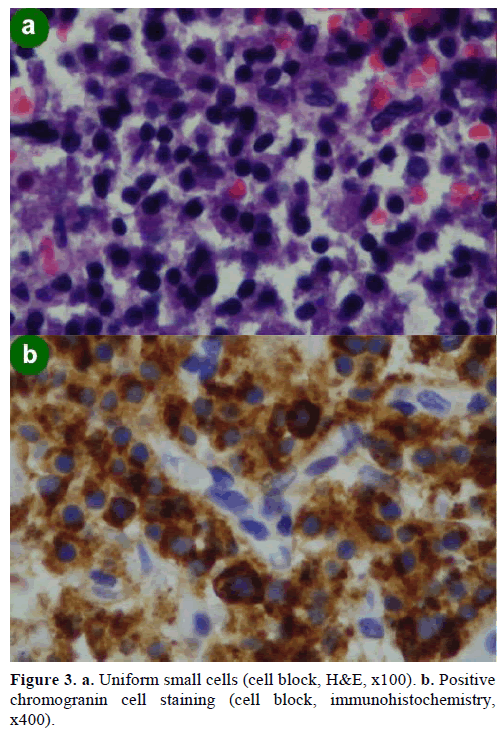
Figur 3. a. Ensartede små celler (celleblok, H&E, x100). b. Positivchromogranincellefarvning (celleblok, immunhistokemi,x400).
Helkrops 111indium-oktreotidscintigrafi var negativ for somatostatinreceptorer.
Laboratorieundersøgelser afslørede ingen unormale fund, og der var heller ingen tumormarkører såsom carcinoembryonalt antigen (CEA), alfa-fetoprotein (AFP) og CA 19-9 (15 U/mL). Serumniveauerne af glukagon, gastrin og somatostatin blev rapporteret som henholdsvis 77,2 pg/mL (referenceinterval: 30-210 pg/mL), 20 pg/mL (referenceinterval: 0-110 pg/mL) og 19,3 pg/mL (referenceinterval: 5-27 pg/mL). For at udelukke multipel endokrin neoplasi type 1 syndrom (MEN-1) blev følgende serumhormonniveauer målt: parathormon (PTH) intakt (82,4 pg/mL; referenceinterval: 15-65 pg/mL), triiodothyronin (T3: 0,9 ng/mL; referenceinterval: 0.7-1,5 ng/mL), thyroxin (T4: 7,4 μg/dL; referenceområde: 4,5- 12 μg/dL), thyreoideastimulerende hormon (TSH: 1,8 μIU/mL; referenceområde: 0,4-4,5 μIU/mL), frit thyroxin-indeks, (FTI: 9,7μg/dL; referenceområde: 6,3- 12,4μg/dL). Hypofyse-MRI var ubemærket.
På baggrund af ovenstående resultater blev der mistænkt en ikke-fungerende endokrin tumor, og der blev foretaget en distal pancreatectomi med splenectomi. Den kirurgiske prøve indeholdt en rund, velafgrænset, glat, glat, mørkerød knude, 1 cm i diameter, omgivet af pancreatisk væv. Der blev ikke identificeret andre læsioner groft set efter omhyggelig sektionering. Mikroskopisk havde knuden struktur som en milt. Massen blev således diagnosticeret som en IPAS (figur 4 og 5). Otte lymfeknuder, der blev identificeret ved milthjælummet, var benigne.
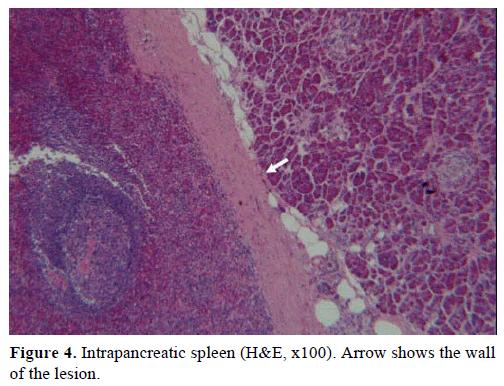
Figur 4. Intrapankreatisk milt (H&E, x100). Pilen viser væggen af læsionen.
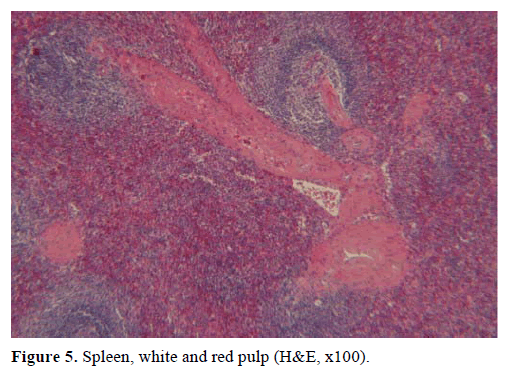
Figur 5. Milten, hvid og rød pulpa (H&E, x100).
DISKUSSION
Ektopisk miltvæv kan inddeles i to kategorier: splenose som følge af autotransplantation af miltvæv (normalt efter splenectomi) og accessoriske milter, som udgør medfødte foci af sundt miltvæv, der er adskilt fra miltens hovedkrop . Embryologisk set stammer milten fra mesenkymalt væv, som ligger mellem lagene i det dorsale mesogastrium. I den 6. til 8. leveuge befinder milten sig tæt på den mest cefale forlængelse af mesonephros . Efter splenorenal fusion kan der findes en accessorisk milt pararenalt og retroperitonealt, eller den kan gå ned i bækkenet eller scrotum . Ved en grov undersøgelse er en IPAS normalt omgivet af en fibrotisk kapsel, som adskiller den fra det tilstødende pancreatiske parenkym. Dens histologi ligner den ortotopiske milt . Læsioner eller processer vedrørende milten, såsom hæmosiderose, leukæmi, lymfom og hypersplenisme, kan påvirke accessorisk miltvæv. Derfor bør en omhyggelig søgning efter accessorisk milt overvejes i differentialdiagnosen af nodulære tætheder påvist ved radiologisk undersøgelse af bugspytkirtlen .
Eksistensen af en IPAS bør overvejes, når en pancreasmasse har CT-tætheder og/eller MRI-signalintensiteter, der ligner miltens, på prækontrast- og kontrastforstærkede billeder af alle billeddannelsesmodaliteter. Især kan en inhomogen forstærkning af en IPAS i de tidlige faser være et diagnostisk fingerpeg. Angiografisk påvisning af en blodforsyning fra milten kan være nyttig til at udelukke en pancreas- eller en binyretumor .
Differentialdiagnoser for intra- og peri-pancreatisk accessorisk milt kan omfatte pancreatiske neuroendokrine tumorer, lymfoepithelcyster, lymfomer, hypervaskulære metastaser, solide pseudopapillære tumorer og pancreatiske adenokarcinomer . I øjeblikket er der ingen kliniske eller radiografiske kriterier for diagnosticering eller differentiering af en IPAS fra en malignitet .
De radiologiske fund og den præoperative diagnose af de henviste, kirurgisk resecerede og patologisk bekræftede IPAS er opsummeret i tabel 1. De fleste tilfælde blev oprindeligt anset for at være ikke-fungerende endokrine tumorer eller isletcelletumorer, og kun et ud af tolv tilfælde blev præoperativt endeligt diagnosticeret som en IPAS efter mislykket gentagen kirurgisk behandling for idiopatisk trombocytopenisk purpura (ITP). Størrelsen varierede fra 1,0 til 2,5 cm, med en middelværdi på 1,55 cm . Ikke-funktionelle endokrine tumorer udgør 15-41 % af de endokrine pancreastumorer, og deres maligne transformationsprocent er 62-92 %, afhængigt af tumortypen . Total resektion af tumoren er den ultimative forudsigelse af langtidsoverlevelsen, uafhængigt af størrelse, placering, histologisk differentiering, lymfeknudeinvolvering og andre parametre .
Da der ikke er fastsat nogen grænseværdi for størrelse til at skelne mellem maligne og benigne ikke-fungerende neuroendokrine tumorer i bugspytkirtlen, er det blevet foreslået, at alle sådanne tumorer større end 1 cm bør udskæres, hvis patienten er en god kandidat til kirurgi .
På basisultralyd i gråskala ses en IPAS normalt som en rund eller oval masse med en svagt ekkogen og homogen tekstur, omgivet af en grænseflade med høj amplitude og med forstærkning bag læsionen. Ved farve- eller power-dopplerultralyd er det blevet rapporteret, at en karakteristisk blodforsyning (som repræsenterer det vaskulære hilum, der går ind i massen) giver 90 % sensitivitet ved diagnosticering af en IPAS . Ved kontrastforstærket ultralydsundersøgelse (CEUS) med Levovist® (Schering, Berlin, Tyskland) viser en IPAS inhomogen forstærkning i den tidlige vaskulære fase, forstærkning svarende til milt i den postvaskulære fase og langvarig forstærkning i den hepatospleniske parenkymfase .
Fundet ved EUS omfatter en rund til oval læsion med skarpe regelmæssige kanter og homogen ekkotekstur, der varierer fra hypo- til hyper-echoisk . EUS-guidet FNA cytologi afslører en population af overvejende små lymfocytter og et blandet inflammatorisk infiltrat, der repræsenterer hvid pulpa. Der observeres også en tydelig vaskulær komponent bestående af tyndvæggede blodkar, der repræsenterer miltære bihuler … Disse bihuler er veldefinerede på cellebloksektioner. Interessant er det, at de buttede endothelceller fra milt-sinus-endene har en karakteristisk immunfarve for CD8, som er mere almindeligt kendt som en T-cellemarkør. Farvningen synes at være specifik, fordi systemiske endothelceller og hæmangiomer er negative for CD8 . I tilfælde, hvor FNA af den accessoriske milt kun giver lymfocytter uden andre miltelementer, kan flowcytometri og immunhistokemi anvendes til at udelukke en lymfoproliferativ lidelse, herunder Hodgkin-lymfom, selv om en endelig diagnose af accessorisk milt ikke kan bekræftes . Schreiner et al. rapporterede tre tilfælde af IPAS, der blev diagnosticeret ved EUS-guidet FNA-biopsi . I vores tilfælde, sandsynligvis på grund af prøvetagning af isletcelleklynger fra det tilstødende pancreatiske parenkym, indikerede den samme procedure en neuroendokrin tumor, hvilket førte til kirurgisk overbehandling.
En lignende falsk positiv EUS-FNA, hvor en pancreatisk miltknude blev forvekslet med en isletcelletumor, er også blevet rapporteret af Ardengh et al. . Generelt har EUS-FNA en høj (80-90 %) sensitivitet og specificitet for pancreatiske neuroendokrine tumorer, selv om dens nøjagtighed for sådanne tumorer anses for at være lavere end for pancreatisk adenokarcinom . For at minimere diagnostiske fejl bør EUS-FNA af små neuroendokrine tumorer udføres af en erfaren endoskopiker, og den cytopatologiske vurdering bør kombineres med immunohistokemi .
99mTechnetium-scintigrafi af varmebeskadigede røde blodlegemer (99mTc-HDRBC) kombineret med enkeltfotonemissions-computertomografi (SPECT) er en meget følsom og specifik metode til påvisning af miltvæv, da op til 90 % af de injicerede HDRBC’er fanges af dette væv . Selv om scintigrafi giver mulighed for selektiv synliggørelse af milten med et fremragende forhold mellem milt og lever, er det stadig vanskeligt at synliggøre milten under forhold, hvor der er tale om minimalt fungerende miltvæv, som f.eks. i tilfælde af accessoriske miltvæv . Desuden giver scintigrafi, selv med SPECT, en ringere rumlig opløsning end andre tværsnitlige billeddannelsesmodaliteter som f.eks. CT eller MRI. Derfor anvendes scintigrafi ofte sammen med andre tværsnitlige billeddannelsesteknikker. Desuden er superparamagnetisk jernoxid (SPIO)-forstærket MRI rapporteret som et fremragende alternativ til 99mTc-HDRBC-scintigrafi, når en IPAS har et signalfald svarende til miltens. Ud over det refererede signaldrop er en anden forskel mellem IPAS’er og hypervaskulære pancreasneoplasmer den heterogene forstærkning på CT-scanning i arteriel fase .
Accessormælder kan kræve kirurgisk behandling, når de efterligner lymfadenopatier eller tumorer, eller når de bliver symptomatiske på grund af torsion, spontan ruptur, blødning eller cystedannelse. Alt funktionelt miltvæv bør også fjernes til behandling af hæmatologiske lidelser som f.eks. ITP.
Sammenfattende vil moderne billeddannelsesteknikker sandsynligvis føre til, at der i fremtiden vil blive opdaget et stigende antal intrapancreatiske accessoriske miltceller, hvilket vil medføre betydelige diagnostiske og terapeutiske udfordringer. I sådanne tilfælde bør alle ikke-invasive diagnostiske midler anvendes for at undgå unødvendige kirurgiske indgreb og mindske den samlede patientmorbiditet.
Interessekonflikter
Forfatterne har ingen potentielle interessekonflikter
- Halpert B, Gyorkey F. Lesioner observeret i accessoriske spleener hos 311 patienter. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Accessoriske spleener i eller ved bugspytkirtlens hale: En undersøgelse af 2.700 yderligere nekropsier. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapancreatisk accessorisk milt: fund på MR-billeddannelse, CT, US og scintigrafi og den patologiske analyse. Korean J Radiol 2008; 9:162-74.
- Moore K. Mennesket under udvikling. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Et bidrag til embryologi, topografi og patologi af ektopisk miltvæv. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid miltcyste, der forekommer i en intrapancreatisk accessorisk milt. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Accessorisk milt i hovedet af pancreas. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreatisk accessorisk milt: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Mindelzun RE, Jeffrey RB. Intrapancreatisk accessorisk milt, der efterligner en pancreatisk masse på CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikal pancreatoduodenektomi for fejldiagnosticeret pancreatisk masse. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapancreatisk accessorisk milt, der efterligner en endokrin tumor i pancreas: case report and review of the literature. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPom og ikke-funktionelle endokrine pancreastumorer: Klinisk præsentation, diagnose og fremskridt i behandlingen. I: Mignon M, Jensen RT, eds. Endokrine tumorer i bugspytkirtlen: Recent Advances in Research and Management: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Schweiz: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endokrine tumorer i bugspytkirtlen. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Maligne ikke-funktionelle endokrine tumorer i pancreas: prædiktive faktorer for overlevelse efter kirurgisk behandling. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonografi af den accessoriske milt. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Lee JY, Han JK, Choi BI. Kontrastforstærket sonografi af intrapancreatisk accessorisk milt hos seks patienter. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessorisk milt: en potentiel årsag til fejldiagnosticering ved EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenose diagnosticeret ved fineneedle aspirationscytologi: en case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnosticering af et tilfælde ved hjælp af finnålsaspirationscytologi. Acta Cytol 1988; 32:91-3.
- Kraus MD. Splenisk histologi og histopatologi: en opdatering. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. A case report. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosticering af dybtliggende lymfomer og leukæmi ved hjælp af endoskopisk ultralydsvejledt finnålsaspirationsbiopsi. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreatisk accessorisk milt: efterligning af pancreatisk endokrin tumor diagnosticeret ved endoskopisk ultralydsvejledt finnålsaspirationsbiopsi. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-guided FNA i diagnosen af pancreatiske neuroendokrine tumorer før kirurgi. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Værdien af endoskopisk ultralydsvejledt finnålsaspirationsbiopsi ved diagnosticering af solide pancreatiske masser. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatisk accessorisk milt diagnosticeret ved hjælp af technetium-99m varmebeskadiget røde blodlegemer SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT og superparamagnetisk jernoxid (SPIO)-forstærket MR-fund af intrapankreatisk accessorisk milt hos syv patienter. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreatisk accessorisk milt. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Accessorisk milt, der forårsager en masse i bugspytkirtlens hale: MR-billeddannelse fund. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapancreatisk accessorisk milt. en sjælden årsag til pancreatisk masse. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatisk accessorisk milt. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatisk accessorisk milt, der efterligner en neuroendokrin tumor: magnetisk resonansfund og den mulige diagnostiske rolle af forskellige nuklearmedicinske test. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoskopisk miltbevarende resektion af pancreashaler for en intrapancreatisk accessorisk milt, der efterligner en ikke-fungerende endokrin tumor: rapport om et tilfælde. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Kliniske udfordringer og billeder inden for GI. Intrapancreatisk accessorisk milt, der efterligner en ikke-fungerende neuroendokrin tumor. Gastroenterology 2006; 131:350, 689.