Nyckelord
Endosonografi; Neuroendokrina tumörer; Pankreatektomi
Abkortningar
HDRBC: värmeskadad röd blodkropp; IPAS: Intrapancreatisk accessorisk mjälte; ITP: Idiopatisk trombocytopenisk purpura; SPECT: SPIO: superparamagnetisk järnoxid
INLEDNING
Ektopisk accessorisk mjältvävnad kan hittas var som helst längs mjältkärlen, i jejunumväggen, i mesenteriet, i större omentum, i bäckenet eller i vänster scrotum. Även om det sällan märks radiologiskt är det relativt vanligt och förekommer hos cirka 10 % av befolkningen enligt obduktionsstudier. Accessoriska mjältor är i 80 % av fallen belägna vid eller i närheten av mjälthjälmen. I resten av fallen finns den antingen i bukspottkörtelns svans eller i närheten av den. Accessoriska mjältor utgör vanligtvis inget kliniskt hot och de radiologiska fynden från de för närvarande avancerade avbildningsteknikerna är användbara diagnostiska verktyg för att undvika kirurgi . Den enda säkra diagnostiska metoden är direkt provtagning, såvida den inte felaktigt ger pankreasöarna, som i vårt fall. I denna rapport analyserar vi fallet med en kirurgiskt behandlad intrapankreatisk accessorisk mjälte (IPAS) som radiologiskt och cytologiskt efterliknade en neuroendokrin tumör i bukspottkörteln.
FAKUSBERÄTTELSE
En 60-årig kaukasisk man remitterades till vår klinik för ytterligare utvärdering och behandling av en tillfällig solitär massa, i bukspottkörtelns kropp, som efterliknade en endokrin tumör. Vid en rutinkontroll hade patienten en lätt förhöjning av kolhydratantigenet (CA) 19-9 till 40 U/mL (referensintervall: 0-37 U/mL). Kontrastspiral datortomografi (CT) visade en rund homogen lesion, 1,2 cm i diameter, belägen i den övre delen av bukspottkörtelkroppen (figur 1).
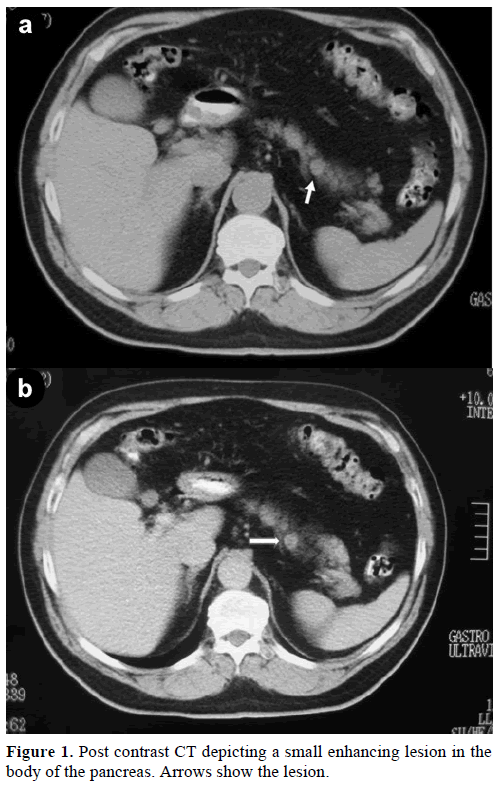
Figur 1. Postkontrast-CT som visar en liten förstärkande lesion i bukspottkörtelns kropp. Pilarna visar lesionen.
Kontrastmagnetisk resonanstomografi (MRT) avslöjade en rund, väldefinierad massa, 1 cm i diameter, med låg signalintensitet på T1-viktade bilder, heterogen lesionsförstärkning under den arteriella fasen på gadoliniumförstärkta T1-viktade bilder och hyperintensitet på fettmättade T2-viktade bilder (Figur 2).
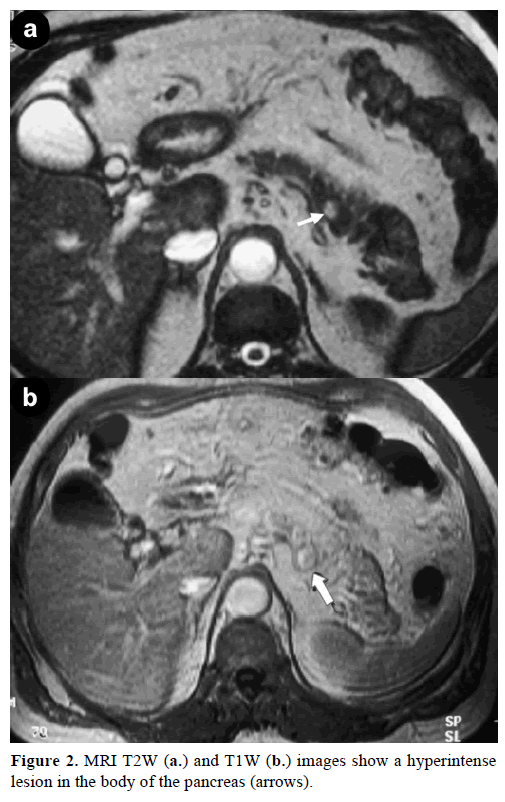
Figur 2. MRI T2W (a.) och T1W (b.) bilder visar en hyperintenselesion i bukspottkörtelns kropp (pilar).
Endoskopisk ultraljudsundersökning (EUS) visade en väldefinierad knöl, ca 1,2 cm stor, relativt homogen med väldefinierade och släta marginaler, ökad blodtillförsel och blandad ekogenicitet. Dessa attribut var förenliga med en neuroendokrin tumör. Massan var belägen i bukspottkörtelns kropp, direkt perifert i förhållande till celiakuströmmen och mellan bukspottkörtelgången och magsäcksväggen. Inga regionala lymfkörtlar eller andra patologiska fynd noterades.
En EUS-guidad biopsi med fin nålaspiration (FNA) resulterade i cellkluster av olika storlek, immunopositiva för kromogranin, glukagon, gastrin och somatostatin och med ett Ki-67-proliferationsindex på mindre än 2 %; dessa fynd var morfologiskt och immunohistokemiskt karakteristiska för en neuroendokrin neoplasm (figur 3).
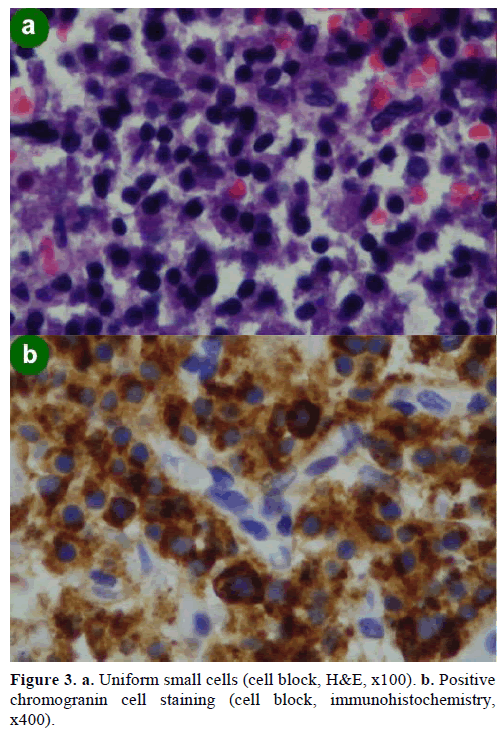
Figur 3. a. Enhetliga små celler (cellblock, H&E, x100). b. Positiv färgning av kromograninceller (cellblock, immunohistokemi,x400).
Helkroppsscintigrafi med 111indium-oktreotid var negativ för somatostatinreceptorer.
Laboratorietesterna visade inga onormala fynd och det fanns inte heller några tumörmarkörer såsom carcinoembryonalt antigen (CEA), alfa-fetoprotein (AFP) och CA 19-9 (15 U/mL). Serumnivåerna av glukagon, gastrin och somatostatin rapporterades som 77,2 pg/mL (referensintervall: 30-210 pg/mL), 20 pg/mL (referensintervall: 0-110 pg/mL) respektive 19,3 pg/mL (referensintervall: 5-27 pg/mL). För att utesluta multipel endokrin neoplasi typ 1 syndrom (MEN-1) mättes följande serumhormonnivåer: parathormon (PTH) intakt (82,4 pg/mL; referensintervall: 15-65 pg/mL), trijodtyronin (T3: 0,9 ng/mL; referensintervall: 0.7-1,5 ng/mL), tyroxin (T4: 7,4 μg/dL; referensintervall: 4,5- 12 μg/dL), sköldkörtelstimulerande hormon (TSH: 1,8 μIU/mL; referensintervall: 0,4-4,5 μIU/mL), index för fritt tyroxin (FTI: 9,7μg/dL; referensintervall: 6,3- 12,4μg/dL). Hypofysens MRT var okej.
På grundval av ovanstående resultat misstänktes en icke-fungerande endokrin tumör och en distal pankreatektomi med splenektomi utfördes. Det kirurgiska provet innehöll en rund, väl avgränsad, slät, mörkröd nodul, 1 cm i diameter, omgiven av pankreasvävnad. Inga andra lesioner identifierades grovt efter noggrann sektionering. Mikroskopiskt hade knölen strukturen av en mjälte. Massan diagnostiserades därför som en IPAS (figurerna 4 och 5). Åtta lymfkörtlar, som identifierades vid mjältans hilum, var godartade.
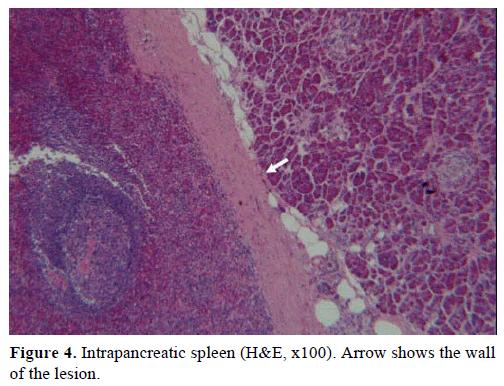
Figur 4. Intrapankreatisk mjälte (H&E, x100). Pilen visar skadans vägg.
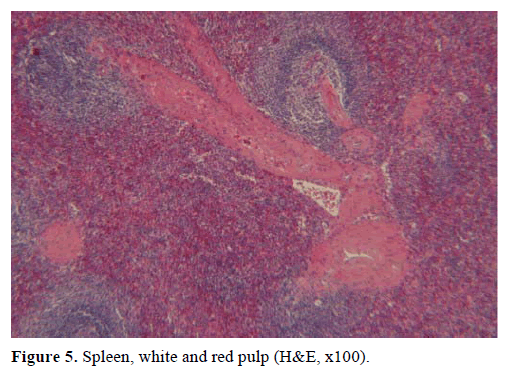
Figur 5. Mjälte, vit och röd massa (H&E, x100).
DISKUSSION
Ektopisk mjältvävnad kan klassificeras i två kategorier: splenos på grund av autotransplantation av mjältvävnad (vanligen efter splenektomi) och accessoriska mjältor som utgör medfödda fynd av frisk mjältvävnad som är separerad från mjältens huvudkropp . Embryologiskt sett härstammar mjälten från mesenkymal vävnad som ligger mellan lagren i det dorsala mesogastriet. Under den sjätte till åttonde levnadsveckan befinner sig mjälten i nära anslutning till den mest cefala förlängningen av mesonefros . Efter fusionen av mjälten kan en extra mjälte finnas pararenalt och retroperitonealt, eller så kan den gå ner i bäckenet eller scrotum . Vid en grov undersökning är IPAS vanligen omgiven av en fibrotisk kapsel som skiljer den från den intilliggande bukspottkörtelparenkymet. Histologin liknar den ortotoperta mjälten. Läsioner eller processer som rör mjälten, t.ex. hemosideros, leukemi, lymfom och hypersplenism, kan påverka accessorisk mjältvävnad. Därför bör ett noggrant sökande efter accessorisk mjälte övervägas i differentialdiagnosen av nodulära tätheter som påvisas genom radiologisk undersökning av bukspottkörteln .
Förekomsten av en IPAS bör övervägas när en bukspottkörtelmassa har CT-tätheter och/eller MRT-signalintensitet som liknar mjältens på förkontrast- och kontrastförstärkta bilder av alla bildgivande modaliteter. I synnerhet kan en inhomogen förstärkning av en IPAS i dess tidiga faser vara en diagnostisk ledtråd. Angiografiskt påvisande av en blodtillförsel från mjälten kan vara till hjälp för att utesluta en tumör i bukspottkörteln eller binjuren .
Differentialdiagnosen för intra- och peri-pankreatisk accessorisk mjälte kan innefatta neuroendokrina tumörer i bukspottkörteln, lymfoepitelcystor, lymfom, hypervaskulära metastaser, solida pseudopapillära tumörer och pankreatiska adenokarcinom . För närvarande finns det inga kliniska eller radiografiska kriterier för diagnos eller differentiering av en IPAS från en malignitet .
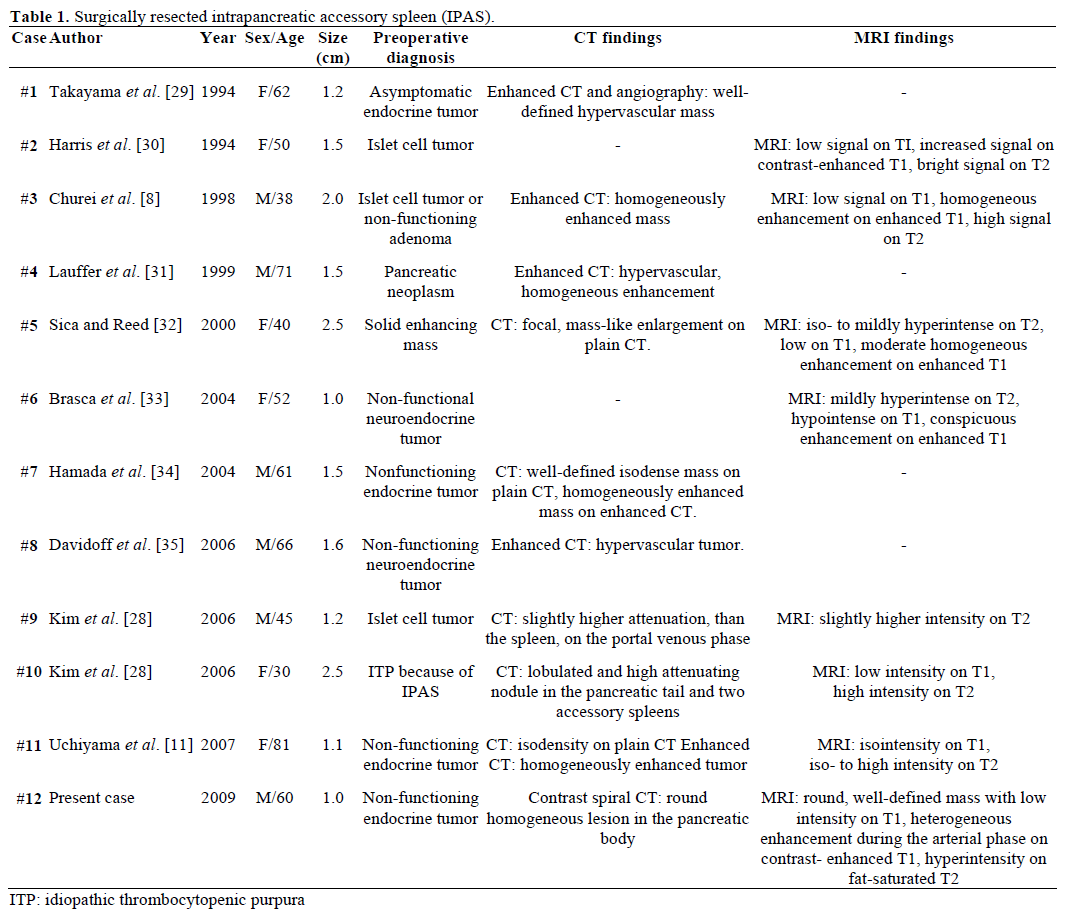
Radiologiska fynd och preoperativ diagnos av de remitterade, kirurgiskt resecerade och patologiskt bekräftade IPAS sammanfattas i tabell 1. De flesta fallen ansågs inledningsvis vara icke-fungerande endokrina tumörer eller ö-cellstumörer och endast ett av tolv fall diagnostiserades slutgiltigt preoperativt som en IPAS efter misslyckad upprepad kirurgisk behandling för idiopatisk trombocytopenisk purpura (ITP). Storleken varierade från 1,0 till 2,5 cm, med ett medelvärde på 1,55 cm . Icke-fungerande endokrina tumörer utgör 15-41 % av de endokrina pankreastumörerna och graden av deras maligna omvandling är 62-92 %, beroende på tumörtyp . Total tumörresektion är den ultimata förutsägelsen för långtidsöverlevnad, oberoende av storlek, läge, histologisk differentiering, lymfkörtelpåverkan och andra parametrar .
Då ingen gränsstorlek har fastställts för att skilja mellan maligna och godartade icke-fungerande neuroendokrina tumörer i bukspottkörteln, har det föreslagits att alla sådana tumörer som är större än 1 cm bör excideras om patienten är en god kandidat för kirurgi .
På basal ultraljud i gråskala ses en IPAS vanligen som en rund eller oval massa med en svagt ekogen och homogen textur, omgiven av ett gränssnitt med hög amplitud och som visar förstärkning bakom lesionen. På färg- eller kraftdopplerultraljud har en karakteristisk blodtillförsel (som representerar det vaskulära hilum som går in i massan) rapporterats ge en 90-procentig sensitivitet vid diagnosen av en IPAS . Vid kontrastförstärkt ultraljud (CEUS) med Levovist® (Schering, Berlin, Tyskland) visar en IPAS en inhomogen förstärkning i den tidiga vaskulära fasen, en förstärkning som liknar den för mjälte under den postvaskulära fasen och en långvarig förstärkning i den hepatospleniska parenkymala fasen .
Fynd vid EUS är bland annat en rund till oval lesion med skarpa, regelbundna marginaler och en homogen ekotextur, som sträcker sig från hypo- till hyperekoisk . EUS-guidad FNA-cytologi avslöjar en population av övervägande små lymfocyter och ett blandat inflammatoriskt infiltrat som representerar vit massa. En tydlig kärlkomponent bestående av tunnväggiga blodkärl som representerar mjältans sinus observeras också. Dessa sinus är väl synliga på cellblocksektioner. Intressant är att de fylliga endotelcellerna i mjältans sinus karakteriseras av CD8, som är mer allmänt erkänd som en T-cellsmarkör. Färgningen verkar vara specifik, eftersom systemiska endotelceller och hemangiom är negativa för CD8 . I de fall då FNA av den accessoriska mjälten endast ger lymfocyter, utan andra mjältdelar, kan flödescytometri och immunohistokemi användas för att utesluta en lymfoproliferativ sjukdom, inklusive Hodgkins lymfom, även om den definitiva diagnosen accessorisk mjälte inte kan bekräftas . Schreiner et al. rapporterade tre fall av IPAS som diagnostiserades genom EUS-guidad FNA-biopsi . I vårt fall, troligen på grund av provtagning av ö-cellkluster från den intilliggande bukspottkörtelparenkymet, indikerade samma förfarande en neuroendokrin tumör, vilket ledde till kirurgisk överbehandling.
En liknande falskt positiv EUS-FNA, där en pankreatisk mjältknöl misstogs för en ö-cellstumör, har också rapporterats av Ardengh et al . I allmänhet har EUS-FNA en hög (80-90 %) sensitivitet och specificitet för neuroendokrina tumörer i bukspottkörteln även om dess noggrannhet för sådana tumörer anses vara lägre än för adenokarcinom i bukspottkörteln . För att minimera diagnostiska fel bör EUS-FNA av små neuroendokrina tumörer utföras av en erfaren endoskopist och den cytopatologiska bedömningen bör kombineras med immunohistokemi .
99mTechnetium-scintigrafi av värmeskadade röda blodkroppar (99mTc-HDRBC) i kombination med datortomografi med enkel fotonemission (SPECT) är en mycket känslig och specifik metod för att upptäcka mjältvävnad, eftersom upp till 90 % av de injicerade HDRBC:erna fångas upp av denna vävnad . Även om scintigrafi gör det möjligt att selektivt visualisera mjälten med ett utmärkt förhållande mellan mjälte och lever, är det fortfarande svårt att visualisera mjälten under förhållanden där det finns minimalt fungerande mjältvävnad, som i fall med accessoriska mjältor . Dessutom ger scintigrafi, även med SPECT, sämre spatial upplösning jämfört med andra tvärsnittsbilder som CT eller MRT. Därför används scintigrafi ofta tillsammans med andra tvärsnittsbildgivande tekniker. Dessutom har superparamagnetisk järnoxid (SPIO)-förstärkt MRT rapporterats som ett utmärkt alternativ till 99mTc-HDRBC-scintigrafi, när en IPAS har ett signalfall som liknar det i mjälten. Förutom det refererade signalfallet är en annan skillnad mellan IPAS och hypervaskulära pankreasneoplasmer den heterogena förstärkningen vid CT-scanning i arteriell fas .
Accessoriska mjältor kan behöva kirurgisk behandling när de efterliknar lymfadenopatier eller tumörer, eller när de blir symtomatiska på grund av torsion, spontan ruptur, blödning eller cystbildning. All funktionell mjältvävnad bör också avlägsnas för behandling av hematologiska sjukdomar som ITP.
Slutsatsen är att moderna avbildningstekniker troligen kommer att leda till att ett ökande antal intrapankreatiska accessoriska mjältor kommer att upptäckas i framtiden, vilket innebär betydande diagnostiska och terapeutiska utmaningar. I sådana fall bör alla icke-invasiva diagnostiska medel användas för att undvika onödiga kirurgiska ingrepp och minska patientens totala morbiditet .
Intressekonflikter
Författarna har inga potentiella intressekonflikter
- Halpert B, Gyorkey F. Lesioner som observerats i accessoriska spleener hos 311 patienter. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Accessorisk mjälte i eller vid bukspottkörtelns svans: En undersökning av 2 700 ytterligare nekropsier. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapankreatisk accessorisk mjälte: fynd vid MR-avbildning, CT, US och scintigrafi samt patologisk analys. Korean J Radiol 2008; 9:162-74.
- Moore K. Människan under utveckling. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Ett bidrag till embryologi, topografi och patologi för ektopisk mjältvävnad. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cysting occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Accessorisk mjälte i bukspottkörtelns huvud. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapankreatisk accessorisk mjälte: fallrapport. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapankreatisk accessorisk mjälte som efterliknar pankreasmassa på CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikal pankreatoduodenektomi för feldiagnostiserad bukspottkörtelmassa. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapankreatisk accessorisk mjälte som efterliknar endokrin tumör i bukspottkörteln: fallrapport och litteraturgenomgång. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPom och icke-fungerande endokrina tumörer i bukspottkörteln: Klinisk presentation, diagnos och framsteg i hanteringen. I: Mignon M, Jensen RT, eds. Endokrina tumörer i bukspottkörteln: Recent Advances in Research and Management: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Schweiz: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endokrina tumörer i bukspottkörteln. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Maligna icke-fungerande endokrina tumörer i bukspottkörteln: prediktiva faktorer för överlevnad efter kirurgisk behandling. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonografi av den accessoriska mjälten. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Kontrastförstärkt sonografi av intrapankreatisk accessorisk mjälte hos sex patienter. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: a potential cause of misdiagnosis at EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnos av ett fall med hjälp av fin nålsaspirationscytologi. Acta Cytol 1988; 32:91-3.
- Kraus MD. Splenisk histologi och histopatologi: en uppdatering. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. En fallrapport. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnos av djupt liggande lymfom och leukemi med hjälp av endoskopisk ultraljudsstyrd finnålsaspirationsbiopsi. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapankreatisk accessorisk mjälte: mimik av pankreatisk endokrin tumör diagnostiserad med endoskopisk ultraljudsstyrd finnålsaspirationsbiopsi. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-guidad FNA vid diagnos av neuroendokrina tumörer i bukspottkörteln före operation. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Värdet av endoskopisk ultraljudsstyrd fin nålsaspirationsbiopsi vid diagnos av solida pankreasmassor. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapankreatisk accessorisk mjälte diagnostiserad med technetium-99m värmeskadade röda blodkroppar SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT och superparamagnetisk järnoxid (SPIO)-förstärkt MR-fynd av intrapankreatisk accessorisk mjälte hos sju patienter. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapankreatisk accessorisk mjälte. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Accessorisk mjälte som orsakar en massa i bukspottkörtelns svans: MR-avbildningsfynd. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapankreatisk accessorisk mjälte: en sällsynt orsak till pankreatisk massa. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapankreatisk accessorisk mjälte. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapankreatisk accessorisk mjälte som efterliknar en neuroendokrin tumör: magnetresonansfynd och eventuell diagnostisk roll för olika nuklearmedicinska tester. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Kliniska utmaningar och bilder inom GI. Intrapankreatisk accessorisk mjälte som efterliknar en icke-fungerande neuroendokrin tumör. Gastroenterology 2006; 131:350, 689.