Parole chiave
Endosonografia; Tumori neuroendocrini; Pancreatectomia
Abbreviazioni
HDRBC: globuli rossi danneggiati dal calore; IPAS: milza accessoria intrapancreatica; ITP: porpora trombocitopenica idiopatica; SPECT: SPECT: single photon emission computed tomography; SPIO: superparamagnetic iron oxide
INTRODUZIONE
Il tessuto splenico accessorio ectopico si può trovare ovunque lungo i vasi splenici, nella parete del digiuno, nel mesentere, nell’omento maggiore, nella pelvi o nello scroto sinistro. Anche se raramente si nota radiologicamente, è relativamente comune, verificandosi in circa il 10% della popolazione secondo gli studi autoptici. Le milze accessorie si trovano all’ilo splenico o vicino ad esso nell’80% dei casi. Nel resto dei casi si verifica nella coda pancreatica o vicino ad essa. Le milze accessorie di solito non rappresentano una minaccia clinica e i risultati radiologici delle tecniche di imaging attualmente avanzate sono strumenti diagnostici utili per evitare la chirurgia. L’unico metodo diagnostico sicuro è il campionamento diretto, a meno che non produca falsamente le cellule delle isole pancreatiche, come nel nostro caso. In questa relazione analizziamo il caso di una milza accessoria intrapancreatica trattata chirurgicamente (IPAS) che radiologicamente e citologicamente imitava un tumore pancreatico neuroendocrino.
Rapporto del caso
Un maschio caucasico di 60 anni si è rivolto alla nostra clinica per un’ulteriore valutazione e trattamento di una massa solitaria incidentale, nel corpo del pancreas, che imitava un tumore endocrino. In un controllo di routine, il paziente aveva un leggero aumento dell’antigene carboidrato (CA) 19-9 a 40 U/mL (range di riferimento: 0-37 U/mL). La tomografia spirale computerizzata (TC) con contrasto ha mostrato una lesione rotonda omogenea, di 1,2 cm di diametro, situata nella parte superiore del corpo pancreatico (Figura 1).
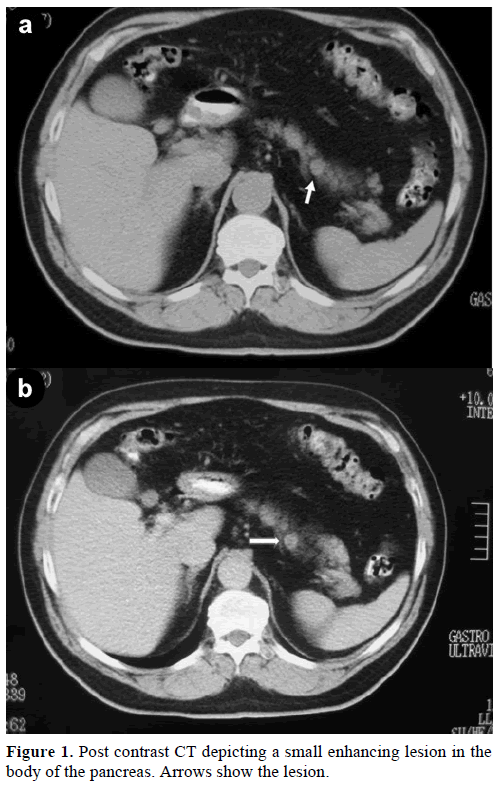
Figura 1. CT post contrasto che mostra una piccola lesione che aumenta nel corpo del pancreas. Le frecce mostrano la lesione.
La risonanza magnetica di contrasto (MRI) ha rivelato una massa rotonda, ben definita, di 1 cm di diametro, con bassa intensità di segnale sulle immagini T1-pesate, aumento eterogeneo della lesione durante la fase arteriosa sulle immagini T1-pesate con gadolinio e iperintensità sulle immagini T2-sature di grasso (Figura 2).
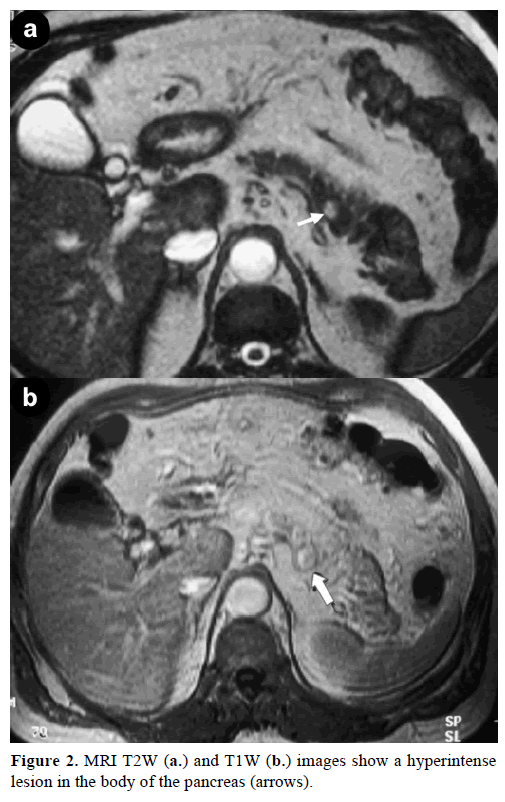
Figura 2. Le immagini RM T2W (a.) e T1W (b.) mostrano un’iperintensificazione nel corpo del pancreas (frecce).
L’ecografia endoscopica (EUS) ha mostrato un nodulo ben delineato, di circa 1,2 cm, relativamente omogeneo con margini ben definiti e lisci, un aumento del flusso sanguigno e un’ecogenicità mista. Questi attributi erano compatibili con un tumore neuroendocrino. La massa era situata nel corpo del pancreas, direttamente in periferia al tronco celiaco e tra il dotto pancreatico e la parete gastrica. Non sono stati notati linfonodi regionali o altri risultati patologici.
Una biopsia con ago aspirato fine (FNA) guidata dall’EUS ha dato luogo a gruppi di cellule di varie dimensioni, immunopositive per cromogranina, glucagone, gastrina e somatostatina e con un indice di proliferazione Ki-67 inferiore al 2%; questi risultati erano morfologicamente e immunoistochimicamente caratteristici di una neoplasia neuroendocrina (Figura 3).
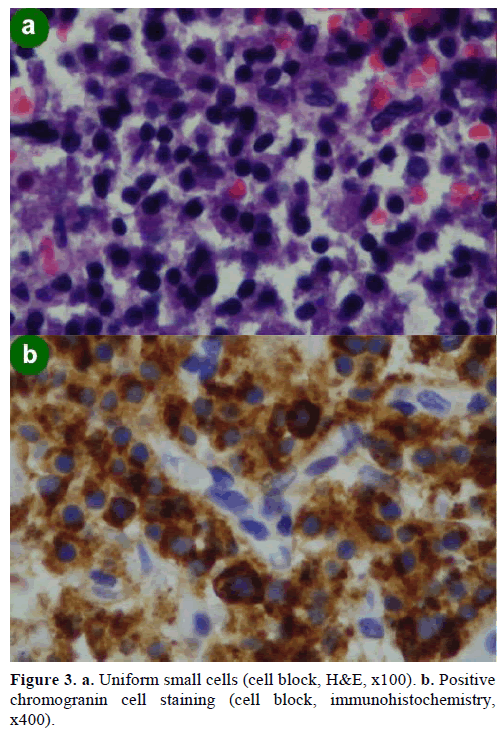
Figura 3. a. Piccole cellule uniformi (blocco di cellule, H&E, x100). b. Colorazione positiva delle cellule di cromogranina (blocco di cellule, immunoistochimica, x400).
La scintigrafia del corpo intero 111indium-octreotide era negativa per i recettori della somatostatina.
I test di laboratorio non hanno rivelato alcun risultato anormale, né erano presenti marcatori tumorali come l’antigene carcinoembrionale (CEA), l’alfa-fetoproteina (AFP) e il CA 19-9 (15 U/mL). I livelli sierici di glucagone, gastrina e somatostatina sono stati riportati come 77,2 pg/mL (range di riferimento: 30-210 pg/mL), 20 pg/mL (range di riferimento: 0-110 pg/mL) e 19,3 pg/mL (range di riferimento: 5-27 pg/mL) rispettivamente. Per escludere la sindrome da neoplasia endocrina multipla di tipo 1 (MEN-1), sono stati misurati i seguenti livelli ormonali nel siero: paratormone (PTH) intatto (82,4 pg/mL; intervallo di riferimento: 15-65 pg/mL), triiodotironina (T3: 0,9 ng/mL; intervallo di riferimento: 0.7-1.5 ng/mL), tiroxina (T4: 7.4 μg/dL; range di riferimento: 4.5- 12 μg/dL), ormone stimolante la tiroide (TSH: 1.8 μIU/mL; range di riferimento: 0.4-4.5 μIU/mL), indice di tiroxina libera, (FTI: 9.7μg/dL; range di riferimento: 6.3- 12.4μg/dL). La risonanza magnetica ipofisaria era irrilevante.
Sulla base dei risultati di cui sopra, è stato sospettato un tumore endocrino non funzionante ed è stata eseguita una pancreatectomia distale con splenectomia. Il campione chirurgico conteneva un nodulo rotondo, ben delimitato, liscio, rosso scuro, di 1 cm di diametro, circondato da tessuto pancreatico. Nessun’altra lesione è stata identificata grossolanamente, dopo un sezionamento meticoloso. Al microscopio, il nodulo aveva la struttura di una milza. Pertanto, la massa è stata diagnosticata come un IPAS (Figure 4 e 5). Otto linfonodi, identificati all’ilo splenico, erano benigni.
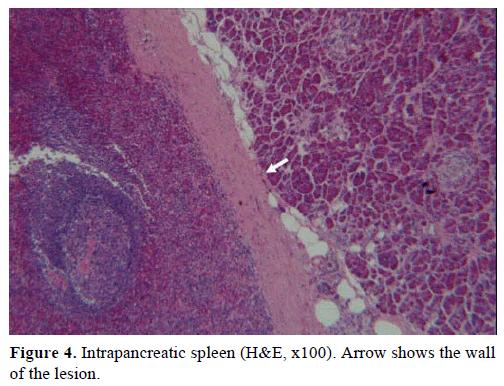
Figura 4. Milza intrapancreatica (H&E, x100). La freccia mostra il muro della lesione.
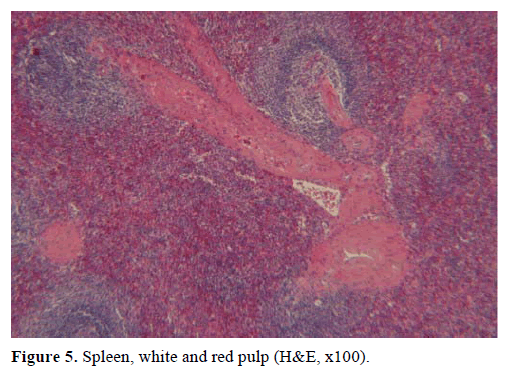
Figura 5. Milza, polpa bianca e rossa (H&E, x100).
DISCUSSIONE
Il tessuto splenico ectopico può essere classificato in due categorie: splenosi dovute ad autotrapianto di tessuto splenico (di solito dopo splenectomia) e milze accessorie che costituiscono focolai congeniti di tessuto splenico sano separati dal corpo principale della milza . Embriologicamente, la milza deriva dal tessuto mesenchimale che si trova tra gli strati del mesogastrio dorsale. Durante la sesta e l’ottava settimana di vita, la milza si trova in prossimità dell’estensione più cefalica del mesonefro. Dopo la fusione splenorenale, una milza accessoria può essere trovata pararenalmente e retroperitonealmente o può scendere nella pelvi o nello scroto. All’esame macroscopico, un IPAS è solitamente circondato da una capsula fibrotica che lo separa dal parenchima pancreatico adiacente. La sua istologia è simile alla milza ortotopica. Lesioni o processi riguardanti la milza, come l’emosiderosi, la leucemia, il linfoma e l’ipersplenismo possono interessare il tessuto splenico accessorio. Così, un’attenta ricerca di milze accessorie dovrebbe essere considerata nella diagnosi differenziale delle densità nodulari dimostrate dallo studio radiologico del pancreas.
L’esistenza di un IPAS dovrebbe essere considerata quando una massa pancreatica ha densità CT e/o intensità di segnale MRI simili a quelle della milza, sulle immagini precontrastate e contrastate di tutte le modalità di imaging. In particolare, l’aumento disomogeneo di un IPAS nelle sue fasi iniziali può essere un indizio diagnostico. La dimostrazione angiografica di un apporto di sangue splenico potrebbe essere utile per escludere un tumore pancreatico o surrenale.
La diagnosi differenziale per le milze accessorie intra- e peri-pancreatiche potrebbe includere tumori neuroendocrini pancreatici, cisti linfoepiteliali, linfomi, metastasi ipervascolari, tumori solidi pseudopapillari e adenocarcinomi pancreatici. Attualmente, non ci sono criteri clinici o radiografici per la diagnosi o la differenziazione di un IPAS da una neoplasia.
I risultati radiologici e la diagnosi preoperatoria degli IPAS riferiti, resecati chirurgicamente e confermati patologicamente sono riassunti nella Tabella 1. La maggior parte dei casi sono stati inizialmente considerati come tumori endocrini non funzionanti o tumori delle cellule delle isole e solo uno su dodici casi è stato definitivamente diagnosticato preoperatoriamente come un IPAS dopo un trattamento chirurgico ripetitivo senza successo per la porpora trombocitopenica idiopatica (ITP). Le dimensioni variavano da 1,0 a 2,5 cm, con un valore medio di 1,55 cm. I tumori endocrini non funzionanti rappresentano il 15-41% dei tumori pancreatici endocrini e il tasso della loro trasformazione maligna è del 62-92%, a seconda del tipo di tumore. La resezione totale del tumore è l’ultimo fattore predittivo della sopravvivenza a lungo termine, indipendentemente dalle dimensioni, dalla localizzazione, dalla differenziazione istologica, dal coinvolgimento linfonodale e da altri parametri.
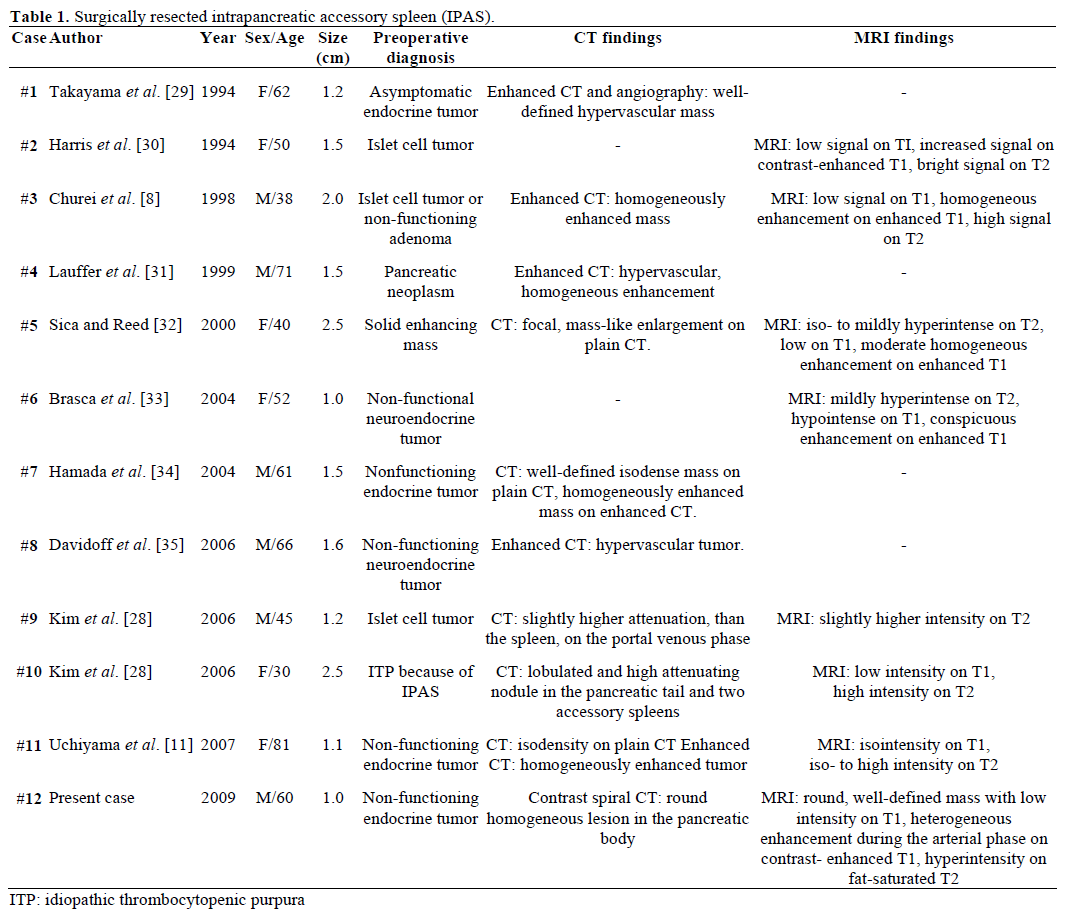
Poiché non è stato stabilito un cut-off per differenziare i tumori neuroendocrini maligni da quelli benigni non funzionanti del pancreas, è stato suggerito che tutti questi tumori superiori a 1 cm dovrebbero essere asportati se il paziente è un buon candidato alla chirurgia.
Sull’ecografia basale in scala di grigi, un IPAS è di solito visto come una massa rotonda o ovale con una texture lievemente echogenica e omogenea, circondata da un’interfaccia ad alta ampiezza e che mostra un miglioramento dietro la lesione. Nell’ecografia colorata o power Doppler, un caratteristico apporto di sangue (che rappresenta l’ilo vascolare che entra nella massa), è stato riportato per offrire una sensibilità del 90% nella diagnosi di un IPAS. Nell’ecografia con contrasto (CEUS) utilizzando Levovist® (Schering, Berlino, Germania), un IPAS mostra un aumento disomogeneo nella fase vascolare iniziale, un aumento simile a quello della milza durante la fase postvascolare e un aumento prolungato nella fase parenchimale epatosplenica.
I risultati all’EUS includono una lesione rotonda-ovale con margini regolari e nitidi e una texture eco omogenea, da ipo- a iper-ecoica. La citologia FNA guidata dall’EUS rivela una popolazione di linfociti prevalentemente piccoli e un infiltrato infiammatorio misto che rappresenta la polpa bianca. Si osserva anche una cospicua componente vascolare costituita da vasi sanguigni a parete sottile che rappresentano i seni splenici. Questi seni sono ben visualizzati sulle sezioni del blocco cellulare. È interessante notare che le cellule endoteliali dei seni splenici grassottelle si colorano caratteristicamente per CD8, che è più comunemente riconosciuto come un marcatore delle cellule T. La colorazione sembra essere specifica, perché le cellule endoteliali sistemiche e gli emangiomi sono negativi per CD8. Nei casi in cui l’FNA della milza accessoria produce solo linfociti, senza altri elementi splenici, la citometria a flusso e l’immunoistochimica possono essere impiegati per escludere un disordine linfoproliferativo, compreso il linfoma di Hodgkin, anche se una diagnosi definitiva di milza accessoria non può essere confermata. Schreiner et al. hanno riportato tre casi di IPAS diagnosticati mediante biopsia FNA guidata da EUS. Nel nostro caso, probabilmente a causa del campionamento di cluster di cellule islamiche dal parenchima pancreatico adiacente, la stessa procedura era indicativa di un tumore neuroendocrino, portando ad un sovratrattamento chirurgico.
Un simile falso positivo EUS-FNA, in cui un nodulo splenico pancreatico è stato scambiato per un tumore delle cellule islamiche è stato riportato anche da Ardengh et al. In generale, l’EUS-FNA ha un’alta (80-90%) sensibilità e specificità per i tumori neuroendocrini pancreatici, sebbene la sua accuratezza per tali tumori sia considerata inferiore a quella per l’adenocarcinoma pancreatico. Al fine di ridurre al minimo gli errori diagnostici, l’EUS-FNA dei piccoli tumori neuroendocrini dovrebbe essere eseguito da un endoscopista esperto e la valutazione citopatologica dovrebbe essere combinata con l’immunoistochimica.
99mTechnetium heat-damaged red blood cells (99mTc- HDRBC) scintigrafia, combinato con la tomografia computerizzata a emissione di fotoni singoli (SPECT), è un metodo altamente sensibile e specifico per il rilevamento del tessuto splenico, poiché fino al 90% degli HDRBC iniettati sono intrappolati da questo tessuto. Anche se la scintigrafia permette la visualizzazione selettiva della milza con un eccellente rapporto milza-fegato, la visualizzazione splenica è ancora difficile in condizioni in cui è presente tessuto splenico minimamente funzionante, come nei casi di milza accessoria. Inoltre, la scintigrafia, anche con SPECT, offre una risoluzione spaziale inferiore rispetto ad altre modalità di imaging trasversale come CT o MRI. Pertanto, la scintigrafia è spesso utilizzata in combinazione con altre tecniche di imaging trasversale. Inoltre, la risonanza magnetica superparamagnetica all’ossido di ferro (SPIO) è stata segnalata come un’eccellente alternativa alla scintigrafia 99mTc-HDRBC, quando un IPAS ha una caduta di segnale simile a quella della milza. Oltre alla caduta di segnale riferita, un’altra differenza tra gli IPAS e le neoplasie pancreatiche ipervascolari è l’aumento eterogeneo sulla TAC a fase arteriosa.
Le milze accessorie possono richiedere un trattamento chirurgico quando simulano linfoadenopatie o tumori, o quando diventano sintomatiche a causa di torsione, rottura spontanea, emorragia o formazione di cisti. Tutto il tessuto splenico funzionale dovrebbe essere rimosso anche per il trattamento di disturbi ematologici come l’ITP.
In conclusione, le moderne tecniche di imaging probabilmente porteranno alla scoperta di un numero crescente di milze accessorie intrapancreatiche in futuro, ponendo sfide diagnostiche e terapeutiche significative. In questi casi tutti i mezzi diagnostici non invasivi dovrebbero essere utilizzati per evitare procedure chirurgiche inutili e diminuire la morbilità complessiva del paziente.
Conflitto di interesse
Gli autori non hanno potenziali conflitti di interesse
- Halpert B, Gyorkey F. Lesioni osservate nelle milze accessorie di 311 pazienti. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Milze accessorie nella o alla coda del pancreas: Un’indagine su 2.700 necroscopie supplementari. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Milza accessoria intrapancreatica: risultati su MR Imaging, CT, US e scintigrafia, e l’analisi patologica. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human. Filadelfia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Milza accessoria nella coda pancreatica — un’entità trascurata? Un contributo all’embriologia, topografia e patologia del tessuto splenico ectopico. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Cisti splenica epidermoide che si verifica in una milza accessoria intrapancreatica. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Milza accessoria nella testa del pancreas. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Milza accessoria intrapancreatica: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapancreatica milza accessorio mimando massa pancreatica su CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Pancreatoduodenectomia radicale per massa pancreatica mal diagnosticata. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Milza accessoria intrapancreatica che imita il tumore endocrino del pancreas: case report e revisione della letteratura. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomi e tumori pancreatici endocrini non funzionanti: Presentazione clinica, diagnosi e progressi nella gestione. In: Mignon M, Jensen RT, eds. Tumori endocrini del pancreas: Recenti progressi nella ricerca e nella gestione. Frontiers of Gastrointestinal Research. Basilea, Svizzera: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Tumori endocrini del pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Tumori endocrini maligni non funzionanti del pancreas: fattori predittivi di sopravvivenza dopo il trattamento chirurgico. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonografia della milza accessoria. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Contrasto-enhanced sonografia di milza accessorio intrapancreatico in sei pazienti. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Milza accessoria: una potenziale causa di diagnosi errata a EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Splenosi toracica diagnosticata dalla citologia di aspirazione con ago sottile: un caso. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Splenosi toracica. Diagnosi di un caso mediante citologia di aspirazione con ago sottile. Acta Cytol 1988; 32:91-3.
- Kraus MD. Istologia e istopatologia splenica: un aggiornamento. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Aspirazione con ago sottile di splenosi toracica. Un rapporto di caso. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosi di linfoma profondo e leucemia mediante biopsia con ago sottile guidata da ultrasuoni. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Milza accessoria intrapancreatica: mimica del tumore endocrino pancreatico diagnosticato da biopsia di aspirazione dell’ago fine guidata da ecografia endoscopica. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. FNA guidato dall’EUS nella diagnosi dei tumori neuroendocrini pancreatici prima della chirurgia. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Valore della biopsia endoscopica ad ago aspirato guidata da ultrasuoni nella diagnosi di masse pancreatiche solide. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. milza accessorio intrapancreatico diagnosticato da tecnezio-99m calore danneggiato globuli rossi SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT e superparamagnetic iron oxide (SPIO)-enhanced MR findings of intrapancreatic accessory spleen in seven patients. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Milza accessoria intrapancreatica. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Milza accessoria che causa una massa nella coda del pancreas: Risultati di imaging MR. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Milza accessoria intrapancreatica: una rara causa di massa pancreatica. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiologia 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatic accessory spleen mimicking a neuroendocrine tumor: magnetic resonance findings and possible diagnostic role of different nuclear medicine tests. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Sfide cliniche e immagini in GI. Milza accessoria intrapancreatica che imita un tumore neuroendocrino non funzionante. Gastroenterologia 2006; 131:350, 689.