Schlüsselwörter
Endosonographie; Neuroendokrine Tumore; Pankreatektomie
Abkürzungen
HDRBC: heat-damaged red blood cell; IPAS: intrapancreatic accessory spleen; ITP: idiopathic thrombocytopenic purpura; SPECT: Einzelphotonen-Emissions-Computertomographie; SPIO: superparamagnetisches Eisenoxid
EINLEITUNG
Ektopes akzessorisches Milzgewebe kann überall entlang der Milzgefäße, in der Wand des Jejunums, im Mesenterium, im Omentum major, im Becken oder im linken Hodensack zu finden sein. Obwohl sie radiologisch nur selten auffällt, ist sie relativ häufig und kommt Autopsiestudien zufolge bei etwa 10 % der Bevölkerung vor. In 80 % der Fälle befindet sich die akzessorische Milz am oder in der Nähe des Milzhilus. In den übrigen Fällen befindet sie sich entweder im Pankreasschwanz oder in dessen Nähe. Akzessorische Milzen stellen in der Regel keine klinische Bedrohung dar, und die radiologischen Befunde der derzeit fortschrittlichen bildgebenden Verfahren sind hilfreiche Diagnoseinstrumente, um eine Operation zu vermeiden. Die einzige sichere Diagnosemethode ist die direkte Probenentnahme, es sei denn, es werden fälschlicherweise Inselzellen des Pankreas gefunden, wie in unserem Fall. In diesem Bericht analysieren wir den Fall einer chirurgisch behandelten intrapankreatischen akzessorischen Milz (IPAS), die radiologisch und zytologisch einen neuroendokrinen Pankreastumor vortäuschte.
FALLBERICHT
Ein 60-jähriger kaukasischer Mann wurde zur weiteren Untersuchung und Behandlung einer zufälligen solitären Masse im Pankreaskörper, die einen endokrinen Tumor vortäuschte, an unsere Klinik überwiesen. Bei einer Routineuntersuchung wies der Patient eine leichte Erhöhung des Kohlenhydratantigens (CA) 19-9 auf 40 U/mL auf (Referenzbereich: 0-37 U/mL). Die Kontrastmittel-Spiral-Computertomographie (CT) zeigte eine runde homogene Läsion von 1,2 cm Durchmesser im oberen Teil des Pankreaskörpers (Abbildung 1).
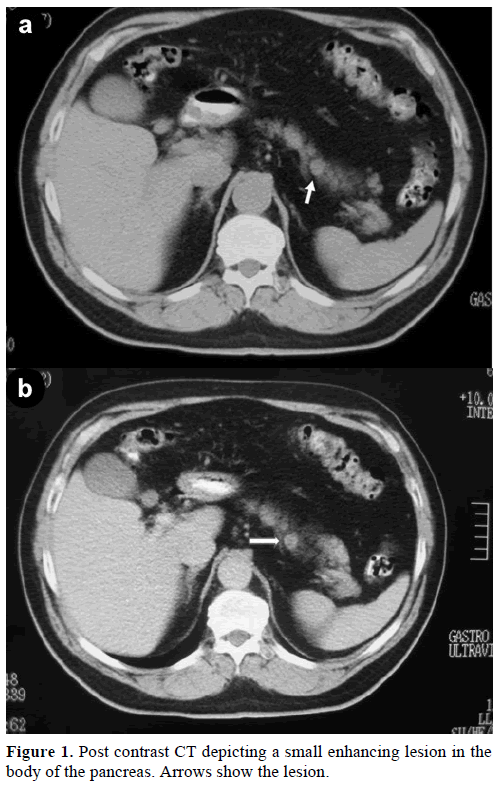
Abbildung 1. Postkontrast-CT, das eine kleine, sich vergrößernde Läsion im Pankreaskörper zeigt. Pfeile zeigen die Läsion.
Die Kontrast-Magnetresonanztomographie (MRT) zeigte eine runde, gut abgegrenzte Masse von 1 cm Durchmesser mit geringer Signalintensität auf T1-gewichteten Bildern, heterogener Läsionsanreicherung während der arteriellen Phase auf gadoliniumangereicherten T1-gewichteten Bildern und Hyperintensität auf fettgesättigten T2-gewichteten Bildern (Abbildung 2).
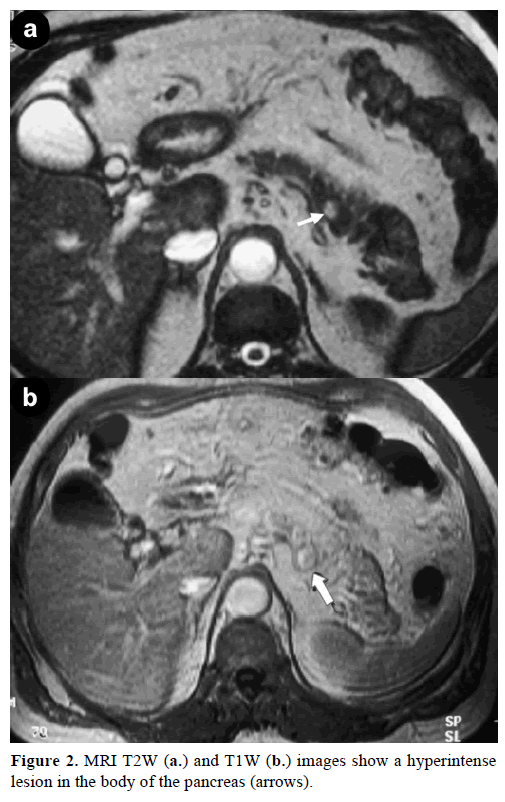
Abbildung 2. MRT-T2W- (a.) und T1W-Aufnahmen (b.) zeigen eine Hyperintensität im Pankreaskörper (Pfeile).
Die endoskopische Ultraschalluntersuchung (EUS) zeigte einen gut abgegrenzten, etwa 1,2 cm großen, relativ homogenen Knoten mit gut definierten und glatten Rändern, erhöhter Blutversorgung und gemischter Echogenität. Diese Merkmale waren mit einem neuroendokrinen Tumor vereinbar. Die Masse befand sich im Körper der Bauchspeicheldrüse, direkt peripher zum Truncus celiacus und zwischen dem Pankreasgang und der Magenwand. Es wurden keine regionalen Lymphknoten oder andere pathologische Befunde festgestellt.
Eine EUS-geführte Feinnadelaspirationsbiopsie (FNA) ergab Zellcluster unterschiedlicher Größe, immunopositiv für Chromogranin, Glucagon, Gastrin und Somatostatin und mit einem Ki-67-Proliferationsindex von weniger als 2 %; diese Befunde waren morphologisch und immunhistochemisch charakteristisch für ein neuroendokrines Neoplasma (Abbildung 3).
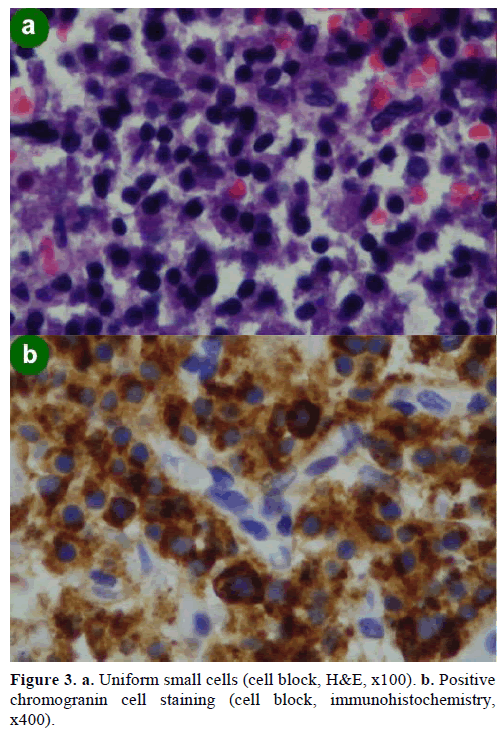
Abbildung 3. a. Uniforme kleine Zellen (Zellblock, H&E, x100). b. Positive Chromogranin-Zellfärbung (Zellblock, Immunhistochemie, x400).
Die Ganzkörperszintigraphie mit 111-Indium-Octreotid war negativ für Somatostatinrezeptoren.
Laboruntersuchungen ergaben keine auffälligen Befunde und auch keine Tumormarker wie Carcinoembryonales Antigen (CEA), Alpha-Fetoprotein (AFP) und CA 19-9 (15 U/mL). Die Serumspiegel von Glukagon, Gastrin und Somatostatin wurden mit 77,2 pg/ml (Referenzbereich: 30-210 pg/ml), 20 pg/ml (Referenzbereich: 0-110 pg/ml) bzw. 19,3 pg/ml (Referenzbereich: 5-27 pg/ml) angegeben. Um das Syndrom der multiplen endokrinen Neoplasie Typ 1 (MEN-1) auszuschließen, wurden die folgenden Hormonwerte im Serum gemessen: Parathormon (PTH) intakt (82,4 pg/mL; Referenzbereich: 15-65 pg/mL), Trijodthyronin (T3: 0,9 ng/mL; Referenzbereich: 0.7-1,5 ng/mL), Thyroxin (T4: 7,4 μg/dL; Referenzbereich: 4,5- 12 μg/dL), schilddrüsenstimulierendes Hormon (TSH: 1,8 μIU/mL; Referenzbereich: 0,4-4,5 μIU/mL), Index des freien Thyroxins, (FTI: 9,7μg/dL; Referenzbereich: 6,3- 12,4μg/dL). Die MRT der Hypophyse war unauffällig.
Auf der Grundlage der oben genannten Ergebnisse wurde ein nicht funktionsfähiger endokriner Tumor vermutet und eine distale Pankreatektomie mit Splenektomie durchgeführt. Das Operationspräparat enthielt einen runden, gut abgegrenzten, glatten, dunkelroten Knoten mit einem Durchmesser von 1 cm, der von Pankreasgewebe umgeben war. Nach einer sorgfältigen Sektion wurden keine weiteren Läsionen festgestellt. Mikroskopisch hatte der Knoten die Struktur einer Milz. Daher wurde die Masse als IPAS diagnostiziert (Abbildungen 4 und 5). Acht Lymphknoten, die am Milzhilum identifiziert wurden, waren gutartig.
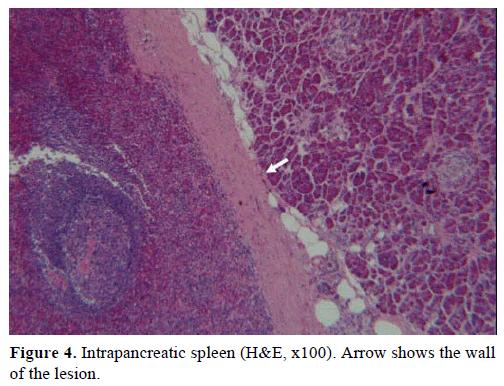
Abbildung 4. Intrapankreatische Milz (H&E, x100). Pfeil zeigt die Wand der Läsion.
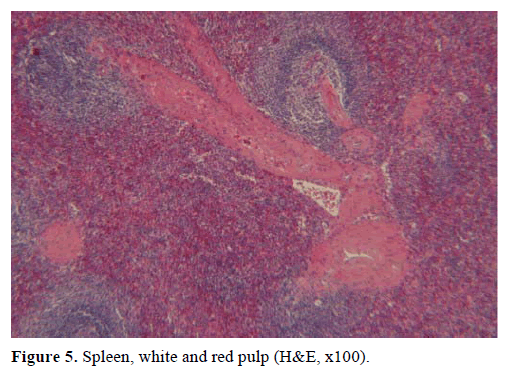
Abbildung 5. Milz, weißes und rotes Mark (H&E, x100).
DISKUSSION
Ektopes Milzgewebe kann in zwei Kategorien eingeteilt werden: Splenose durch Autotransplantation von Milzgewebe (gewöhnlich nach Splenektomie) und akzessorische Milzen, die angeborene Herde von gesundem Milzgewebe darstellen, die vom Hauptkörper der Milz getrennt sind. Embryologisch gesehen entsteht die Milz aus mesenchymalem Gewebe, das zwischen den Schichten des dorsalen Mesogastriums liegt. In der 6. bis 8. Lebenswoche befindet sich die Milz in unmittelbarer Nähe der kephaladsten Ausdehnung des Mesonephros. Nach der splenorenalen Fusion kann eine akzessorische Milz pararenal und retroperitoneal zu finden sein, oder sie kann in das Becken oder den Hodensack herabsinken. Bei der groben Untersuchung ist eine IPAS in der Regel von einer fibrotischen Kapsel umgeben, die sie vom angrenzenden Pankreasparenchym abgrenzt. Die Histologie ist ähnlich wie bei der orthotopen Milz. Läsionen oder Prozesse, die die Milz betreffen, wie Hämosiderose, Leukämie, Lymphome und Hypersplenismus, können akzessorisches Milzgewebe betreffen. Daher sollte bei der Differenzialdiagnose von knotigen Verdichtungen, die durch eine radiologische Untersuchung der Bauchspeicheldrüse nachgewiesen werden, sorgfältig nach akzessorischen Milzen gesucht werden.
Das Vorliegen eines IPAS sollte in Betracht gezogen werden, wenn eine Bauchspeicheldrüsenmasse auf den Präkontrast- und kontrastverstärkten Bildern aller bildgebenden Verfahren CT-Dichten und/oder MRT-Signalintensitäten aufweist, die denen der Milz ähneln. Insbesondere die inhomogene Anreicherung eines IPAS in seiner Frühphase kann ein diagnostischer Hinweis sein. Der angiographische Nachweis einer Milzdurchblutung könnte hilfreich sein, um einen Pankreas- oder Nebennierentumor auszuschließen.
Zu den Differentialdiagnosen für intra- und peripankreatische akzessorische Milzen gehören neuroendokrine Tumoren des Pankreas, lymphoepitheliale Zysten, Lymphome, hypervaskuläre Metastasen, solide pseudopapilläre Tumoren und Adenokarzinome des Pankreas. Derzeit gibt es keine klinischen oder radiologischen Kriterien für die Diagnose oder Unterscheidung eines IPAS von einem malignen Tumor.
Die radiologischen Befunde und die präoperative Diagnose der überwiesenen, chirurgisch resezierten und pathologisch bestätigten IPAS sind in Tabelle 1 zusammengefasst. Die meisten Fälle wurden zunächst als nicht funktionierende endokrine Tumoren oder Inselzelltumoren angesehen, und nur in einem von zwölf Fällen wurde präoperativ eindeutig ein IPAS diagnostiziert, nachdem eine wiederholte chirurgische Behandlung wegen idiopathischer thrombozytopenischer Purpura (ITP) erfolglos geblieben war. Die Größe reichte von 1,0 bis 2,5 cm, mit einem Mittelwert von 1,55 cm. Nicht funktionierende endokrine Tumoren machen 15-41 % der endokrinen Pankreastumoren aus, und die Rate ihrer malignen Transformation beträgt je nach Tumorart 62-92 %. Die vollständige Resektion des Tumors ist der beste Prädiktor für das Langzeitüberleben, unabhängig von Größe, Lokalisation, histologischer Differenzierung, Lymphknotenbefall und anderen Parametern.
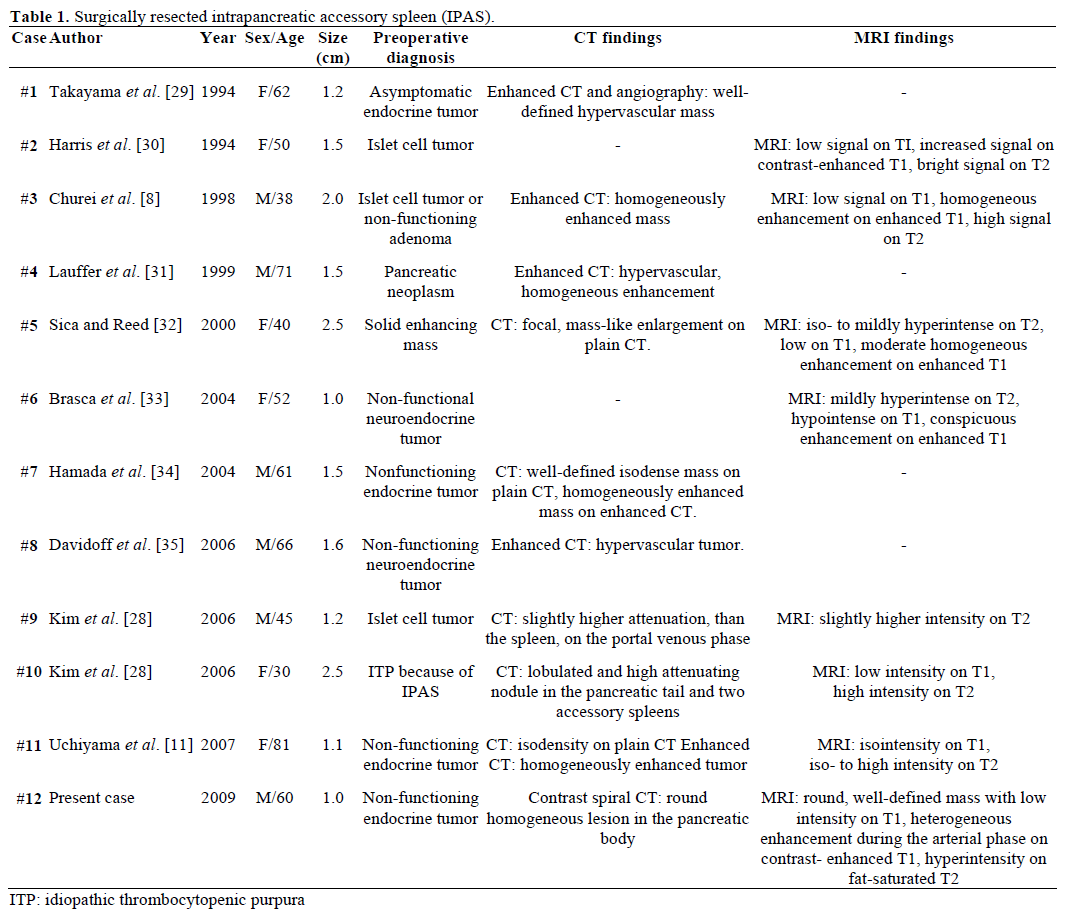
Da es keinen Grenzwert für die Größe gibt, um zwischen bösartigen und gutartigen nicht funktionierenden neuroendokrinen Tumoren der Bauchspeicheldrüse zu unterscheiden, wurde vorgeschlagen, dass alle derartigen Tumoren, die größer als 1 cm sind, entfernt werden sollten, wenn der Patient ein guter Kandidat für eine Operation ist.
Auf dem Graustufen-Basis-Ultraschall ist ein IPAS in der Regel als runde oder ovale Masse mit einer leicht echogenen und homogenen Textur zu erkennen, die von einer Grenzfläche mit hoher Amplitude umgeben ist und eine Anreicherung hinter der Läsion aufweist. Im Farb- oder Power-Doppler-Ultraschall wird eine charakteristische Blutversorgung (die das in die Masse eintretende Gefäßhilum darstellt) mit einer Sensitivität von 90 % für die Diagnose eines IPAS nachgewiesen. In der kontrastverstärkten Ultraschalluntersuchung (CEUS) mit Levovist® (Schering, Berlin, Deutschland) zeigt ein IPAS eine inhomogene Anreicherung in der frühen vaskulären Phase, eine milzähnliche Anreicherung in der postvaskulären Phase und eine anhaltende Anreicherung in der hepatosplenischen parenchymalen Phase.
Die EUS zeigt eine runde bis ovale Läsion mit scharfen, regelmäßigen Rändern und homogener Echotextur, die von hypo- bis hyper-echoisch reicht. Die EUS-geführte FNA-Zytologie zeigt eine Population von überwiegend kleinen Lymphozyten und ein gemischtes entzündliches Infiltrat, das die weiße Pulpa repräsentiert. Eine auffällige vaskuläre Komponente, bestehend aus dünnwandigen Blutgefäßen, die die Milzsinus darstellen, wird ebenfalls beobachtet. Diese Sinus sind auf Zellblockschnitten gut zu erkennen. Interessanterweise weisen die prallen Endothelzellen der Milzsinuszellen eine charakteristische Immunfärbung für CD8 auf, das eher als T-Zell-Marker bekannt ist. Die Färbung scheint spezifisch zu sein, da systemische Endothelzellen und Hämangiome negativ für CD8 sind. In Fällen, in denen die FNA der akzessorischen Milz nur Lymphozyten ohne andere Milzbestandteile ergibt, können Durchflusszytometrie und Immunhistochemie eingesetzt werden, um eine lymphoproliferative Störung, einschließlich des Hodgkin-Lymphoms, auszuschließen, selbst wenn die endgültige Diagnose einer akzessorischen Milz nicht bestätigt werden kann. Schreiner et al. berichteten über drei Fälle von IPAS, die durch eine EUS-geführte FNA-Biopsie diagnostiziert wurden. In unserem Fall, wahrscheinlich aufgrund der Entnahme von Inselzellclustern aus dem angrenzenden Pankreasparenchym, deutete dasselbe Verfahren auf einen neuroendokrinen Tumor hin, was zu einer chirurgischen Überbehandlung führte.
Ein ähnlicher falsch positiver EUS-FNA-Befund, bei dem ein Pankreasmilzknötchen fälschlicherweise für einen Inselzelltumor gehalten wurde, wurde auch von Ardengh et al. berichtet. Im Allgemeinen hat die EUS-FNA eine hohe Sensitivität (80-90 %) und Spezifität für neuroendokrine Tumoren der Bauchspeicheldrüse, obwohl ihre Genauigkeit für solche Tumoren als geringer angesehen wird als die für Adenokarzinome der Bauchspeicheldrüse. Um diagnostische Fehler zu minimieren, sollte die EUS-FNA bei kleinen neuroendokrinen Tumoren von einem erfahrenen Endoskopiker durchgeführt werden, und die zytopathologische Beurteilung sollte mit Immunhistochemie kombiniert werden.
99mTechnetium hitzegeschädigte rote Blutkörperchen (99mTc-HDRBC) Szintigraphie, kombiniert mit Einzelphotonen-Emissions-Computertomographie (SPECT), ist eine hochempfindliche und spezifische Methode zum Nachweis von Milzgewebe, da bis zu 90 % der injizierten HDRBC von diesem Gewebe abgefangen werden. Obwohl die Szintigraphie eine selektive Darstellung der Milz mit einem ausgezeichneten Milz-Leber-Verhältnis ermöglicht, ist die Darstellung der Milz immer noch schwierig, wenn nur wenig funktionierendes Milzgewebe vorhanden ist, wie z. B. bei akzessorischen Milzen. Darüber hinaus bietet die Szintigraphie, selbst mit SPECT, eine geringere räumliche Auflösung als andere bildgebende Verfahren mit Querschnittscharakter wie CT oder MRT. Daher wird die Szintigrafie häufig in Verbindung mit anderen Schnittbildverfahren eingesetzt. Darüber hinaus wird die mit superparamagnetischem Eisenoxid (SPIO) verstärkte MRT als hervorragende Alternative zur 99mTc-HDRBC-Szintigraphie genannt, wenn ein IPAS einen ähnlichen Signalabfall wie die Milz aufweist. Ein weiterer Unterschied zwischen IPAS und hypervaskulären Pankreasneoplasmen ist die heterogene Anreicherung in der arteriellen CT-Phase.
Akzessorische Milzen müssen unter Umständen chirurgisch behandelt werden, wenn sie Lymphadenopathien oder Tumore imitieren oder wenn sie aufgrund von Torsion, spontaner Ruptur, Blutung oder Zystenbildung symptomatisch werden. Das gesamte funktionelle Milzgewebe sollte auch zur Behandlung von hämatologischen Erkrankungen wie ITP entfernt werden.
Zusammenfassend lässt sich sagen, dass moderne bildgebende Verfahren in Zukunft wahrscheinlich dazu führen werden, dass immer mehr akzessorische Milzen in der Bauchspeicheldrüse entdeckt werden, was eine große diagnostische und therapeutische Herausforderung darstellt. In solchen Fällen sollten alle nicht-invasiven diagnostischen Mittel eingesetzt werden, um unnötige chirurgische Eingriffe zu vermeiden und die Gesamtmorbidität der Patienten zu verringern.
Interessenkonflikt
Die Autoren haben keine potentiellen Interessenkonflikte
- Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Akzessorische Milzen im oder am Schwanz des Pankreas: A survey of 2,700 additional necropsies. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapankreatische akzessorische Milz: Befunde auf MR-Bildgebung, CT, US und Szintigraphie und die pathologische Analyse. Korean J Radiol 2008; 9:162-74.
- Moore K. The developing human. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Ein Beitrag zur Embryologie, Topographie und Pathologie des ektopen Milzgewebes. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid splenic cyst occurring in an intrapancreatic accessory spleen. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Akzessorische Milz im Kopf der Bauchspeicheldrüse. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreatic accessory spleen: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapankreatische akzessorische Milz, die auf dem CT eine Pankreasmasse vortäuscht. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikale Pankreatoduodenektomie bei fehldiagnostizierter Pankreasmasse. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapankreatische akzessorische Milz, die einen endokrinen Tumor der Bauchspeicheldrüse vortäuscht: Fallbericht und Überprüfung der Literatur. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomas und nicht funktionsfähige endokrine Pankreastumoren: Klinische Präsentation, Diagnose und Fortschritte bei der Behandlung. In: Mignon M, Jensen RT, eds. Endokrine Tumore der Bauchspeicheldrüse: Recent Advances in Research and Management. Grenzbereiche der gastrointestinalen Forschung. Basel, Schweiz: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Bösartige nicht funktionierende endokrine Tumoren des Pankreas: Prädiktive Faktoren für das Überleben nach chirurgischer Behandlung. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonography of the accessory spleen. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Kontrastverstärkte Sonographie der intrapankreatischen akzessorischen Milz bei sechs Patienten. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: a potential cause of misdiagnosis at EUS. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnose eines Falles durch Feinnadelaspirationszytologie. Acta Cytol 1988; 32:91-3.
- Kraus MD. Histologie und Histopathologie der Milz: ein Update. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. A case report. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosis of deep-seated lymphoma and leukemia by endoscopic ultrasound-guided fine-needle aspiration biopsy. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapankreatische akzessorische Milz: Mimik eines endokrinen Tumors der Bauchspeicheldrüse, diagnostiziert durch endoskopische ultraschallgesteuerte Feinnadelaspirationsbiopsie. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-geführte FNA in der Diagnose von neuroendokrinen Tumoren des Pankreas vor der Operation. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT- und superparamagnetisches Eisenoxid (SPIO)-verstärkte MR-Befunde der intrapankreatischen akzessorischen Milz bei sieben Patienten. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreatic accessory spleen. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Akzessorische Milz, die eine Masse im Schwanz des Pankreas verursacht: MR imaging findings. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapankreatische akzessorische Milz – eine seltene Ursache einer Pankreasmasse. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapankreatische akzessorische Milz, die einen neuroendokrinen Tumor imitiert: Magnetresonanzbefunde und mögliche diagnostische Rolle verschiedener nuklearmedizinischer Tests. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoskopische milzschonende Pankreasschwanzresektion bei einer intrapankreatischen akzessorischen Milz, die einen nicht funktionierenden endokrinen Tumor vortäuscht: Bericht über einen Fall. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Clinical challenges and images in GI. Intrapankreatische akzessorische Milz, die einen nicht funktionierenden neuroendokrinen Tumor imitiert. Gastroenterology 2006; 131:350, 689.