Mots-clés
Endosonographie ; tumeurs neuroendocrines ; pancréatectomie
Abréviations
HDRBC : globule rouge endommagé par la chaleur ; IPAS : rate accessoire intrapancréatique ; PTI : purpura thrombocytopénique idiopathique ; SPECT : tomographie par émission monophotonique ; SPIO : oxyde de fer superparamagnétique
INTRODUCTION
Le tissu splénique accessoire ectopique peut se trouver n’importe où le long des vaisseaux spléniques, dans la paroi du jéjunum, dans le mésentère, dans le grand épiploon, dans le bassin ou le scrotum gauche. Bien qu’elle soit rarement remarquée radiologiquement, elle est relativement fréquente, se produisant chez environ 10 % de la population selon les études d’autopsie. Les rates accessoires sont situées au niveau ou à proximité du hile splénique dans 80 % des cas. Dans le reste des cas, elle se trouve soit dans la queue pancréatique, soit à proximité de celle-ci. Les rates accessoires ne présentent généralement aucune menace clinique et les résultats radiologiques des techniques d’imagerie actuellement avancées sont des outils de diagnostic utiles pour éviter la chirurgie. La seule méthode diagnostique sûre est le prélèvement direct, à moins qu’il ne produise faussement des cellules d’îlots pancréatiques, comme dans notre cas. Dans ce rapport, nous analysons le cas d’une rate accessoire intrapancréatique (IPAS) traitée chirurgicalement qui, radiologiquement et cytologiquement, imitait une tumeur pancréatique neuroendocrine.
RAPPORT DE CAS
Un homme caucasien de 60 ans a été référé à notre clinique pour une évaluation plus approfondie et le traitement d’une masse solitaire incidente, dans le corps du pancréas, imitant une tumeur endocrine. Lors d’un examen de routine, le patient a présenté une légère élévation de l’antigène glucidique (CA) 19-9 à 40 U/mL (plage de référence : 0-37 U/mL). La tomodensitométrie (TDM) spiralée avec contraste a montré une lésion ronde et homogène de 1,2 cm de diamètre, située dans la partie supérieure du corps pancréatique (Figure 1).
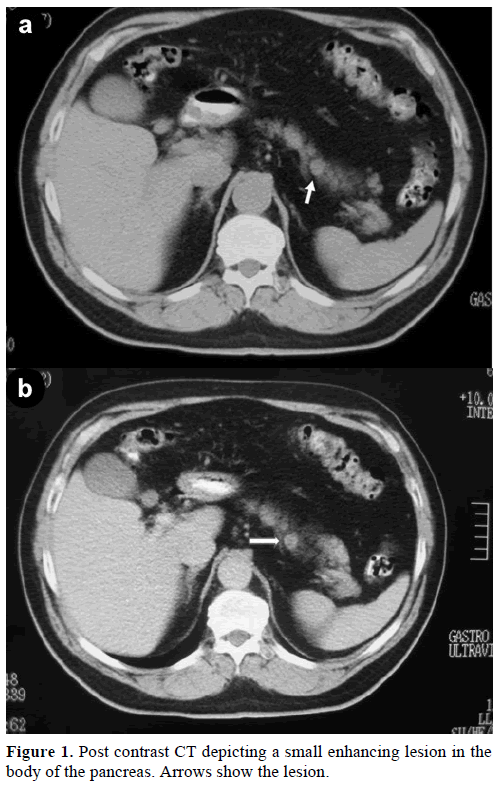
Figure 1. TDM après contraste montrant une petite lésion de rehaussement dans le corps du pancréas. Les flèches montrent la lésion.
L’imagerie par résonance magnétique (IRM) de contraste a révélé une masse ronde, bien définie, de 1 cm de diamètre, avec une faible intensité de signal sur les images pondérées en T1, un rehaussement hétérogène de la lésion pendant la phase artérielle sur les images pondérées en T1 renforcées au gadolinium et une hyperintensité sur les images pondérées en T2 saturées en graisse (figure 2).
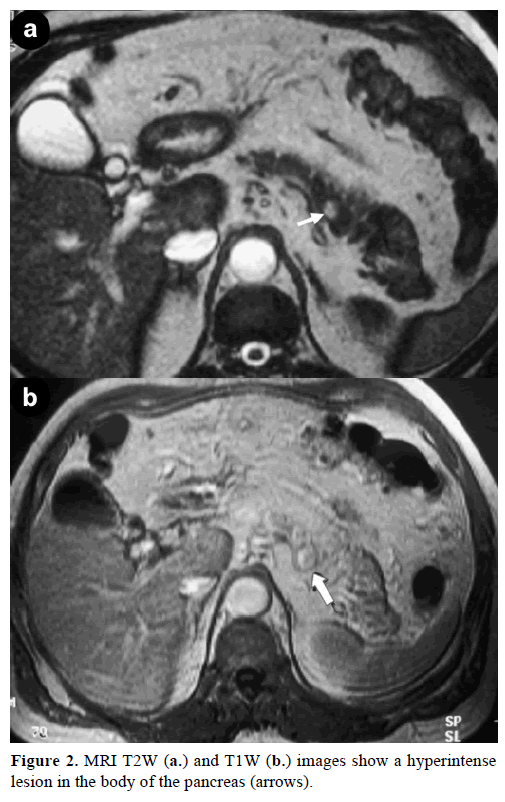
Figure 2. Les images IRM T2W (a.) et T1W (b.) montrent une hyperintensité dans le corps du pancréas (flèches).
L’échographie endoscopique (EUS) a montré un nodule bien délimité, d’environ 1,2 cm de taille, relativement homogène avec des marges bien définies et lisses, un apport sanguin accru et une échogénicité mixte. Ces caractéristiques étaient compatibles avec une tumeur neuroendocrine. La masse était située dans le corps du pancréas, directement à la périphérie du tronc cœliaque et entre le canal pancréatique et la paroi gastrique. Aucun ganglion lymphatique régional ou autre résultat pathologique n’a été noté.
Une biopsie par aspiration à l’aiguille fine (FNA) guidée par l’EUS a donné lieu à des amas cellulaires de taille variable, immunopositifs pour la chromogranine, le glucagon, la gastrine et la somatostatine et avec un indice de prolifération Ki-67 inférieur à 2 % ; ces résultats étaient morphologiquement et immunohistochimiquement caractéristiques d’un néoplasme neuroendocrine (figure 3).
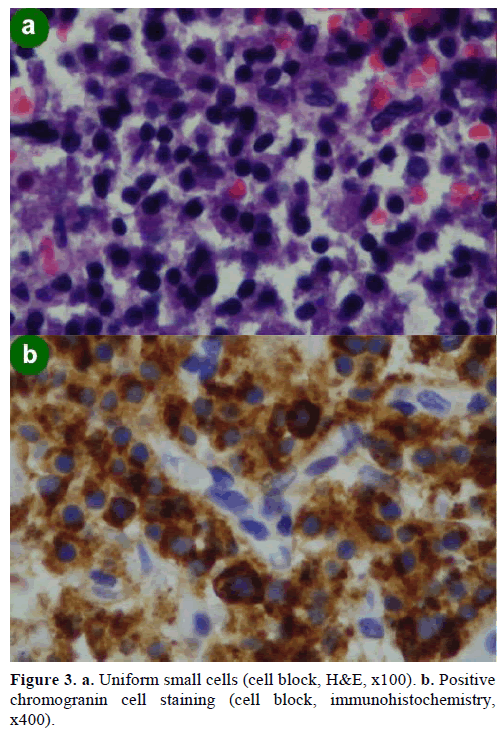
Figure 3. a. Petites cellules uniformes (bloc cellulaire, H&E, x100). b. Coloration positive des cellules à chromogranine (bloc cellulaire, immunohistochimie,x400).
La scintigraphie à l’111indium-octréotide du corps entier était négative pour les récepteurs de la somatostatine.
Les examens de laboratoire n’ont révélé aucune anomalie ni aucun marqueur tumoral tel que l’antigène carcinoembryonnaire (ACE), l’alpha-fœtoprotéine (AFP) et le CA 19-9 (15 U/mL). Les taux sériques de glucagon, de gastrine et de somatostatine étaient respectivement de 77,2 pg/mL (plage de référence : 30-210 pg/mL), 20 pg/mL (plage de référence : 0-110 pg/mL) et 19,3 pg/mL (plage de référence : 5-27 pg/mL). Pour exclure le syndrome de néoplasie endocrinienne multiple de type 1 (MEN-1), les taux d’hormones sériques suivants ont été mesurés : parathormone (PTH) intacte (82,4 pg/mL ; plage de référence : 15-65 pg/mL), triiodothyronine (T3 : 0,9 ng/mL ; plage de référence : 0.7-1,5 ng/mL), thyroxine (T4 : 7,4 μg/dL ; plage de référence : 4,5- 12 μg/dL), thyréostimuline (TSH : 1,8 μIU/mL ; plage de référence : 0,4-4,5 μIU/mL), indice de thyroxine libre, (ITF : 9,7μg/dL ; plage de référence : 6,3- 12,4μg/dL). L’IRM hypophysaire était sans particularité.
Sur la base des résultats ci-dessus, une tumeur endocrine non fonctionnelle a été suspectée et une pancréatectomie distale avec splénectomie a été réalisée. La pièce opératoire contenait un nodule rond, bien délimité, lisse, rouge foncé, de 1 cm de diamètre, entouré de tissu pancréatique. Aucune autre lésion n’a été identifiée grossièrement, après une section méticuleuse. Au microscope, le nodule avait la structure d’une rate. Ainsi, la masse a été diagnostiquée comme un IPAS (Figures 4 et 5). Huit ganglions lymphatiques, identifiés au niveau du hile splénique, étaient bénins.
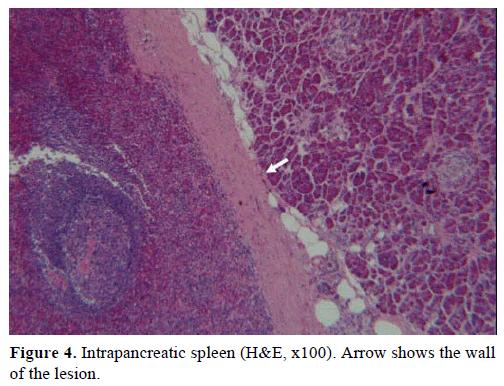
Figure 4. Rate intrapancréatique (H&E, x100). La flèche indique le wallof de la lésion.
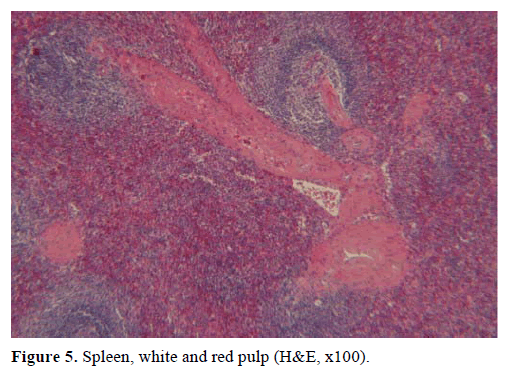
Figure 5. Rate, pulpe blanche et rouge (H&E, x100).
DISCUSSION
Le tissu splénique ectopique peut être classé en deux catégories : les splénoses dues à l’autotransplantation de tissu splénique (généralement après splénectomie) et les rates accessoires qui constituent des foyers congénitaux de tissu splénique sain séparés du corps principal de la rate . Du point de vue embryologique, la rate est dérivée du tissu mésenchymateux qui se trouve entre les couches du mésogastre dorsal. De la 6e à la 8e semaine de vie, la rate se trouve à proximité de l’extension la plus céphalique du mésonéphros. Après la fusion splénorénale, on peut trouver une rate accessoire pararénale et rétropéritonéale ou bien elle peut descendre dans le bassin ou le scrotum . À l’examen macroscopique, un SAPI est généralement entouré d’une capsule fibreuse qui le sépare du parenchyme pancréatique adjacent. Son histologie est similaire à celle de la rate orthotopique. Les lésions ou processus concernant la rate, tels que l’hémosidérose, la leucémie, le lymphome et l’hypersplénisme peuvent affecter le tissu splénique accessoire. Ainsi, une recherche minutieuse de rate accessoire doit être envisagée dans le diagnostic différentiel des densités nodulaires démontrées par l’étude radiologique du pancréas .
L’existence d’un SIPA doit être envisagée lorsqu’une masse pancréatique présente des densités CT et/ou des intensités de signal IRM similaires à celles de la rate, sur les images précontrastées et renforcées en contraste de toutes les modalités d’imagerie. En particulier, le rehaussement inhomogène d’un SAPI dans ses premières phases peut être un indice diagnostique. La démonstration angiographique d’un apport sanguin splénique pourrait être utile pour exclure une tumeur pancréatique ou surrénalienne.
Le diagnostic différentiel pour les rates accessoires intra- et péri-pancréatiques pourrait inclure les tumeurs neuroendocrines pancréatiques, les kystes lymphoépithéliaux, les lymphomes, les métastases hypervasculaires, les tumeurs solides pseudo-papillaires et les adénocarcinomes pancréatiques. Actuellement, il n’y a pas de critères cliniques ou radiographiques pour le diagnostic ou la différenciation d’un SAPI d’une tumeur maligne.
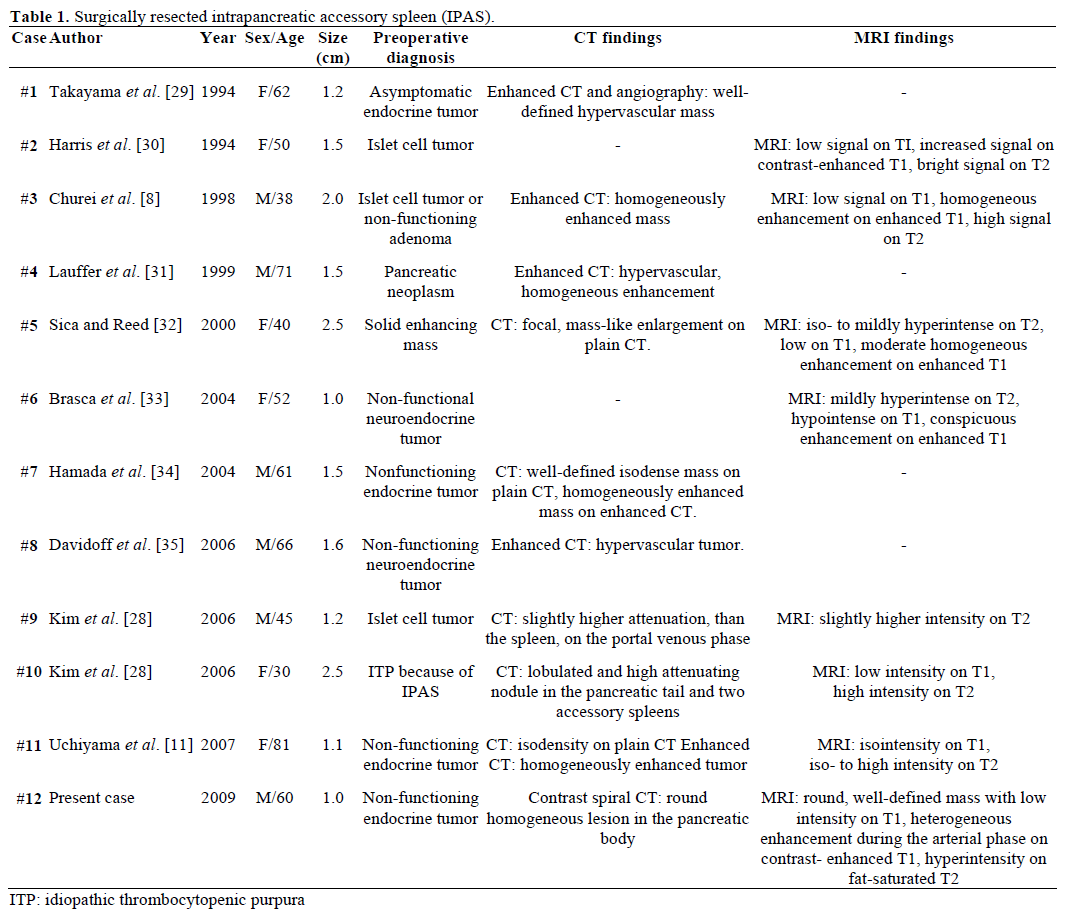
Les résultats radiologiques et le diagnostic préopératoire des SAPI référés, réséqués chirurgicalement et confirmés pathologiquement sont résumés dans le tableau 1. La plupart des cas ont été initialement considérés comme des tumeurs endocrines non fonctionnelles ou des tumeurs des cellules des îlots de Langerhans et seulement un cas sur douze a été diagnostiqué de manière concluante avant l’opération comme un SAPI après un traitement chirurgical répétitif infructueux pour un purpura thrombocytopénique idiopathique (PTI). La taille variait de 1,0 à 2,5 cm, avec une valeur moyenne de 1,55 cm . Les tumeurs endocrines non fonctionnelles représentent 15 à 41 % des tumeurs endocrines du pancréas et le taux de leur transformation maligne est de 62 à 92 %, selon le type de tumeur . La résection totale de la tumeur est le prédicteur ultime de la survie à long terme, indépendamment de la taille, de la localisation, de la différenciation histologique, de l’implication des ganglions lymphatiques et d’autres paramètres .
Puisqu’aucune taille seuil n’a été établie pour différencier les tumeurs neuroendocrines non fonctionnelles malignes et bénignes du pancréas, il a été suggéré que toutes ces tumeurs de plus de 1 cm devraient être excisées si le patient est un bon candidat pour la chirurgie .
Sur une échographie de base en échelle de gris, un IPAS est généralement vu comme une masse ronde ou ovale avec une texture légèrement échogène et homogène, entourée d’une interface de haute amplitude et montrant un rehaussement derrière la lésion. A l’échographie Doppler couleur ou puissance, un apport sanguin caractéristique (représentant le hile vasculaire entrant dans la masse), a été rapporté comme offrant une sensibilité de 90% dans le diagnostic d’un IPAS . En échographie avec produit de contraste (CEUS) utilisant Levovist® (Schering, Berlin, Allemagne), un SAPI présente un rehaussement inhomogène dans la phase vasculaire précoce, un rehaussement similaire à celui de la rate pendant la phase postvasculaire et un rehaussement prolongé dans la phase parenchymateuse hépatosplénique.
Les résultats de l’EUS comprennent une lésion ronde à ovale avec des marges régulières et nettes et une texture d’écho homogène, allant d’hypo- à hyper-échoïque. La cytologie FNA guidée par l’EUS révèle une population de petits lymphocytes prédominants et un infiltrat inflammatoire mixte représentant la pulpe blanche. On observe également une composante vasculaire bien visible composée de vaisseaux sanguins à paroi mince représentant les sinus spléniques . Ces sinus sont bien visualisés sur les coupes cellulaires. Il est intéressant de noter que les cellules endothéliales dodues des sinus spléniques présentent une immunocoloration caractéristique pour le CD8, qui est plus communément reconnu comme un marqueur des cellules T. La coloration semble spécifique, car les cellules endothéliales des sinus spléniques ne sont pas visibles. La coloration semble être spécifique, car les cellules endothéliales systémiques et les hémangiomes sont négatifs pour CD8 . Dans les cas où la FNA de la rate accessoire ne donne que des lymphocytes, sans autres éléments spléniques, la cytométrie de flux et l’immunohistochimie peuvent être utilisées pour exclure un trouble lymphoprolifératif, y compris le lymphome de Hodgkin, même si un diagnostic définitif de rate accessoire ne peut être confirmé. Schreiner et al. ont rapporté trois cas d’IPAS diagnostiqués par une biopsie FNA guidée par EUS. Dans notre cas, probablement en raison du prélèvement d’amas de cellules d’îlots de Langerhans dans le parenchyme pancréatique adjacent, la même procédure a indiqué une tumeur neuroendocrine, conduisant à un surtraitement chirurgical.
Un faux positif similaire EUS-FNA, dans lequel un nodule splénique pancréatique a été confondu avec une tumeur des cellules d’îlots de Langerhans a également été rapporté par Ardengh et al . En général, l’EUS-FNA a une sensibilité et une spécificité élevées (80-90%) pour les tumeurs neuroendocrines du pancréas, bien que sa précision pour de telles tumeurs soit considérée comme inférieure à celle de l’adénocarcinome du pancréas. Afin de minimiser les erreurs de diagnostic, l’EUS-FNA des petites tumeurs neuroendocrines doit être réalisé par un endoscopiste expérimenté et l’évaluation cytopathologique doit être combinée avec l’immunohistochimie .
La scintigraphie aux globules rouges thermodégradés au 99mTechnetium (99mTc- HDRBC), associée à la tomographie par émission monophotonique (SPECT), est une méthode très sensible et spécifique de détection du tissu splénique, puisque jusqu’à 90 % des HDRBC injectés sont piégés par ce tissu . Bien que la scintigraphie permette une visualisation sélective de la rate avec un excellent rapport rate/foie, la visualisation de la rate reste difficile dans les cas où le tissu splénique est peu fonctionnel, comme dans les cas de rate accessoire. De plus, la scintigraphie, même avec la TEMP, offre une résolution spatiale inférieure à celle d’autres modalités d’imagerie en coupe telles que le CT ou l’IRM. C’est pourquoi la scintigraphie est souvent utilisée en conjonction avec d’autres techniques d’imagerie transversale. De plus, l’IRM renforcée par l’oxyde de fer superparamagnétique (SPIO) est considérée comme une excellente alternative à la scintigraphie au 99mTc-HDRBC, lorsqu’un IPAS présente une chute de signal similaire à celle de la rate. En plus de la chute de signal référencée, une autre différence entre les IPAS et les néoplasmes pancréatiques hypervasculaires est le rehaussement hétérogène sur le scanner en phase artérielle .
Les rates accessoires peuvent nécessiter un traitement chirurgical lorsqu’elles imitent des adénopathies ou des tumeurs, ou lorsqu’elles deviennent symptomatiques en raison d’une torsion, d’une rupture spontanée, d’une hémorragie ou de la formation d’un kyste. Tous les tissus spléniques fonctionnels doivent également être retirés pour le traitement des troubles hématologiques tels que le PTI.
En conclusion, les techniques d’imagerie modernes conduiront probablement à la découverte d’un nombre croissant de rates accessoires intrapancréatiques à l’avenir, posant des défis diagnostiques et thérapeutiques importants. Dans de tels cas, tous les moyens de diagnostic non invasifs devraient être utilisés afin d’éviter des procédures chirurgicales inutiles et de diminuer la morbidité globale du patient .
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt potentiel
- Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959 ; 32:165-8.
- Halpert B, Alden ZA. Les rates accessoires dans ou à la queue du pancréas : Une enquête sur 2 700 nécropsies supplémentaires. Arch Pathol 1964 ; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Rate accessoire intrapancréatique : résultats de l’imagerie par résonance magnétique, de la tomographie, de l’échographie et de la scintigraphie, et analyse pathologique. Korean J Radiol 2008 ; 9:162-74.
- Moore K. The developing human. Philadelphie : Saunders, 1986 : 225-8.
- Weiand G, Mangold G. La rate accessoire dans la queue pancréatique — une entité négligée ? Une contribution à l’embryologie, la topographie et la pathologie du tissu splénique ectopique. Chirurg 2003 ; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Kyste épidermoïde splénique survenant dans une rate accessoire intrapancréatique. Dig Dis Sci 1980 ; 25:964-7.
- Landry ML, Sarma DP. Rate accessoire dans la tête du pancréas. Hum Pathol 1989 ; 20:497.
- Churei H, Inoue H, Nakajo M. Rate accessoire intra-pancréatique : rapport de cas. Abdom Imaging 1998 ; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Rate accessoire intrapancréatique mimant une masse pancréatique sur la tomographie. J Comput Assist Tomogr 1992 ; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Pancréatoduodénectomie radicale pour une masse pancréatique mal diagnostiquée. Br J Surg 1994 ; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Rate accessoire intrapancréatique mimant une tumeur endocrine du pancréas : rapport de cas et revue de la littérature. J Gastrointest Surg 2008 ; 12:1471-3.
- Eriksson B, Oberg K. PPomas et tumeurs pancréatiques endocrines non fonctionnelles : Présentation clinique, diagnostic et progrès dans la prise en charge. In : Mignon M, Jensen RT, eds. Endocrine Tumors of the Pancreas : Recent Advances in Research and Management. Frontières de la recherche gastro-intestinale. Basel, Suisse : Karger, 1995 : 208-222.
- Oberg K, Eriksson B. Tumeurs endocrines du pancréas. Best Pract Res Clin Gastroenterol 2005 ; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Tumeurs endocrines malignes non fonctionnelles du pancréas : facteurs prédictifs de survie après traitement chirurgical. World J Surg 2007 ; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Chirurgie des tumeurs pancréatiques neuroendocrines non fonctionnelles résécables. World J Surg 2004 ; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Sonographie de la rate accessoire. AJR Am J Roentgenol 1984 ; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Sonographie à contraste amélioré de la rate accessoire intrapancréatique chez six patients. AJR Am J Roentgenol 2007 ; 188:422-8.
- Barawi M, Bekal P, Gress F. La rate accessoire : une cause potentielle d’erreur de diagnostic à l’EUS. Gastrointest Endosc 2000 ; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology : a case report. Diagn Cytopathol 2001 ; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Diagnostic d’un cas par cytologie par aspiration à l’aiguille fine. Acta Cytol 1988 ; 32:91-3.
- Kraus MD. Histologie et histopathologie spléniques : une mise à jour. Semin Diagn Pathol 2003 ; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Aspiration à l’aiguille fine d’une splénose thoracique. Un rapport de cas. Acta Cytol 1999 ; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnostic de lymphome et de leucémie profonds par biopsie par aspiration à l’aiguille fine guidée par échographie endoscopique. Am J Clin Pathol 2006 ; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Rate accessoire intrapancréatique : mimique de tumeur endocrine pancréatique diagnostiquée par biopsie par aspiration à l’aiguille fine guidée par échographie endoscopique. Diagn Cytopathol 2008 ; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. FNA guidée par EUS dans le diagnostic des tumeurs neuroendocrines pancréatiques avant la chirurgie. Gastrointest Endosc 2004 ; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000 ; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Rate accessoire intrapancréatique diagnostiquée par SPECT de globules rouges endommagés par la chaleur au technetium-99m. J Nucl Med 1997 ; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT and superparamagnetic iron oxide (SPIO)-enhanced MR findings of intrapancreatic accessory spleen in seven patients. Eur Radiol 2006 ; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Rate accessoire intra-pancréatique. Lancet. 1994 ; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Rate accessoire causant une masse dans la queue du pancréas : MR imaging findings. AJR Am J Roentgenol 1994 ; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Rate accessoire intrapancréatique.Une cause rare de masse pancréatique. Int J Pancreatol 1999 ; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiology 2000 ; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatic accessory spleen mimicking a neuroendocrine tumor : magnetic resonance findings and possible diagnostic role of different nuclear medicine tests. Eur Radiol. 2004 ; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor : report of a case. Surg Today 2004 ; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Défis cliniques et images en GI. Rate accessoire intrapancréatique mimant une tumeur neuroendocrine non fonctionnelle. Gastroenterology 2006 ; 131:350, 689.