Keywords
Endosonografia; Neuroendokriiniset kasvaimet; Pankreatektomia
Abbreviations
HDRBC: lämpövaurioitunut punasolu; IPAS: intrapancreatic accessory spleen (pernan sisäinen lisäperna); ITP: idiopaattinen trombosytopeeninen purppura; SPECT: SPIO: superparamagneettinen rautaoksidi
TOIMINTA
Ektooppinen ylimääräinen pernakudos voi sijaita missä tahansa pernasuonten varrella, jejunumin seinämässä, suoliliepeessä, suuressa omentumissa, lantiossa tai vasemmassa kivespussissa. Vaikka sitä havaitaan radiologisesti harvoin, se on suhteellisen yleinen, ja sitä esiintyy ruumiinavaustutkimusten mukaan noin 10 prosentilla väestöstä. Lisäsylki sijaitsee 80 prosentissa tapauksista pernan hilumissa tai sen läheisyydessä. Lopuissa tapauksissa se sijaitsee joko haiman hännässä tai sen läheisyydessä. Lisääntyvä perna ei yleensä aiheuta kliinistä uhkaa, ja nykyisin kehittyneiden kuvantamistekniikoiden radiologiset löydökset ovat hyödyllisiä diagnostisia välineitä leikkauksen välttämiseksi . Ainoa turvallinen diagnostinen menetelmä on suora näytteenotto, paitsi jos se tuottaa virheellisesti haiman saarekesoluja, kuten meidän tapauksessamme. Tässä raportissa analysoimme tapauksen, jossa kirurgisesti hoidettu haiman sisäinen lisäkasvain (intrapancreatic accessory spleen, IPAS) jäljitteli radiologisesti ja sytologisesti neuroendokriinistä haimakasvainta.
TAPAUSKERTOMUS
Klinikallemme ohjattiin 60-vuotias kaukaasialainen mies lisäarviointia ja -hoitoa varten, koska hänellä oli haimassa satunnaisesti havaittu yksinäinen kasvain, joka jäljitteli endokriinistä kasvainta. Rutiinitarkastuksessa potilaalla todettiin hiilihydraattiantigeenin (CA) 19-9:n lievä nousu 40 U/ml:iin (viitealue: 0-37 U/ml). Kontrastispiraalinen tietokonetomografia (CT) osoitti pyöreän, halkaisijaltaan 1,2 cm:n suuruisen homogeenisen leesion, joka sijaitsi haimarungon yläosassa (kuva 1).
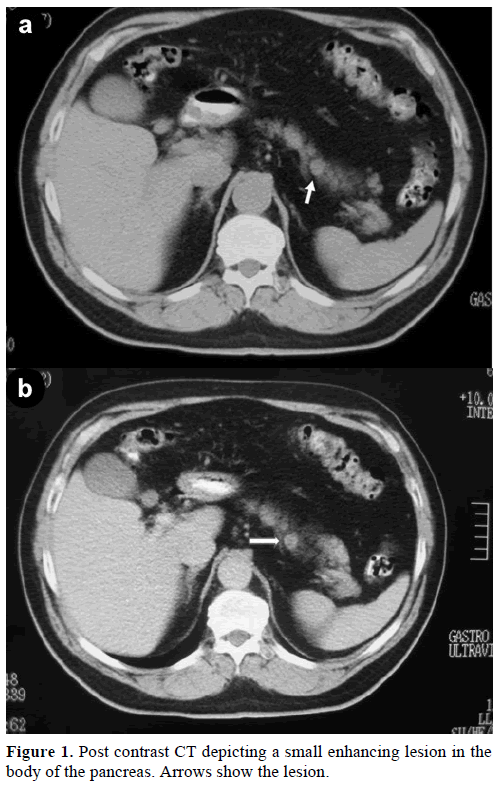
Kuva 1. Haimahalvaus. Kontrastikuvion jälkeinen TT, jossa näkyy pieni tehostuva leesio haiman rungossa. Nuolet kuvaavat leesiota.
Kontrastimagneettikuvaus (MRI) paljasti pyöreän, hyvin määritellyn, halkaisijaltaan 1 cm:n suuruisen massan, jolla oli matala signaalin voimakkuus T1-painotteisissa kuvissa, heterogeeninen leesion voimistuminen valtimovaiheen aikana gadoliniumilla tehostetuissa T1-painotteisissa kuvissa ja hyperintensiivisyys rasvakyllästetyissä T2-painotetuissa kuvissa (kuva 2).
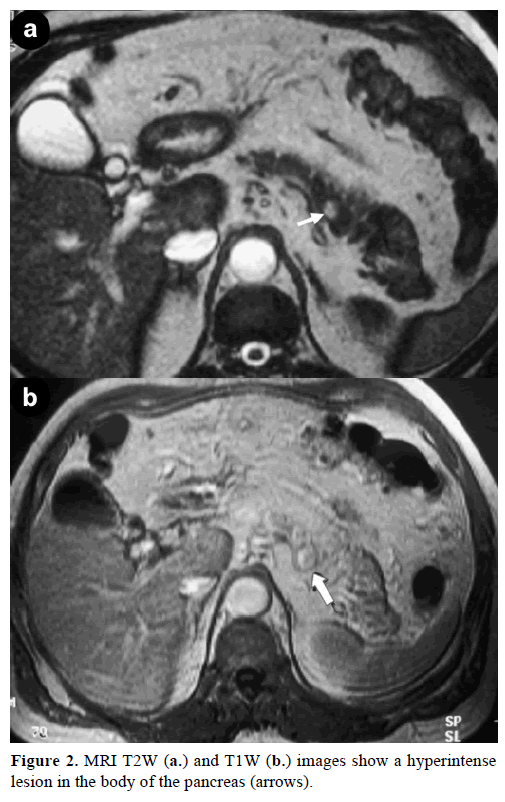
Kuva 2. MRI:n T2W- (a.) ja T1W- (b.) kuvissa näkyy haiman rungossa hyperintenseesio (nuolet).
Endoskooppinen ultraäänitutkimus (EUS) osoitti noin 1,2 cm:n kokoisen, hyvin rajattua kyhmyn, joka oli suhteellisen homogeeninen ja jolla oli tarkoin määritellyt ja sileät reunat, lisääntynyt verenkierto ja sekoittunut echogeenisyys. Nämä ominaisuudet sopivat yhteen neuroendokriinisen kasvaimen kanssa. Massa sijaitsi haiman rungossa, suoraan perifeerisesti keliakian runkoon nähden ja haimakanavan ja mahalaukun seinämän välissä. Alueellisia imusolmukkeita tai muita patologisia löydöksiä ei todettu.
EUS-ohjatun ohutneula-aspiraatiobiopsian (FNA) tuloksena saatiin erikokoisia soluklustereita, jotka olivat immunopositiivisia kromograniinille, glukagonille, gastriinille ja somatostatiinille ja joiden Ki-67-proliferaatioindeksi oli alle 2 %; nämä löydökset olivat morfologisesti ja immunohistokemiallisesti tyypillisiä neuroendokriiniselle neoplasmalle (kuva 3).
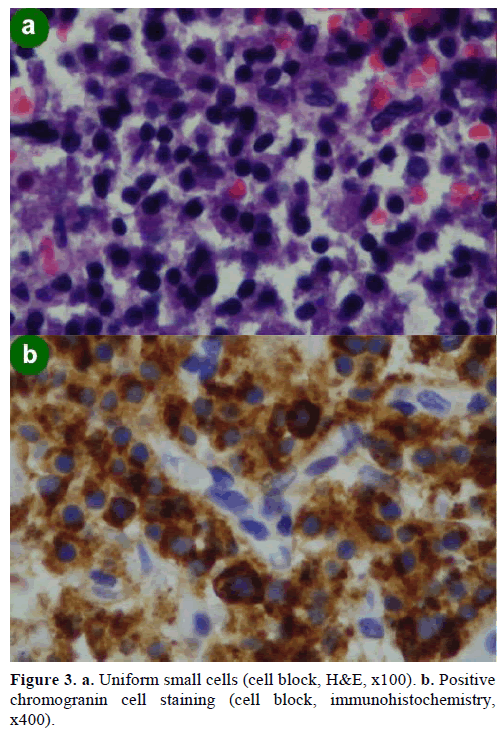
Kuva 3. a. Yhtenäiset pienet solut (solulohko, H&E, x100). b. Positiivinen kromograniinisolujen värjäytyminen (solulohko, immunohistokemia,x400).
Kokovartalokohtainen 111indium-oktreotidipisteytys oli negatiivinen somatostatiinireseptoreille.
Laboratoriokokeissa ei havaittu poikkeavia löydöksiä eikä kasvainmerkkiaineita, kuten karsinoembryonista antigeenia (CEA), alfa-fetoproteiinia (AFP) ja CA 19-9:ää (15 U/ml). Seerumin glukagoni-, gastriini- ja somatostatiinipitoisuudet olivat 77,2 pg/ml (viitealue: 30-210 pg/ml), 20 pg/ml (viitealue: 0-110 pg/ml) ja 19,3 pg/ml (viitealue: 5-27 pg/ml). Monimuotoisen endokriinisen neoplasiatyypin 1 oireyhtymän (MEN-1) poissulkemiseksi mitattiin seuraavat seerumin hormonipitoisuudet: parathormoni (PTH) ehjä (82,4 pg/ml; viitealue: 15-65 pg/ml), trijodityroniini (T3: 0,9 ng/ml; viitealue: 0.7-1,5 ng/ml), tyroksiini (T4: 7,4 μg/dl; viitealue: 4,5- 12 μg/dl), kilpirauhasta stimuloiva hormoni (TSH: 1,8 μIU/ml; viitealue: 0,4-4,5 μIU/ml), vapaan tyroksiinin indeksi, (FTI: 9,7μg/dl; viitealue: 6,3- 12,4μg/dl). Aivolisäkkeen magneettikuvaus oli merkityksetön.
Edellä mainittujen tulosten perusteella epäiltiin ei-toimivaa endokriinistä kasvainta ja tehtiin distaalinen haimatulehdus, johon liittyi pernanpoisto. Leikkausnäytteessä oli pyöreä, hyvin rajattu, sileä, tummanpunainen, halkaisijaltaan 1 cm:n kokoinen kyhmy, jota ympäröi haimakudos. Huolellisen leikkelyn jälkeen ei todettu muita vaurioita. Mikroskooppisesti kyhmy oli rakenteeltaan pernan kaltainen. Näin ollen massa diagnosoitiin IPAS:ksi (kuvat 4 ja 5). Kahdeksan imusolmuketta, jotka tunnistettiin pernan hilumissa, olivat hyvänlaatuisia.
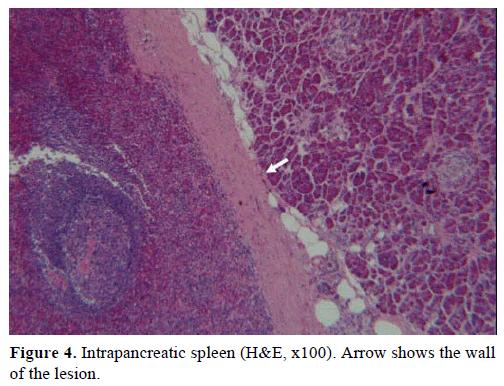
Kuvio 4. Kahdeksan imusolmuketta. Pernan sisäinen perna (H&E, x100). Nuoli osoittaa vaurion seinämää.
Kuva 5. Perna, valkoinen ja punainen massa (H&E, x100).
KESKUSTELU
Ektooppinen pernakudos voidaan luokitella kahteen luokkaan: pernakudoksen autotransplantaatiosta johtuvaan pernarakkuloosiin (tavallisesti pernanpoistoleikkauksen jälkeen tapahtuvaan pernan autosiirtoon) ja akkseptorisiin pernoihin (accessorisiin pernoihin), jotka ovat pernan päärungosta erillään sijaitsevia, terveiden terveiden pernakudoskudoskasojen synnynnäisiä pesäkkeitä . Embryologisesti perna on peräisin mesenkymaalisesta kudoksesta, joka sijaitsee selän mesogastrium-kerrosten välissä. Perna on 6.-8. elinviikon aikana mesonefronin kefaalisimman jatkeen läheisyydessä. Pernan sulautumisen jälkeen ylimääräinen perna voi sijaita pararenaalisesti ja retroperitoneaalisesti tai se voi laskeutua lantioon tai kivespussiin . Bruttotutkimuksessa IPAS:n ympärillä on yleensä fibroottinen kapseli, joka erottaa sen viereisestä haiman parenkyymista. Sen histologia on samanlainen kuin ortotooppisen pernan . Pernaa koskevat vauriot tai prosessit, kuten hemosideroosi, leukemia, lymfooma ja hypersplenismi, voivat vaikuttaa pernan lisäkudokseen. Näin ollen haiman radiologisessa tutkimuksessa osoitettujen nodulaaristen tihentymien erotusdiagnostiikassa olisi harkittava huolellista apupernan etsintää .
IPAS:n olemassaoloa olisi harkittava, kun haimamassan CT-tiheydet ja/tai MRI-signaalien intensiteetit ovat samankaltaisia kuin pernan kaikkien kuvantamismenetelmien prekontrasti- ja kontrastia vahvistavissa kuvissa. Erityisesti IPAS:n epäyhtenäinen vahvistuminen sen alkuvaiheessa voi olla diagnostinen vihje. Pernan verenkierron osoittaminen angiografisesti voi olla hyödyllistä haiman tai lisämunuaisen kasvaimen poissulkemisessa .
Pankreakensisäisten ja -peri-pankreaksen liitännäispernojen erotusdiagnostiikkaan voivat kuulua haiman neuroendokriiniset kasvaimet, lymfaepiteelikystat, lymfoomat, hypervaskulaariset metastaasit, kiinteät pseudopapillaariset kasvaimet ja haiman adenokarsinoomat . Tällä hetkellä ei ole olemassa kliinisiä tai radiologisia kriteerejä IPAS:n diagnosoimiseksi tai erottamiseksi pahanlaatuisesta kasvaimesta .
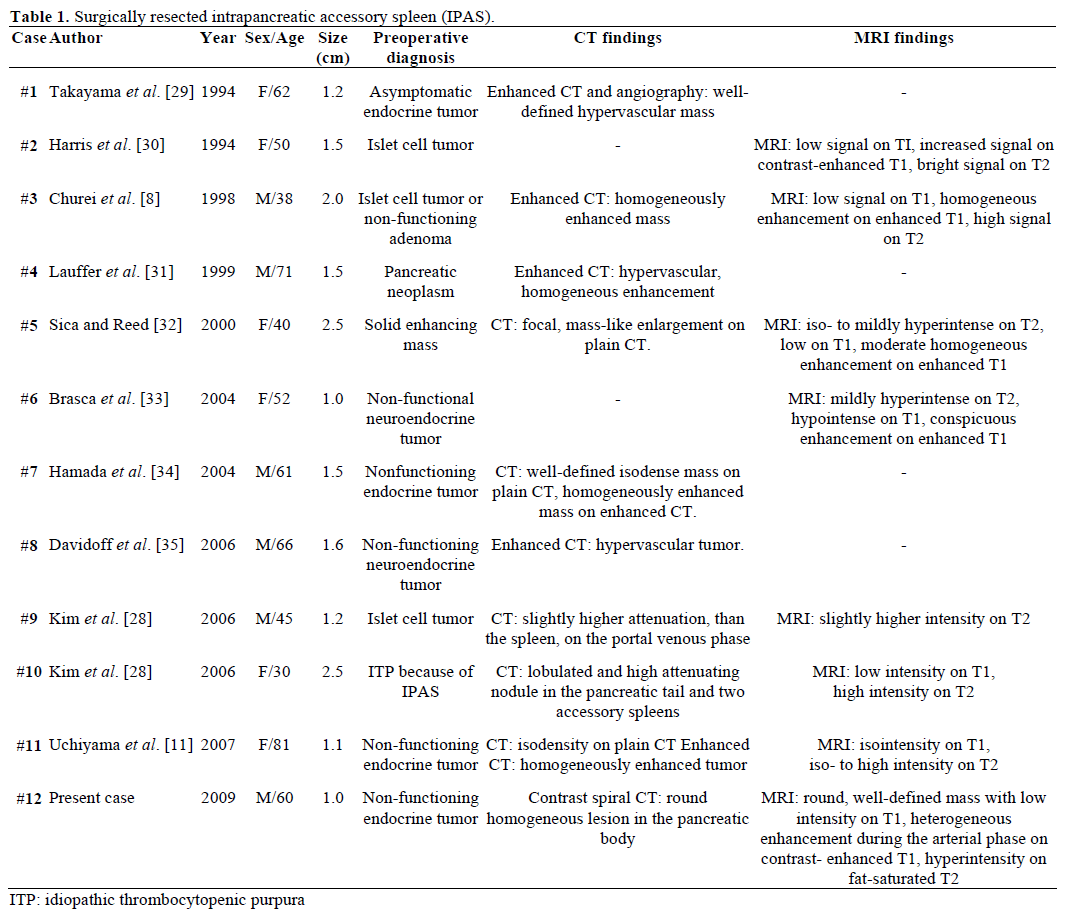
Viitattujen, kirurgisesti leikattujen ja patologisesti vahvistettujen IPAS:ien radiologiset löydökset ja preoperatiivinen diagnoosi on esitetty yhteenvetona taulukossa 1. Useimpia tapauksia pidettiin alun perin ei-toimivina endokriinisina kasvaimina tai saarekesolukasvaimina, ja vain yksi kahdestatoista tapauksesta diagnosoitiin lopullisesti preoperatiivisesti IPAS:ksi sen jälkeen, kun idiopaattisen trombosytopeenisen purppuran (ITP) toistuva kirurginen hoito oli epäonnistunut. Koko vaihteli 1,0-2,5 cm:n välillä, keskiarvon ollessa 1,55 cm . Toimimattomat endokriiniset kasvaimet muodostavat 15-41 prosenttia endokriinisistä haimakasvaimista, ja niiden pahanlaatuisten muutosten osuus on 62-92 prosenttia kasvaintyypistä riippuen . Kasvaimen täydellinen resektio on pitkän aikavälin eloonjäämisen perimmäinen ennustaja riippumatta koosta, sijainnista, histologisesta erilaistumisesta, imusolmukkeiden mukanaolosta ja muista parametreista .
Koska ei ole määritetty raja-arvoa, jonka avulla voitaisiin erottaa toisistaan pahanlaatuiset ja hyvänlaatuiset, ei-toimivat neuroendokriiniset haimakasvaimet, on ehdotettu, että kaikki tällaiset yli 1 cm:n kokoiset kasvaimet tulisi poistaa, jos potilas on hyvä leikkauskandidaatti .
Harmaasävyisessä perusultraäänitutkimuksessa IPAS nähdään yleensä pyöreänä tai soikeana massana, jolla on lievästi echogeeninen ja homogeeninen rakenne, jota ympäröi korkean amplitudin rajapinta ja jossa näkyy tehostumista vaurion takana. Väri- tai tehodoppler-ultraäänitutkimuksessa tyypillisen verenkierron (joka edustaa massan sisään tulevaa verisuonten hilaa) on raportoitu tarjoavan 90 prosentin herkkyyden IPAS:n diagnosoinnissa. Levovist®-valmistetta (Schering, Berliini, Saksa) käyttävässä kontrastivahvistetussa ultraäänitutkimuksessa (CEUS) IPAS:ssä näkyy epähomogeenista tehostumista varhaisessa verisuonivaiheessa, pernan kaltaista tehostumista verisuonivaiheen jälkeisessä vaiheessa ja pitkittynyttä tehostumista hepatosplenisessa parenkyymivaiheessa .
EUS:ssa havaitaan pyöreä tai soikea leesio, jolla on terävät säännölliset reunat ja homogeeninen kaikukuvausrakenne, joka vaihtelee hypo- ja hyperkaikuisuudesta . EUS-ohjattu FNA-sytologia paljastaa pääasiassa pienten lymfosyyttien populaation ja sekalaisen tulehdusinfiltraatin, joka edustaa valkoista massaa. Lisäksi havaitaan selvä verisuonikomponentti, joka koostuu ohutseinäisistä verisuonista, jotka edustavat pernan sivuonteloita. Nämä sinukset näkyvät hyvin solunsalpausleikkauksissa. Mielenkiintoista on, että paksuille pernan sivuonteloiden endoteelisoluille on ominaista CD8:n immunovärjäytyminen, joka tunnetaan yleisemmin T-solujen merkkiaineena. Värjäytyminen näyttää olevan spesifistä, koska systeemiset endoteelisolut ja hemangioomat ovat negatiivisia CD8:lle. Tapauksissa, joissa ylimääräisen pernan FNA:sta saadaan vain lymfosyyttejä ilman muita pernan osia, virtaussytometriaa ja immunohistokemiaa voidaan käyttää lymfoproliferatiivisen sairauden, kuten Hodgkinin lymfooman, poissulkemiseksi, vaikka lopullista diagnoosia ylimääräisestä pernasta ei voida vahvistaa. Schreiner ja muut raportoivat kolmesta IPAS-tapauksesta, jotka diagnosoitiin EUS-ohjatulla FNA-biopsialla . Meidän tapauksessamme, luultavasti viereisestä haiman parenkyymistä otettujen saarekesoluryhmien näytteenoton vuoksi, sama toimenpide viittasi neuroendokriiniseen kasvaimeen, mikä johti kirurgiseen ylihoitoon.
Samankaltaisesta väärästä positiivisesta EUS-FNA:sta, jossa haiman pernan kyhmy luultiin erehdyksessä saarekesolukasvaimeksi, ovat raportoineet myös Ardengh ym . Yleisesti ottaen EUS-FNA:n herkkyys ja spesifisyys haiman neuroendokriinisille kasvaimille on korkea (80-90 %), vaikka sen tarkkuutta tällaisten kasvainten osalta pidetään alhaisempana kuin haiman adenokarsinooman osalta . Diagnoosivirheiden minimoimiseksi pienten neuroendokriinisten kasvainten EUS-FNA:n olisi oltava kokeneen endoskopistin suorittama, ja sytopatologinen arviointi olisi yhdistettävä immunohistokemiaan .
99mTechnetium lämpövaurioituneet punasolut (99mTc- HDRBC) -skintigrafia yhdistettynä yhden fotoniemissiotietokonetomografiaan (SPECT) on erittäin herkkä ja spesifinen menetelmä pernakudoksen havaitsemiseksi, koska jopa 90 % injektoiduista HDRBC:stä jää tämän kudoksen vangiksi . Vaikka skintigrafia mahdollistaa pernan valikoivan visualisoinnin erinomaisella pernan ja maksan suhteella, pernan visualisointi on silti vaikeaa olosuhteissa, joissa pernakudos on vain vähän toimiva, kuten tapauksissa, joissa perna on ylimääräinen . Lisäksi skintigrafiassa, jopa SPECT:n kanssa, on huonompi alueellinen erotuskyky kuin muissa poikkileikkauskuvantamismenetelmissä, kuten tietokonetomografiassa tai magneettikuvauksessa. Siksi skintigrafiaa käytetään usein yhdessä muiden poikkileikkauskuvantamismenetelmien kanssa. Lisäksi superparamagneettisella rautaoksidilla (SPIO) tehostettu magneettikuvaus on raportoitu erinomaiseksi vaihtoehdoksi 99mTc-HDRBC-skintigrafialle, kun IPAS:n signaalipudotus on samanlainen kuin pernassa. Viitatun signaalipudotuksen lisäksi toinen ero IPAS:n ja hypervaskulaaristen haiman kasvainten välillä on heterogeeninen tehostuminen valtimovaiheen tietokonetomografiassa.
Aksessoriset pernat voivat tarvita kirurgista hoitoa, kun ne jäljittelevät lymfadenopatioita tai kasvaimia tai kun ne tulevat oireellisiksi vääntymisen, spontaanin repeämisen, verenvuodon tai kystan muodostumisen vuoksi. Kaikki toiminnallinen pernakudos olisi myös poistettava hematologisten sairauksien, kuten ITP:n, hoitoa varten.
Johtopäätöksenä voidaan todeta, että nykyaikaiset kuvantamistekniikat johtavat todennäköisesti siihen, että tulevaisuudessa löydetään yhä enemmän haiman sisäisiä ylimääräisiä pernoja, mikä asettaa merkittäviä diagnostisia ja terapeuttisia haasteita. Tällaisissa tapauksissa olisi käytettävä kaikkia ei-invasiivisia diagnostisia keinoja, jotta vältettäisiin tarpeettomat kirurgiset toimenpiteet ja vähennettäisiin potilaiden kokonaissairastavuutta.
Esintressiristiriita
Kirjoittajilla ei ole mahdollisia eturistiriitoja
- Halpert B, Gyorkey F. Lesions observed in accessory spleens of 311 patients. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. Lisäsylkirauhaset haiman hännässä tai sen kohdalla: Tutkimus 2700 ylimääräisestä nekropsiasta. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapancreatic accessory spleen: löydökset MR-kuvauksessa, CT:ssä, US:ssa ja skintigrafiassa sekä patologinen analyysi. Korean J Radiol 2008; 9:162-74.
- Moore K. Kehittyvä ihminen. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Panos ektooppisen pernakudoksen embryologiaan, topografiaan ja patologiaan. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoidinen pernakysta, joka esiintyy haiman sisäisessä apupernassa. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. Haiman päässä sijaitseva ylimääräinen perna. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreatic accessory spleen: case report. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Intrapancreatic accessory spleen mimicking pancreatic mass on CT. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikaali pancreatoduodenektomia väärin diagnosoidun haimamassan vuoksi. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapancreatic accessory spleen mimicking endocrine tumor of the pancreas: case report and review of the literature. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPoomat ja ei-toimivat endokriiniset haimakasvaimet: Kliininen esitys, diagnoosi ja hoidon edistyminen. In: Mignon M, Jensen RT, eds. Endocrine Tumors of the Pancreas: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Sveitsi: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. Haiman pahanlaatuiset ei-toimivat endokriiniset kasvaimet: kirurgisen hoidon jälkeistä eloonjäämistä ennustavat tekijät. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. Surgery of resectable nonfunctioning neuroendocrine pancreatic tumors. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. Lisääntyvän pernan sonografia. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Kontrastinvahvistettu sonografia intrapancreatic accessory spleenistä kuudella potilaalla. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Accessory spleen: mahdollinen syy virheelliseen diagnoosiin EUS:ssa. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracic splenosis diagnosed by fineneedle aspiration cytology: a case report. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Tapauksen diagnosointi hienoneulaspiraatiosytologian avulla. Acta Cytol 1988; 32:91-3.
- Kraus MD. Pernan histologia ja histopatologia: päivitys. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. Tapausselostus. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Diagnosis of deep-seated lymphoma and leukemia by endoscopic ultrasound-guided fine-needle aspiration biopsy. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreatic accessory spleen: mimic of pancreatic endocrine tumor diagnosed by endoscopic ultrasound-guided fine-needle aspiration biopsy. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-ohjattu FNA haiman neuroendokriinisten kasvainten diagnostiikassa ennen leikkausta. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT- ja superparamagneettisella rautaoksidilla (SPIO) tehostettu magneettikuvaus (MDCT and superparamagnetic iron oxide (SPIO)-enhanced MR findings of intrapancreatic accessory spleen in seven patients. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreatic accessory spleen. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. Haiman häntään massan aiheuttava aksiorinen perna: MR-kuvantamislöydökset. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapancreatic accessory spleen.A rare cause of pancreatic mass. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreatic accessory spleen. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreatic accessory spleen mimicking a neuroendocrine tumor: magneettiresonanssilöydökset ja erilaisten ydinlääketieteellisten testien mahdollinen diagnostinen merkitys. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoskooppinen pernaa säästävä haiman hännän resektio ei-toimivaa endokriinistä kasvainta jäljittelevän intrapancreatisen akksessorisen pernan vuoksi: tapauskuvaus. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Clinical challenges and images in GI. Intrapancreatic accessory spleen mimicking nonfunctioning neuroendocrine tumor. Gastroenterology 2006; 131:350, 689.