Keywords
Endoszonográfia; Neuroendokrin tumorok; Pancreatectomia
Abbreviations
HDRBC: heat-damaged red blood cell; IPAS: intrapancreatic accessory spleen; ITP: idiopathic thrombocytopenic purpura; SPECT: SPIO: szuperparamágneses vas-oxid
BEVEZETÉS
Ektopikus járulékos lépszövet bárhol megtalálható a lépi erek mentén, a jejunum falában, a mesenteriumban, a nagyobb omentumban, a kismedencében vagy a bal scrotumban. Bár radiológiailag ritkán észlelhető, viszonylag gyakori, a boncolási vizsgálatok szerint a lakosság körülbelül 10%-ánál fordul elő. A járulékos lépek az esetek 80%-ában a lép hilumban vagy annak közelében helyezkednek el. Az esetek fennmaradó részében a hasnyálmirigy farkában vagy annak közelében fordul elő. A járulékos lépek általában nem jelentenek klinikai veszélyt, és a jelenleg fejlett képalkotó eljárások radiológiai leletei hasznos diagnosztikai eszközök a műtét elkerülése érdekében . Az egyetlen biztonságos diagnosztikai módszer a közvetlen mintavétel, kivéve, ha az tévesen hasnyálmirigy-szigetsejteket eredményez, mint esetünkben. Ebben a beszámolóban egy műtétileg kezelt intrapancreaticus járulékos lép (IPAS) esetét elemezzük, amely radiológiailag és citológiailag egy neuroendokrin hasnyálmirigydaganatot utánzott.
ESETISMERTETÉS
Egy 60 éves kaukázusi férfit utaltak klinikánkra további kivizsgálás és kezelés céljából egy véletlenszerű, a hasnyálmirigy testében lévő szoliter tömeg miatt, amely endokrin tumort utánzott. A rutinvizsgálat során a betegnél a szénhidrát antigén (CA) 19-9 enyhe, 40 U/ml-re emelkedett (referencia tartomány: 0-37 U/ml). A kontrasztanyagos spirális komputertomográfia (CT) a hasnyálmirigytest felső részén elhelyezkedő, 1,2 cm átmérőjű, kerek, homogén elváltozást mutatott (1. ábra).
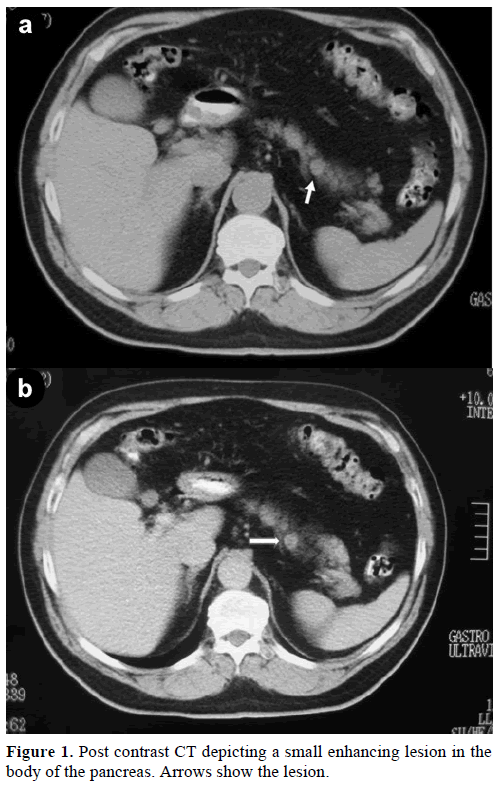
1. ábra. Kontrasztanyag utáni CT, amely a hasnyálmirigy testében lévő kisméretű, fokozódó elváltozást ábrázolja. A nyilak mutatják az elváltozást.
A kontrasztos mágneses rezonanciás képalkotás (MRI) kerek, jól körülhatárolt, 1 cm átmérőjű tömeget mutatott, alacsony jelintenzitással a T1-súlyozott felvételeken, heterogén elváltozás fokozódással az artériás fázisban a gadoliniummal dúsított T1-súlyozott felvételeken és hiperintenzitással a zsírral telített T2-súlyozott felvételeken (2. ábra).
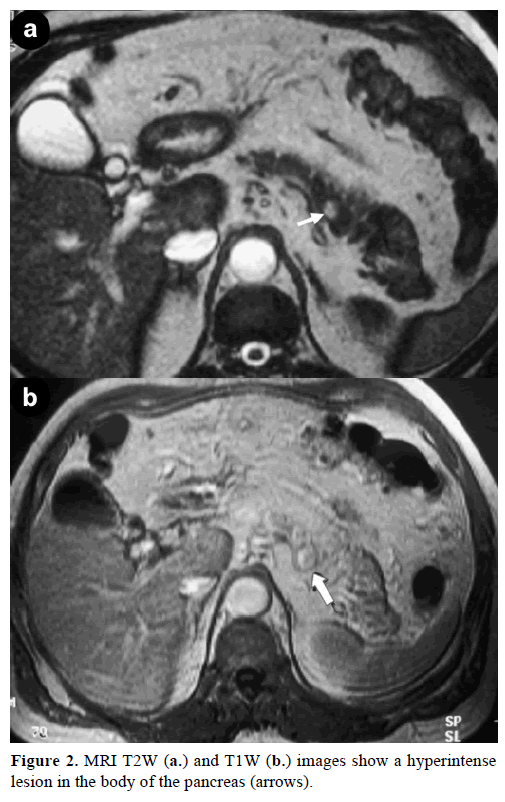
2. ábra. Az MRI T2W (a.) és T1W (b.) felvételek a hasnyálmirigy testében lévő hiperintenziont mutatnak (nyilak).
Az endoszkópos ultrahangvizsgálat (EUS) jól körülhatárolt, körülbelül 1,2 cm méretű, viszonylag homogén, jól körülhatárolt és sima peremű, fokozott vérellátású és vegyes echogenitású csomót mutatott. Ezek a jellemzők összeegyeztethetők voltak egy neuroendokrin tumorral. A csomó a hasnyálmirigy testében helyezkedett el, közvetlenül perifériásan a cöliákiás törzstől és a hasnyálmirigyvezeték és a gyomorfal között. Regionális nyirokcsomókat vagy más patológiai leletet nem észleltek.
Egy EUS-vezetett finom tűs aspirációs (FNA) biopszia különböző méretű, kromograninra, glükagonra, gasztrinra és szomatosztatinra immunpozitív sejtcsomókat eredményezett, a Ki-67 proliferációs index 2%-nál kisebb volt; ezek a leletek morfológiailag és immunhisztokémiailag neuroendokrin neoplazmára voltak jellemzőek (3. ábra).
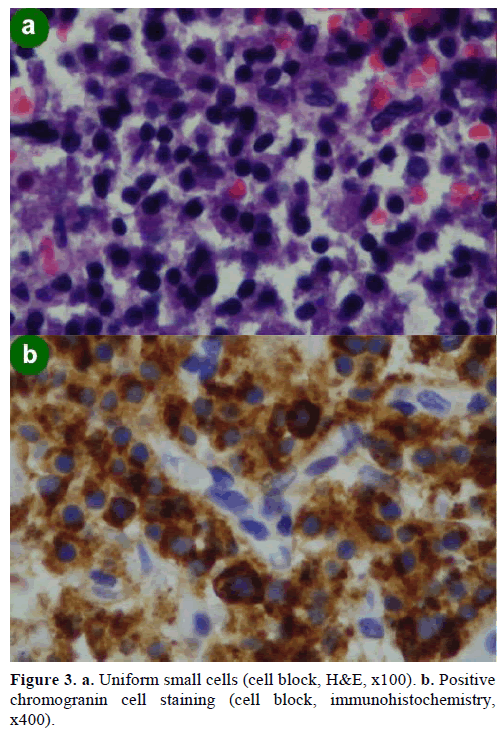
3. ábra. a. Egyenletes kis sejtek (sejtblokk, H&E, x100). b. Pozitívchromogranin sejtfestés (sejtblokk, immunhisztokémia,x400).
A teljes test 111indium-oktreotid szcintigráfia negatív volt szomatosztatinreceptorokra.
A laboratóriumi vizsgálatok nem mutattak ki kóros leletet, sem tumormarkereket, mint a karcinoembryonális antigén (CEA), alfa-fetoprotein (AFP) és CA 19-9 (15 U/ml). A glükagon, a gasztrin és a szomatosztatin szérumszintje 77,2 pg/ml (referencia tartomány: 30-210 pg/ml), 20 pg/ml (referencia tartomány: 0-110 pg/ml), illetve 19,3 pg/ml (referencia tartomány: 5-27 pg/ml) volt. Az 1-es típusú multiplex endokrin neoplázia szindróma (MEN-1) kizárása érdekében a következő szérum hormonszinteket mértük: parathormon (PTH) ép (82,4 pg/ml; referencia tartomány: 15-65 pg/ml), trijódtironin (T3: 0,9 ng/ml; referencia tartomány: 0.7-1,5 ng/ml), tiroxin (T4: 7,4 μg/dL; referenciatartomány: 4,5- 12 μg/dL), pajzsmirigy-stimuláló hormon (TSH: 1,8 μIU/ml; referenciatartomány: 0,4-4,5 μIU/ml), szabad tiroxin index, (FTI: 9,7μg/dL; referenciatartomány: 6,3- 12,4μg/dL). Az agyalapi mirigy MRI-je nem volt feltűnő.
A fenti eredmények alapján nem működő endokrin tumorra gyanakodtak, és disztális pancreatectomiát végeztek lépeltávolítással. A műtéti minta egy kerek, jól körülhatárolt, sima, sötétvörös színű, 1 cm átmérőjű csomót tartalmazott, amelyet hasnyálmirigyszövet vett körül. Az aprólékos metszést követően durván más elváltozást nem azonosítottak. Mikroszkóposan a csomó a lép szerkezetét mutatta. Így a csomót IPAS-nak diagnosztizálták (4. és 5. ábra). A lép hilumában azonosított nyolc nyirokcsomó jóindulatú volt.
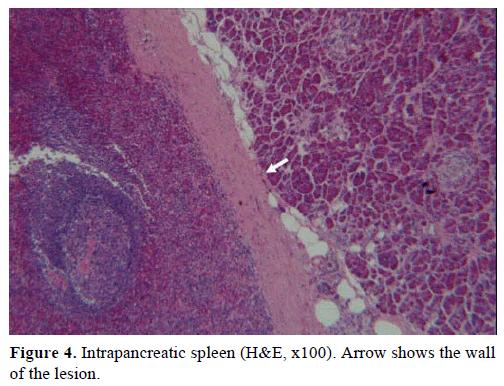
4. ábra. Intrapancreaticus lép (H&E, x100). A nyíl az elváltozás falát mutatja.
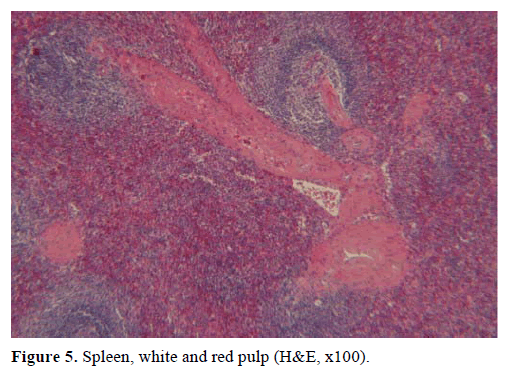
5. ábra. Lép, fehér és vörös pulpa (H&E, x100).
DISZKURZUS
Az ektopikus lépszövetet két kategóriába sorolhatjuk: a lépszövet autotranszplantációjából eredő splenosis (általában lépeltávolítás után) és a járulékos lépek, amelyek a lép főtestétől elválasztott egészséges lépszövet veleszületett fókuszait alkotják . Embriológiai szempontból a lép a háti mezogasztrium rétegei között elhelyezkedő mesenchymális szövetből származik. Az élet 6-8. hete alatt a lép a mezonefrosz legfejlettebb nyúlványához közel helyezkedik el. A lépfészek fúziója után a járulékos lép pararenálisan és retroperitoneálisan található, vagy a medencébe vagy a herezacskóba ereszkedhet. A durva vizsgálat során az IPAS-t általában fibrotikus kapszula veszi körül, amely elválasztja a szomszédos hasnyálmirigy-parenchimától. A szövettan hasonlít az ortotópos léphez . A lépet érintő elváltozások vagy folyamatok, mint például a hemosiderosis, a leukémia, a limfóma és a hipersplenizmus érinthetik a járulékos lépszövetet. Ezért a hasnyálmirigy radiológiai vizsgálatával kimutatott csomós sűrűségek differenciáldiagnózisában gondosan meg kell keresni a járulékos lépet .
Az IPAS meglétére akkor kell gondolni, ha a hasnyálmirigy tömegének CT-sűrűsége és/vagy MRI jelintenzitása a lépéhez hasonló, az összes képalkotó modalitás prekontraszt és kontrasztos képén. Különösen az IPAS inhomogén fokozódása a korai fázisokban jelenthet diagnosztikai támpontot. A lép vérellátásának angiográfiás kimutatása hasznos lehet a hasnyálmirigy- vagy mellékvese-tumor kizárásában .
A hasnyálmirigyben és a hasnyálmirigy körül elhelyezkedő járulékos lépek differenciáldiagnózisa lehet a hasnyálmirigy neuroendokrin tumorok, nyiroksejtes ciszták, limfómák, hipervaszkuláris metasztázisok, szolid pszeudopapilláris tumorok és hasnyálmirigy adenokarcinómák . Jelenleg nincsenek klinikai vagy radiológiai kritériumok az IPAS diagnózisára vagy malignitástól való megkülönböztetésére .
A beutalt, sebészileg reszekált és patológiailag igazolt IPAS radiológiai leleteit és preoperatív diagnózisát az 1. táblázat foglalja össze. A legtöbb esetet kezdetben nem funkcionáló endokrin tumornak vagy szigetsejtes daganatnak tekintették, és csak minden tizenkettedik esetből egyet diagnosztizáltak véglegesen preoperatívan IPAS-ként, miután az idiopátiás trombocitopéniás purpura (ITP) sikertelen ismétlődő sebészeti kezelése után. A méret 1,0 és 2,5 cm között mozgott, az átlagérték 1,55 cm volt . A nem funkcionáló endokrin tumorok az endokrin hasnyálmirigy-tumorok 15-41%-át teszik ki, és rosszindulatú átalakulásuk aránya 62-92%, a tumor típusától függően . A tumor teljes reszekciója a hosszú távú túlélés végső előrejelzője, függetlenül a mérettől, a lokalizációtól, a szövettani differenciáltságtól, a nyirokcsomók érintettségétől és más paraméterektől .
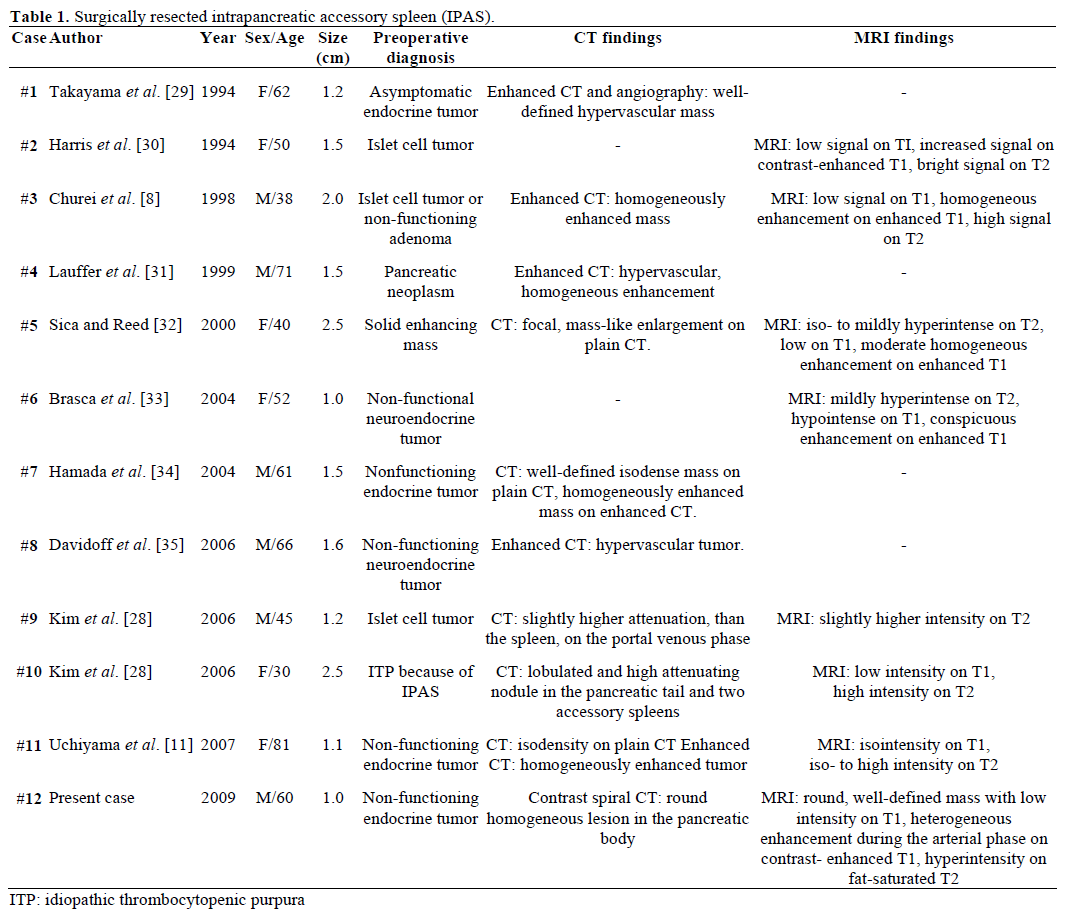
Mivel nem állapítottak meg határméretet a hasnyálmirigy rosszindulatú és jóindulatú nem funkcionális neuroendokrin tumorainak megkülönböztetésére, azt javasolták, hogy minden ilyen, 1 cm-nél nagyobb tumort ki kell vágni, ha a beteg jó jelölt a műtétre .
A szürkeárnyalatos alapszintű ultrahangon az IPAS általában kerek vagy ovális, enyhén echogén és homogén textúrájú tömegként látható, amelyet nagy amplitúdójú határfelület vesz körül, és az elváltozás mögött enhancementet mutat. Színes vagy power Doppler ultrahangon a jellegzetes vérellátás (amely a tömegbe belépő vaszkuláris hilumot képviseli) a jelentések szerint 90%-os érzékenységet biztosít az IPAS diagnózisában. A Levovist® (Schering, Berlin, Németország) kontrasztanyaggal megerősített ultrahangvizsgálat (CEUS) során az IPAS inhomogén erősödést mutat a korai érfázisban, a léphez hasonló erősödést a posztvaszkuláris fázisban és hosszan tartó erősödést a hepatosplenikus parenchymális fázisban .
Az EUS-en a kerek vagy ovális elváltozás éles, szabályos peremekkel és homogén, hipo- és hiper-echós textúrával . Az EUS-vezetett FNA-citológia túlnyomórészt kisméretű limfociták populációját és vegyes gyulladásos infiltrátumot mutat, amely a fehér pulpát képviseli. Megfigyelhető egy feltűnő, vékonyfalú erekből álló vaszkuláris komponens is, amely a lépszinuszokat képviseli … Ezek a szinuszok jól láthatóak a sejtblokkmetszeteken. Érdekes módon a puffadt lépszinuszok endotélsejtjei jellemzően a CD8 immunfestékkel rendelkeznek, amelyet általában T-sejt markerként ismernek fel. A festődés specifikusnak tűnik, mivel a szisztémás endotélsejtek és a hemangiomák negatívak a CD8-ra . Azokban az esetekben, amikor a járulékos lép FNA-ján csak limfociták találhatók, más lépelemek nélkül, áramlási citometria és immunhisztokémia alkalmazható a lymphoproliferatív rendellenesség, beleértve a Hodgkin-limfómát is, kizárására, még akkor is, ha a járulékos lép végleges diagnózisa nem erősíthető meg . Schreiner és munkatársai három olyan esetről számoltak be, amikor az IPAS-t EUS-vezetett FNA-biopsziával diagnosztizálták . Esetünkben – valószínűleg a szomszédos hasnyálmirigy-parenchimából származó szigetsejt-klaszterek mintavétele miatt – ugyanez az eljárás neuroendokrin daganatot jelzett, ami sebészi túlkezeléshez vezetett.
A hasonló téves pozitív EUS-FNA-ról, amelyben egy hasnyálmirigy lépcsőgumót tévesen szigetsejtes daganatnak véltek, Ardengh és munkatársai is beszámoltak . Általánosságban elmondható, hogy az EUS-FNA magas (80-90%) érzékenységgel és specificitással rendelkezik a hasnyálmirigy neuroendokrin tumorok esetében, bár pontossága az ilyen tumorok esetében alacsonyabbnak tekinthető, mint a hasnyálmirigy adenokarcinóma esetében . A diagnosztikai hibák minimalizálása érdekében a kis neuroendokrin tumorok EUS-FNA-ját tapasztalt endoszkópos szakembernek kell elvégeznie, és a citopatológiai értékelést immunhisztokémiával kell kombinálni .
A 99mTechnetium hőkárosodott vörösvértestek (99mTc- HDRBC) szcintigráfia az egyfoton-emissziós komputertomográfiával (SPECT) kombinálva rendkívül érzékeny és specifikus módszer a lépszövet kimutatására, mivel az injektált HDRBC-k akár 90%-át ez a szövet csapdába ejti . Bár a szcintigráfia lehetővé teszi a lép szelektív vizualizálását kiváló lép-máj arány mellett, a lép vizualizálása még mindig nehéz olyan körülmények között, amikor minimálisan működő lépszövet van jelen, mint a járulékos lépek esetében . Ezenkívül a szcintigráfia, még SPECT-vel együtt is, rosszabb térbeli felbontást biztosít más keresztmetszeti képalkotó eljárásokhoz, például a CT-hez vagy az MRI-hez képest. Ezért a szcintigráfiát gyakran más keresztmetszeti képalkotó eljárásokkal együtt alkalmazzák. Ezenkívül a szuperparamágneses vas-oxid (SPIO)-erősített MRI a 99mTc-HDRBC szcintigráfia kiváló alternatívájaként szerepel, ha az IPAS jelcsökkenése hasonló a lépéhez. Az említett jelcsökkenés mellett az IPAS-ok és a hypervaszkuláris hasnyálmirigy-neoplazmák közötti másik különbség az artériás fázisú CT-vizsgálat heterogén fokozódása .
Az akcesszív lépek sebészeti kezelést igényelhetnek, ha nyirokadenopátiát vagy tumort imitálnak, vagy ha torzió, spontán ruptúra, vérzés vagy cisztaképződés miatt tüneteket okoznak. Minden funkcionális lépszövetet el kell távolítani a hematológiai rendellenességek, például az ITP kezeléséhez is.
Összefoglalva, a modern képalkotó technikák valószínűleg ahhoz vezetnek, hogy a jövőben egyre több intrapancreaticus járulékos lépet fedeznek fel, ami jelentős diagnosztikai és terápiás kihívást jelent. Ilyen esetekben minden nem invazív diagnosztikai eszközt fel kell használni a szükségtelen műtéti beavatkozások elkerülése és a betegek általános morbiditásának csökkentése érdekében.
Interdekütközés
A szerzőknek nincs potenciális érdekellentétük
- Halpert B, Gyorkey F. 311 beteg járulékos lépében megfigyelt elváltozások. Am J Clin Pathol 1959; 32:165-8.
- Halpert B, Alden ZA. A hasnyálmirigy farkában vagy farkánál lévő járulékos lépek: További 2700 nekropszia felmérése. Arch Pathol 1964; 77:652-4.
- Kim SH, Lee JM, Han JK, Lee JY, Kim KW, Cho KC, Choi BI. Intrapancreaticus járulékos lép: MR-, CT-, US- és szcintigráfiás leletek és a patológiai elemzés. Korean J Radiol 2008; 9:162-74.
- Moore K. A fejlődő ember. Philadelphia: Saunders, 1986: 225-8.
- Weiand G, Mangold G. Accessory spleen in the pancreatic tail — a neglected entity? Hozzájárulás az ektopikus lépszövet embriológiájához, topográfiájához és patológiájához. Chirurg 2003; 74:1170-7.
- Davidson ED, Campbell WG, Hersh T. Epidermoid lépciszta intrapancreaticus járulékos lépben. Dig Dis Sci 1980; 25:964-7.
- Landry ML, Sarma DP. A hasnyálmirigy fejében lévő járulékos lép. Hum Pathol 1989; 20:497.
- Churei H, Inoue H, Nakajo M. Intrapancreaticus járulékos lép: esetismertetés. Abdom Imaging 1998; 23:191-3.
- Hayward I, Mindelzun RE, Jeffrey RB. Hasnyálmirigytömeget imitáló intrapancreaticus járulékos lép a CT-n. J Comput Assist Tomogr 1992; 16:984-5.
- Smith CD, Behrns KE, van Heerden JA, Sarr MG. Radikális pancreatoduodenectomia tévesen diagnosztizált hasnyálmirigytömeg miatt. Br J Surg 1994; 81:585-9.
- Uchiyama S, Chijiiwa K, Hiyoshi M, Ohuchida J, Imamura N, Nagano M, et al. Intrapancreaticus járulékos lép, amely a hasnyálmirigy endokrin tumorát utánozza: esetjelentés és az irodalom áttekintése. J Gastrointest Surg 2008; 12:1471-3.
- Eriksson B, Oberg K. PPomák és nem működő endokrin hasnyálmirigy-tumorok: Klinikai megjelenés, diagnózis és előrelépés a kezelésben. In: Mignon M, Jensen RT, szerk. A hasnyálmirigy endokrin daganatai: Recent Advances in Research and Management. Frontiers of Gastrointestinal Research. Basel, Svájc: Karger, 1995: 208-222.
- Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19:753-81.
- Chung JC, Choi DW, Jo SH, Heo JS, Choi SH, Kim YI. A hasnyálmirigy rosszindulatú, nem funkcionáló endokrin tumorai: a műtéti kezelést követő túlélés prediktív tényezői. World J Surg 2007; 31:579-85.
- Dralle H, Krohn SL, Karges W, Boehm BO, Brauckhoff M, Gimm O. A reszekábilis, nem funkcionáló neuroendokrin hasnyálmirigydaganatok sebészete. World J Surg 2004; 28:1248-60.
- Subramanyam BR, Balthazar EJ, Horii SC. A járulékos lép szonográfiája. AJR Am J Roentgenol 1984; 143:47-9.
- Kim SH, Lee JM, Lee JY, Han JK, Choi BI. Az intrapancreaticus járulékos lép kontraszterősített szonográfiája hat betegnél. AJR Am J Roentgenol 2007; 188:422-8.
- Barawi M, Bekal P, Gress F. Akcesszoros lép: a téves diagnózis lehetséges oka az EUS-ben. Gastrointest Endosc 2000; 52:769-72.
- Syed S, Zaharopoulos P. Thoracalis splenosis diagnosztizálva finomszemcsés aspirációs citológiával: esetismertetés. Diagn Cytopathol 2001; 25:321-4.
- Carlson BR, McQueen S, Kimbrell F, Humphreys S, Gentry HL, Esbenshade A. Thoracic splenosis. Egy eset diagnózisa finom tűs aspirációs citológiával. Acta Cytol 1988; 32:91-3.
- Kraus MD. A lép szövettan és szövettan: egy frissítés. Semin Diagn Pathol 2003; 20:84-93.
- Renne G, Coci A, Biraghi T, Schmid C. Fine needle aspiration of thoracic splenosis. Egy esetről szóló beszámoló. Acta Cytol 1999; 43:492-4.
- Pugh JL, Jhala NC, Eloubeidi MA, Chhieng DC, Eltoum IA, Crowe DR, et al. Mélyen fekvő limfómák és leukémiák diagnózisa endoszkópos ultrahangvezérelt finom tűs aspirációs biopsziával. Am J Clin Pathol 2006; 125:703-9.
- Schreiner AM, Mansoor A, Faigel DO, Morgan TK. Intrapancreaticus járulékos lép: endoszkópos ultrahangvezérelt finom tűs aspirációs biopsziával diagnosztizált hasnyálmirigy endokrin tumor mimikája. Diagn Cytopathol 2008; 36:262-5.
- Ardengh JC, de Paulo GA, Ferrari AP. EUS-vezetett FNA a hasnyálmirigy neuroendokrin tumorainak műtét előtti diagnosztikájában. Gastrointest Endosc 2004; 60:378-84.
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O’Toole D, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46:244-9.
- Ota T, Tei M, Yoshioka A, Mizuno M, Watanabe S, Seki M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT. J Nucl Med 1997; 38:494-5.
- Kim SH, Lee JM, Han JK, Lee JY, Kang WJ, Jang JY, et al. MDCT és szuperparamágneses vas-oxid (SPIO)-erősített MR leletek az intrapancreaticus járulékos lépről hét betegnél. Eur Radiol 2006; 16:1887-97.
- Takayama T, Shimada K, Inoue K, Wakao F, Yamamoto J, Kosuge T. Intrapancreaticus járulékos lép. Lancet. 1994; 344:957- 8.
- Harris GN, Kase DJ, Bradnock H, Mckinley MJ. A hasnyálmirigy farkában tömeget okozó járulékos lép: MR képalkotó leletek. AJR Am J Roentgenol 1994; 163:1120-1.
- Läuffer JM, Baer HU, Maurer CA, Wagner M, Zimmermann A, Büchler MW. Intrapancreaticus járulékos lép. a hasnyálmirigytömeg ritka oka. Int J Pancreatol 1999; 25:65-8.
- Sica GT, Reed MF. Intrapancreaticus járulékos lép. Radiology 2000; 217:134-7.
- Brasca LE, Zanello A, De Gaspari A, De Cobelli F, Zerbi A, Fazio F, Del Maschio A. Intrapancreaticus járulékos lép, amely neuroendokrin tumort imitál: mágneses rezonancia leletek és a különböző nukleáris medicina vizsgálatok lehetséges diagnosztikus szerepe. Eur Radiol. 2004; 14:1322-3.
- Hamada T, Isaji S, Mizuno S, Tabata M, Yamagiwa K, Yokoi H, Uemoto S. Laparoscopic spleen-preserving pancreatic tail resection for an intrapancreatic accessory spleen mimicking a nonfunctioning endocrine tumor: report of a case. Surg Today 2004; 34:878-81.
- Davidoff S, Fernandes A, Sideridis K, Gecelter G, Bragdon J, Bank S. Klinikai kihívások és képek a GI-ben. Intrapancreaticus járulékos lép, amely nem működő neuroendokrin tumort imitál. Gastroenterology 2006; 131:350, 689.